可循环利用的重金属离子吸附剂的制备与性能研究
余响林,方 红,黎俊波,黎汪周 叶春杰,吕 中,陈 嵘,余训民
(武汉工程大学绿色化工过程省部共建教育部重点实验室, 湖北 武汉 430074)
可循环利用的重金属离子吸附剂的制备与性能研究
余响林,方 红,黎俊波,黎汪周 叶春杰,吕 中,陈 嵘,余训民
(武汉工程大学绿色化工过程省部共建教育部重点实验室, 湖北 武汉 430074)
通过硅源和硅烷偶联剂的共缩聚,同时引入磁性四氧化三铁纳米颗粒合成出可循环利用的、吸附性能优异的新型介孔材料, 并且对材料吸附重金属离子的性能和可回收性能进行了系统研究。结果表明,引入氨基硅烷偶联剂的介孔吸附剂对Pb2+有很强的吸附能力,吸附率达到99%,而引入巯基硅烷偶联剂的介孔吸附剂吸附率可以达到97%,主要与氨基的强络合作用有关。对不同吸附材料进行吸附动力学研究的结果表明,SBA-NH2-0.5g对Pb2+和Cd2+吸附饱和时间均为30min,对Pb2+和Cd2+的吸附率分别为99%和97%,SBA-SH-0.5g对Pb2+和Cd2+吸附饱和时间均为180min,对Pb2+和Cd2+的吸附率分别为96%和93%,说明材料对Pb2+的吸附选择性较好,介孔材料即使经过5次脱附、吸附后,依然具有较强吸附重金属能力。
介孔材料;重金属离子;吸附;废水
随着工业生产和城市现代化的发展,环境污染越来越严重。由于水是人类赖以生存和发展的物质基础,因此水质污染的问题引起人们的高度关注。而重金属离子是水环境中的主要污染物之一,主要来自电镀、采矿、冶金、化工等工业,具有潜在的危害性,特别是汞、镉、铅、铬等重金属具有显著的生物毒性,微量浓度即可产生毒性[1-2]。同时,重金属离子在微生物作用可能转化为毒性更强的有机金属化合物(如甲基汞);或被生物富集,通过食物链进入人体,造成慢性中毒。因此,有效地去除废水中重金属已经成为当前迫切的任务。目前,处理重金属废水的主要方法有沉淀法[3]、电化学法[4]、吸附法[5]、膜分离法[6]、分子印记法[7]、光催化法[8]和超临界流体萃取法[9]等,其中沉淀法因为沉淀剂的加入容易造成二次污染,而且沉淀剂和环境条件都会影响出水质量;电化学法耗电量大,不太适合大批量处理;膜分离法虽然处理效率高,但是膜材料的处理成本也很高;分子印记法由于有机物的参与,给水质增加了新的污染物;光催化法是一种环境友好型的处理方法,但是成本较高,效率很低; 超临界流体萃取法虽然流程简单,萃取速度快,能耗低,后处理简单,但是成本太高,无法实现大规模废水的处理。吸附法因为操作简单、使用方便而成为废水处理最常用的方法,其中还衍生出了物理吸附法、树脂吸附法和生物吸附法。吸附法中最重要的是吸附剂的开发与选择。目前应用于工业废水处理的吸附剂[10]主要有活性炭、生物吸附剂和其他的一些尚处于实验室模拟阶段的吸附剂,如粘土类吸附剂、高分子吸附剂、利用废弃物制备的吸附剂和复合吸附剂。其中活性炭作为一种有效的水和废水处理吸附剂可用于大多数重金属、有机分子的除去且吸附能力强,但由于活性炭成本昂贵、工艺操作及管理较为复杂, 因而较难以在经济尚不发达的地区得到广泛的应用。其他吸附剂也都存在吸附效率低,易产生二次污染等问题,因此如何提高吸附剂的吸附效率、选择性和重复利用率、减少二次污染仍然是大批量处理工业废水中面临的严重挑战。目前,开发处理成本低、可再生,环境友好、性能优异的新型吸附材料是国内外研究的趋势。
介孔材料[12]由于具有很高的比表面积(大于1400m2/g)和大的孔容以及其组成可以灵活调节,可选择性的吸附气体、液体乃至键合金属离子。同传统的微孔吸附剂相比, 介孔材料对重金属离子有较高
的吸附能力,但是介孔材料的使用也存在一些问题,主要是对重金属离子的吸附容量低,不能够满足实际应用的需要,原因是因为吸附重金属的官能团不能够得到有效地的控制[13]。与接枝法相比,共缩聚法能有效地引入有机官能团[14-15],种类和数量都可以调控。为此,笔者拟用共缩聚法合成含不同有机官能团的介孔材料,同时在材料的合成中通过溶胶-凝胶法向体系中引入具有可循环利用性能的磁性纳米粒子四氧化三铁,制备具有可重复利用性、吸附官能团能够有效控制且吸附效率高的介孔吸附材料。
1 试验部分
1.1主要试剂与仪器
1)试剂 P123(EO20PO70EO20, Mw=5800), 德国BASF公司; 正硅酸四乙酯(TEOS),国药集团化学试剂有限公司; 3-氨丙基三乙氧基硅烷(APTES), 上海阿拉丁试剂公司; 3-巯基丙基三甲氧基硅烷(MPTMS), 上海阿拉丁试剂公司; 浓氨水, 开封东大化工有限公司试剂厂; 浓盐酸, 国药集团化学试剂有限公司; 无水乙醇, 国药集团化学试剂有限公司; P25, 广州华力森有限公司。试验所用原料均是分析纯, 可以直接使用不需要经过进一步纯化。
2)仪器 电子天平BT124S,德国赛多利斯(Sartorius); 离心机TG16-1,长沙平凡仪器有限公司; 真空干燥箱DZF-6030A,上海一恒科技有限公司; 磁力搅拌器ZNCL,巩义市予华仪器有限责任公司; 超声仪SB32000,宁波新芝生物科技有限公司。
1.2吸附剂的制备
称取4.0g P123溶于30g H2O中,加入120g 2mol/L 的HCl 溶液,在35℃下搅拌1h左右。然后滴加8.50g TEOS, 5g(APTES或者MPTMS)和一定量的Fe3O4纳米粒子。在35℃下搅拌20h后,停止搅拌,将混合物保持在80℃下放置一夜(加回流装置)。停止反应后,冷却,水洗至中性,再用乙醇洗2次,放入真空干燥箱中干燥, 样品用乙醇盐酸溶液索氏提取72h,得到含巯基或者氨基的介孔材料, 分别命名为SBA-NH2-X, SBA-SH-X, X代表Fe3O4纳米粒子的用量。
1.3测试与表征
1)透射电镜(TEM)表征 将样品分散在乙醇中制成浓度约0.1%(质量百分数)的悬浮液, 超声分散15min后, 滴于覆有碳膜的铜网上, 用JEOL JEM-100CX透射电镜在100kV的加速电压下观察介观结构。
2)X-射线衍射(XRD) 将样品研成粉末, 用Rigaku D/max-2500型广角X-射线衍射仪(WAXS)测定晶格参数。
3)红外光谱(FT-IR) 将样品与少量溴化钾混合研成粉末压片, Bruker Equinox 55 FT-IR红外光谱仪分析。
4)电感耦合等离子体发射光谱 (ICP-AES) 首先选定要检测的重金属元素,然后将液体清液从中心管直接导入试验装置中, 利用各元素波长位置的光电倍增管进行检测。
2 结果与讨论
2.1材料的表征
1)傅里叶红外图谱 从图1可以看出,与图1(a)曲线相比较,图1(b)曲线在1600cm-1波数处有一个微弱的吸收峰,对应于-NH2的吸收峰,可初步认定-NH2已成功加到SBA-15材料上。图1(c)曲线在2600cm-1波数左右发现有微弱的吸收峰,可初步认定-SH已加到SBA-15材料上。
2)粉末X射线衍射分析 图2为不同材料的XRD图,与曲线图2(a)相比,图2(b)、图2(c)、图2(d)曲线上都出现了Fe3O4的特征峰, 证明了Fe3O4的成功加入。而且随着Fe3O4加入量的增大, Fe3O4衍射峰的强度增大,因此可以通过调节Fe3O4的量来调节材料的磁性。
2.2材料的吸附性能研究
1)不同有机基团对吸附性能的影响 从表1可看出,加-NH2改性后的SBA-15比加-SH改性后的SBA-15对Pb2+和Cd2+的吸附能力强很多,而且加-NH2改性后的SBA-15对2种重金属离子的吸附率均很高,达到99%左右,可能是因为-NH2的络合能力比-SH强,因而其改性材料对重金属离子的吸附能力也比-SH改性材料强。

图1 不同介孔吸附材料的傅里叶红外图谱 图2 不同介孔吸附材料的XRD图
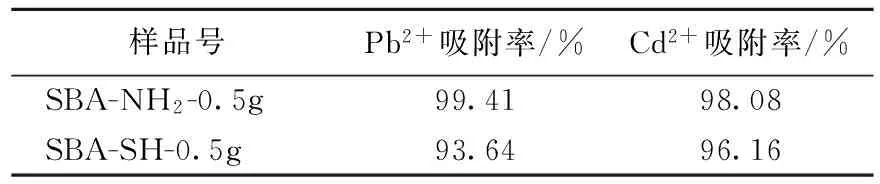
样品号Pb2+吸附率/%Cd2+吸附率/%SBA-NH2-0.5g99.4198.08SBA-SH-0.5g93.6496.16
2)不同改性方法对吸附性能的影响 为了与共缩聚法制备的材料对比,笔者同时通过接枝法得到了成分与共缩聚法类似的材料, 同时进行吸附性能的研究,从表2可以看出,共缩聚法制备的材料对Pb2+和Cd2+的吸附率均比接枝法制备的材料的吸附性能优越很多。从理论上来说[13],用共缩聚法制备得到的材料,其反应成功的有机基团数量应该大于接枝法制备的材料,有利于吸附更多的重金属离子,因此吸附率会提高。
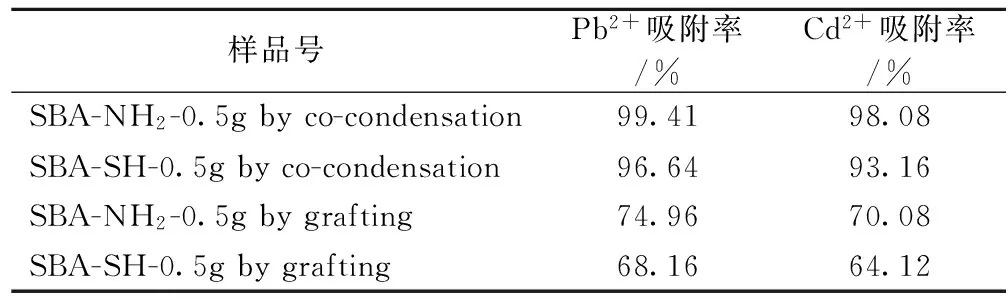
表2 接枝法和共缩聚法制备的介孔材料的吸附Pb2+和Cd2+的数据
3)不同材料的吸附动力学研究 从图3可以看出,在前20min的吸附时间里,溶液中重金属离子的浓度几乎呈线性降低,当吸附时间达到30min左右,溶液中Pb2+浓度几乎已经降为零了,Cd2+浓度在0.8mg/L,即说明溶液中大部分重金属离子均已被吸附材料很好地吸附,但是SBA-NH2-0.5g对Pb2+的吸附能力要优于对Cd2+的吸附能力,再一次验证了该材料对Pb2+的选择性。
从图4可以看出,随着吸附时间的延长,溶液中重金属离子的浓度一直降低,当吸附时间达到180min左右,吸附达到平衡,最终溶液中Cd2+浓度比Pb2+高,也说明的SBA-SH-0.5g对Pb2+的吸附能力要优于对Cd2+的吸附能力。
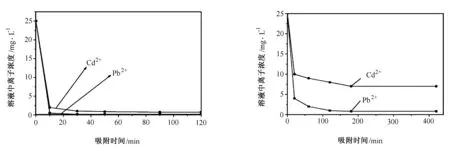
图3 SBA-NH2-0.5g对不同金属离子的吸附动力学曲线 图4 SBA-SH-0.5g对不同金属离子的吸附动力学曲线
2.3材料的可回收性能研究

图5 介孔材料配成溶液的电子照片
1)材料的电子照片 图5(a)是Fe3O4的水分散液,图5(b)是样品SBA-NH2-0.5g的水分散液。很明显可以从图5(b)中看出样品SBA-NH2-0.5g具有较强的磁性,这说明Fe3O4均匀地加入到SBA-15材料中,赋予了材料以优良的磁性,可以利用外加磁场来分离并回收吸附剂。
2)材料的重复利用性能研究 将样品SBA-NH2-0.5g吸附Pb2+后,用磁铁吸附分离,分散于6mol/L的HNO3溶液中,脱除金属离子,继续用于吸附重金属离子,所得数据见表3。可以看出,重复吸附5次后,材料对25mg/L的Pb2+吸附率为90.31%, 对25mg/L的Cd2+吸附率为88.23%,其吸附率虽然有所下降,但是还是有吸附能力,表明该材料具有可循环利用的性能。材料的吸附能力不断下降,这可能是因为材料中的部分基团与重金属离子形成了络合物,因此很难完全将重金属离子洗脱下来,导致材料的吸附能力不断下降。但是从工业处理的角度考虑,该吸附剂还是可以满足工业上水处理的要求,并且大大节约吸附剂的处理量。
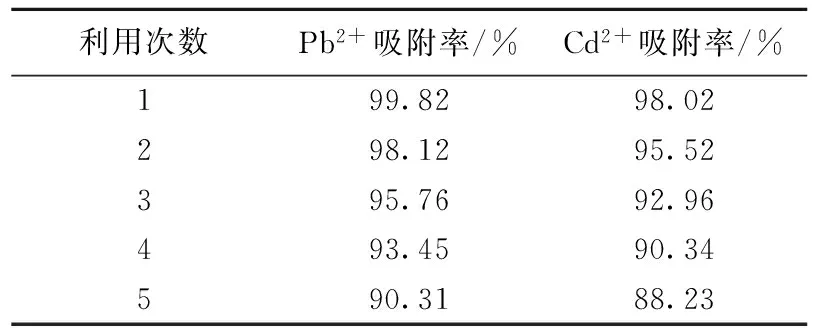
表3 循环利用后材料的吸附能力数据
[1]Matos G D, Arruda M A Z. Vermicompopst as natural adsorbent for removing metal ions form laboratory effluents [J]. Process Biochemistry, 2003, 39: 81-88.
[2] 于萍, 任月明, 张密林. 处理重金属废水技术的研究进展 [J]. 环境科学与管理, 2006, 31 (7): 103-105.
[3] Kim D S. The removal by crab shell of mixed heavy metal ions in aqueous solution [J].Bioresource Technology, 2003, 87: 355-357.
[4] Hunsom M, Pruksathom K, Damronglerd S, et al. Electrochemical treatment of heavy metals(Cu2+, Cr6+, Ni2+)from industrial efflu-ent and modeling of copper reduction [J]. Water Research, 2005, 39 (4): 610-616.
[5] Sciban M, Radetic B, Kevresan B, et al. Adsorption of heavy metals from electroplating wastewater by wood sawdust [J]. Biore-source Technology, 2007, 98 (2): 402-409.
[6] Peng W H, Escobar I C, White D B. Effects of water chemistries and properties of membrane on the performance and fouling-a model development study [J]. Journal of Membrane Science, 2004, 238 (1-2): 33-46.
[7] Yoshifumi K, Hirofumi S, Hideto S, et al. Selective adsorption of metal ions to surface-template resins prepared by emulsion po-lymerization using 10-(p-vinylphenyl) decanoic acid [J]. Bull Chem Soc Jpn, 1996, 69 (1): 125-130.
[8] 刘守新, 孙承林. 金属离子的光催化去除研究进展[J]. 化学通报, 2004, 12: 98-103.
[9] 郭冀峰,逮延军. 含重金属离子废水处理进展[J]. 有色金属加工, 2006, 35 (4): 48-51.
[10] 蒋艳红, 马少健. 废水处理用吸附剂材料的研究进展[J]. 有色矿冶, 2006, 22: 116-118.
[11] Ahluwalia S, Goyal D. Microbial and plant derived biomass for removal of heavy metals from waste water [J]. Bioresource Tech-nology, 2007, 98(12): 2243-2257.
[12] Sayari A, Hamoudi S, Yang Y. Applications of pore-expanded mesoporous silica. 1. Removal of heavy metal cations and organic pollutants from waste water [J]. Chem Mater, 2005, 17 (1): 212-216.
[13] Hoffmann F, Cornelius M, Morell J, et al. Silica-based mesoporous organic-inorganic hybrid materials [J]. Angew Chem Int Ed, 2006, 45 (20): 3216-3251.
[14] Mal N K, Fujiwara M, Tanaka Y, et al. Photo-switched storage and release of guest molecules in the pore void of cou-marin-modified MCM-41 [J]. Chem Mater, 2003, 15 (17): 3385-3394.
[15] Mercier L, Pinnavaia T J. Direct synthesis of hybrid organic-inorganic nanoporous silica by a neutral amine assembly route: structure-function control by stoichiometric incorporation of organosiloxane molecules [J]. Chem Mater, 2000, 12(1): 188-196.
[编辑] 洪云飞
10.3969/j.issn.1673-1409.2011.04.005
TQ174
A
1673-1409(2011)04-0014-04

