白细胞介素-27对白血病细胞株U937细胞生物学行为的影响
郭小燕, 翟凤范蕊芳, 林东军△
(中山大学 1附属第三医院血液科,2血液病研究所,广东 广州 510630)
白细胞介素-27对白血病细胞株U937细胞生物学行为的影响

(中山大学1附属第三医院血液科,2血液病研究所,广东 广州 510630)
目的: 探讨白细胞介素-27(IL-27)对人单核细胞白血病细胞株U937细胞的影响及其机制。方法用不同剂量的重组人IL-27和U937细胞分别共培养24 h和48 h,用荧光定量PCR测定细胞中促凋亡基因p53、bax及caspase-3、主要组织相容性复合物Ⅰ(MHCⅠ)类分子、协同刺激分子CD86和黏附分子CD54的表达,流式细胞仪检测U937细胞表面CD86和CD54的表达,并用四甲基偶氮唑盐(MTT)法测定IL-27对细胞增殖的影响。结果PCR结果显示经过不同剂量IL-27刺激后,U937细胞中促凋亡基因p53和bax表达增加,同时,U937细胞中凋亡相关蛋白caspase-3的表达及活性也有相应增加;MTT结果显示,IL-27可以抑制U937细胞增殖并和抗肿瘤药物阿糖胞苷产生协同作用;IL-27可以诱导U937细胞中的MHCⅠ类分子(HLA-A,B,C)、表面的协同刺激分子CD86和黏附分子CD54的表达增加。结论IL-27可以诱导U937细胞中促凋亡基因的表达,直接抑制细胞增殖,对细胞中MHCⅠ、CD86和CD54的表达有诱导作用。这可能是IL-27抗肿瘤作用的重要机制。
白细胞介素27; U937细胞; 白血病; 单核细胞
白细胞介素-27(interleukin-27,IL-27)是新发现的IL-12家族细胞因子, 由EBI3(EBV-induced gene 3)和P28表达产物组成的异二聚体,其受体也是由2个亚基IL-27Ra(又名WSX-1或T-CCR)和gp130构成,共同表达于很多免疫细胞,如:CD4+T/CD8+T、B细胞、NK细胞、单核细胞、树突状细胞等[1]。IL-27在机体的免疫调节中起到重要作用,它可以影响T细胞的分化,诱导T细胞向Th1方向分化,促使Th1型细胞因子表达,同时抑制Th2和Th17分化,并协同IL-12刺激细胞产生IFN-γ。在Th1高度活化时,IL-27却可以限制Th1型应答的强度。由于IL-27具有促进Th1型反应和减轻炎症的双重作用,它可能是多种主要以Th1型反应为主的病理过程(如感染免疫、自身免疫病和抗肿瘤免疫)的关键性调节因子[1-4],但是作为IL-12家族的成员,除了免疫调节作用之外,学者们更关注其抗肿瘤活性,2004年,Hisada等[5]首次证实了IL-27的抗肿瘤活性。他们将稳定表达IL-27的小鼠结肠癌细胞C26移植到小鼠体内,发现肿瘤生长大大受抑,主要由CD8+T细胞、IFN-γ和T-bet介导其抗肿瘤作用。Yuan等[6]在BM-NSCs(骨髓来源的神经干细胞样细胞)中导入单链IL-27 cDNA,再将其注入小鼠颅内GL-26 神经胶质瘤,有50%小鼠幸存,且幸存的小鼠对颅内再次注射同种瘤细胞株有了持久的免疫力,表明机体产生了对肿瘤细胞的免疫记忆。Salcedo等[7]进一步证实,IL-27可以显著增加CD8+T细胞的局部浸润能力和局部IFN-γ基因的表达,并可以显著上调肿瘤细胞表面的主要组织相容性复合物(major histocompatibility complex,MHC)Ⅰ类分子的表达,增加肿瘤细胞对机体的肿瘤特异性细胞素性T细胞(cytotoxic T-lymphocyte,CTL)的敏感性。但是大多数的实验都是局限在实体瘤模型中,Feng等[8]证实,IL-27可以诱导人单核细胞白血病细胞株THP-1细胞表面的MHC分子、协同刺激分子CD86、CD80和黏附分子CD54的表达,并能诱导THP-1细胞分泌IFN-γ。我们的前期实验(结果未发表)证实IL-27受体的2个亚基在急性单核细胞白血病患者细胞中高表达,而且IL-27可以直接诱导人单核细胞白血病细胞株U937细胞的凋亡,并呈现出一种剂量依赖关系。本实验旨在探讨IL-27是否可以诱导U937细胞MHCⅠ类分子、黏附分子CD54及协同刺激分子CD86的表达,是否诱导U937细胞促凋亡基因p53及bax的表达,并激活凋亡相关蛋白caspase-3,以及IL-27是否跟抗肿瘤药物阿糖胞苷(arabinosylcytosine,Ara-C)发挥协同作用。
材 料 和 方 法
1材料
U937细胞株由上海细胞库提供;重组人IL-27、重组人IFN-γ(eBioscience)购于广州康润生物有限公司;PrimeScript RT reagent Kit(TaKaRa DRR037A)、SYBR Premix Ex Taq(TaKaRa DRR041A)购于广州润真生物有限公司;CD86 PE和CD54 PE(eBioscience)购于广州康润生物有限公司;Taq酶(天根生化科技)购于广州合达生物科技有限公司;caspase-3活性试剂盒(碧云天生物科技);MTT检测试剂盒(碧云天生物科技);引物序列由广州英韦创津生物科技有限公司合成。
2方法
2.1细胞培养 U937细胞在10%小牛血清的RPMI-1640培养基中,于37 ℃、5%CO2的培养箱中培养,2-3 d传代1次。然后取对数生长期细胞进行实验。
2.2PCR及荧光定量PCR 测定MHCⅠ类分子(HLA-A,B,C)、p53、bax、caspase-3、CD86,CD54的表达 取对数生长期的细胞,以2×108cells/L接种至6孔板,加入不同浓度的IL-27(0、20、40、60 μg /L),共同培养24 h,48 h。Trizol法提取总RNA,并逆转录成cDNA,以紫外分光光度计测RNA的含量和纯度(RNA在260 nm和280 nm的吸光度比值为1.8-2.0之间)。以1%琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值gt;2.0)。应用Omiga 20软件设计MHCⅠ类分子(HLA-A,B,C)、p53、bax、caspase-3、CD86、CD54的引物序列。CD54正义链5’- TCACGGAGCTCCCAGTCCTAA -3’,反义链 5’-AAAGGCAGGTTGGCCAATGA-3’;CD86正义链 5’- TGGCCTAGGGTACAGGCAACA -3’,反义链 5’-GCCCAGATAGAAGTGGCTCCAG-3’;p53正义链 5’-AGAGCTGAATGAGGCCTTGGAA-3’,反义链 5’- GAGTCAGGCCCTTCTGTCTTGAAC -3’;bax正义链 5’-CATCATGGGCTGGACATTGG -3’,反义链 5’-CCACAAAGATGGTCACGGTCTG-3’;caspase-3正义链 5’- GACTCTGGAATATCCCTGGACAACA-3’,反义链 5’-CTGAGGTTTGCTGCATCGACA-3’;HLA-A正义链 5’-GACGACACGCAGTTCGTGC-3’,反义链 5’- CATGTCCGCCGCGGTCCAA -3’;HLA-B正义链 5’- ACCAGAGCGAGGCCGGG -3’,反义链 5’- GTGTCCGCSCGGTCCAG-3’;HLA-C正义链 5’- CGCGCGGAGTCCRAGAGG-3’,反义链 5’-GTGTCCGCSCGGTCCAG-3’;β2微球蛋白(β2-microglobulin,β2-MG)正义链 5’-CTCGCGC TACTCTCTCTTTCTGG-3’,反义链 5’- GCTTACATGTCTCGATCCCACTTAA-3’;GAPDH正义链5’- GCACCGTCAAGGCTGAGAAC-3’,反义链 5’- TGGTGAAGACGCCAGTGGA-3’;按照TaKaRa试剂盒给定条件,用荧光定量PCR仪进行基因扩增。
2.3Caspase-3活性的测定 按照caspase-3活性试剂盒说明进行操作。首先制作对硝基苯胺(p-nitroaniline,pNA)标准曲线;然后收集培养了24 h的U937细胞后600 r/min 4 ℃ 离心5 min;弃上清,加入1mL PBS,900 r/min 4 ℃ 离心5 min;弃上清,加入200 μL裂解液,冰浴15 min;4 ℃ 23 500 r/min离心15 min;取上清120 μL于预冷离心管。在96孔板中加样,每孔加入Ac-DEVD-pNA(acetyl-Asp-Glu-Val-Aspp-nitroaniline)10 μL,待测样本10 μL,加检测缓冲液补足100 μL,每个样本设置3个复孔,并设置空白对照。37 ℃孵育4 h后,测在405 nm处的吸光值(A405)。Caspase-3活性表示为实验组与对照组的相对值,对照组caspase-3的活性默认为1。
2.4MTT检测细胞增殖 将100 mL 2×108cells/L细胞种入96孔板中,培养24 h,然后加不同的处理因素刺激细胞,空白组只加培养基,对照组不加处理因素,每组设5个复孔,继续培养。培养24 h后每孔加入10 μL MTT溶液,继续孵育4 h,然后每孔加入100 μL formazan溶解液,在细胞培养箱内继续孵育,直至在普通光学显微镜下发现formazan全部溶解,在570 nm测定吸光度。生长抑制率=(1-A实验组/A对照组)×100%。
2.5流式细胞术检测细胞表面CD86和CD54的表达 将2×108cells/L的细胞悬液100 mL接种于6孔板中,培养24 h,然后加入40 μg/L IL-27刺激细胞,以50 μg/L IFN-γ作为阳性对照,继续培养48 h后收集细胞,2 000 r/min离心10 min,加入2 mL PBS,洗涤2次,然后加入100 mL PBS重悬细胞,加入20 μL PE标记的抗CD86抗体或抗CD54抗体室温共同孵育30 min,加入PBS 2 mL,洗涤1次,加入200 mL PBS重悬细胞,用流式细胞仪测定。以上实验重复3次。
3统计学处理
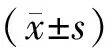
结 果
1IL-27诱导U937细胞中促凋亡基因的表达增加
结果见图1:IL-27 可以诱导U937细胞中p53及bax mRNA的表达,呈现出剂量相关性,在IL-27浓度为40 μg/L时,IL-27的诱导作用最强。

Figure 1.Effect of IL-27 on expression of p53 and bax mRNA in U937 cells.The mRNA level of each sample were normalized to the level of GAPDH±s.n=9.*Plt;0.05 vs 0 μg/L group.
2IL-27对U937细胞中caspase-3表达的影响
IL-27可以明显增加U937细胞中caspase-3的活性(Plt;0.05),并且与caspase-3 mRNA水平的增加表现出一致性,见图2。
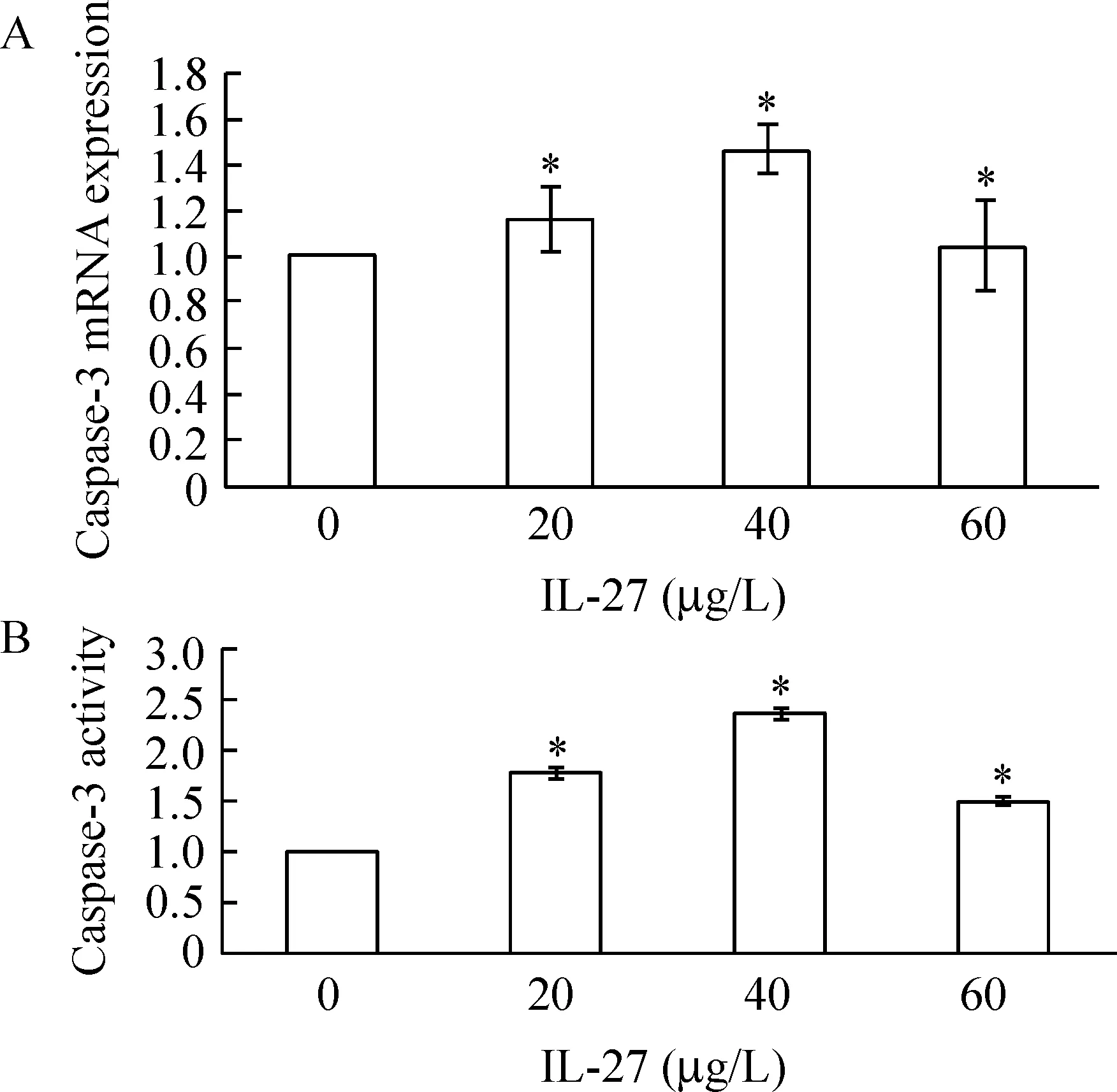
Figure 2.Effect of IL-27 on caspase-3 mRNA expression(A) and caspase-3 activity(B) in U937 cells±s.n=3.*Plt;0.05 vs 0 μg/L group.
3IL-27对U937细胞的增殖抑制作用
将U937细胞分别和不同剂量的IL-27(0、20、40、60 μg/L)和Ara-C(5 g/L)共同孵育12 h、24 h、48 h,发现IL-27对U937细胞的增殖抑制作用随着时间的增加而增强,见图3A。然后将U937细胞分别与IL-27(40 μg/L),Ara-c(5 g/L)、IL-27(40 μg/L)+ Ara-c(5g/L)共同培养12 h、24 h、48 h,结果显示,IL-27可以直接抑制U937细胞增殖(以Ara-C作为阳性对照),IL-27还能和Ara-C产生协同效应。
4IL-27诱导U937细胞MHCⅠ类分子、细胞表面的协同刺激分子和黏附分子表达增加
使用荧光定量PCR法检测U937细胞中MHCⅠ类分子以及协同刺激分子和黏附分子的表达(以IFN-γ作为阳性对照)。发现经过IL-27刺激之后,U937细胞中MHCⅠ类分子(HLA-A,B,C)及β2-MG表达增加,见图4A。在U937细胞中协同刺激分子CD86和黏附分子CD54的表达呈现出相同趋势,见图4B。40 μg/L IL-27刺激48 h后,U937细胞表面(以IFN-γ作为阳性对照)CD86表达增加1.5倍,CD54表达增加 3倍,见图4。
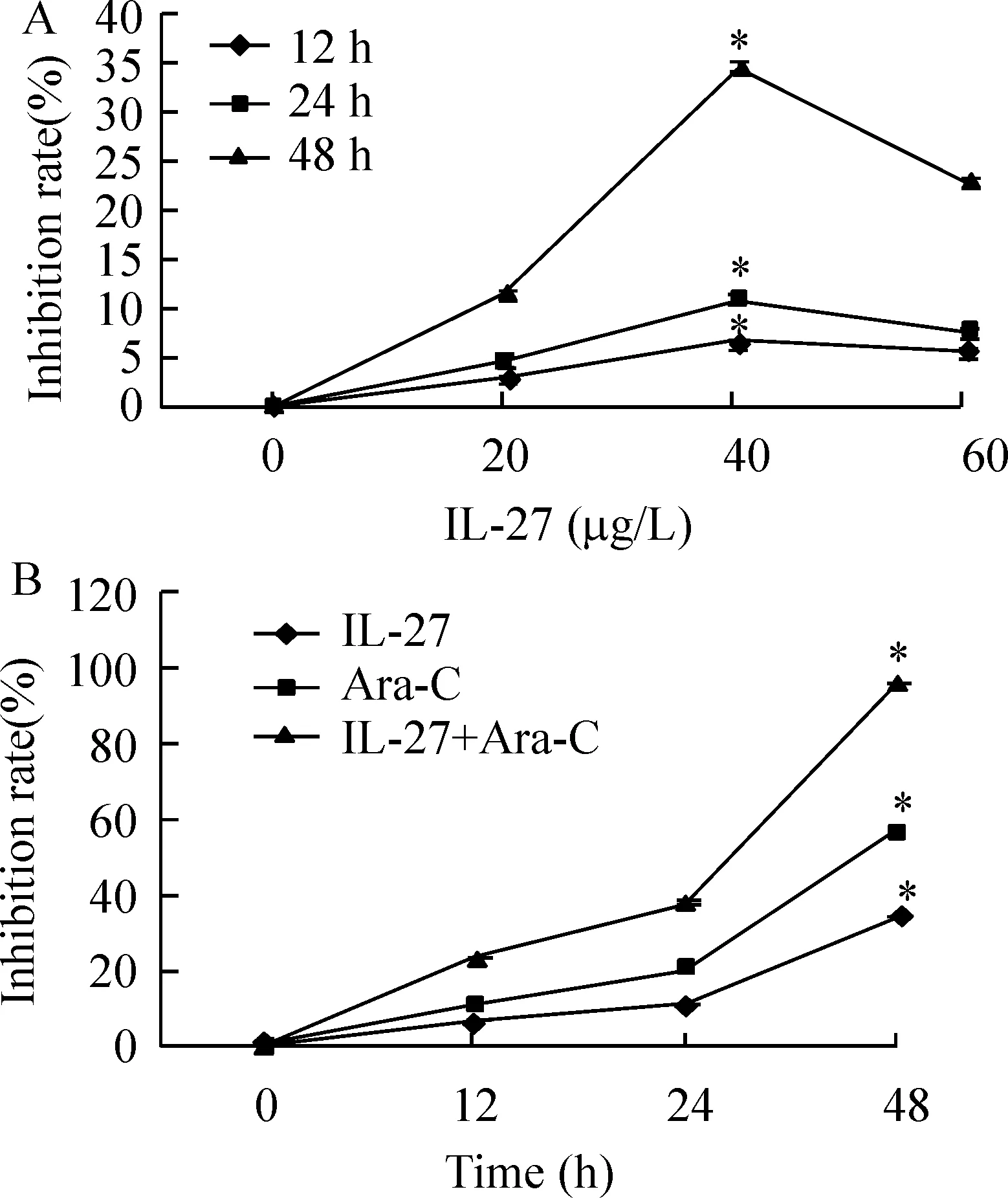
Figure 3.The antiproliferative activity of IL-27 alone(A) and combined with arabinosylcytosine (Ara-C,B) on U937 cells.±s.n=9.*Plt;0.05 vs control(0 μg/L or 0 h).
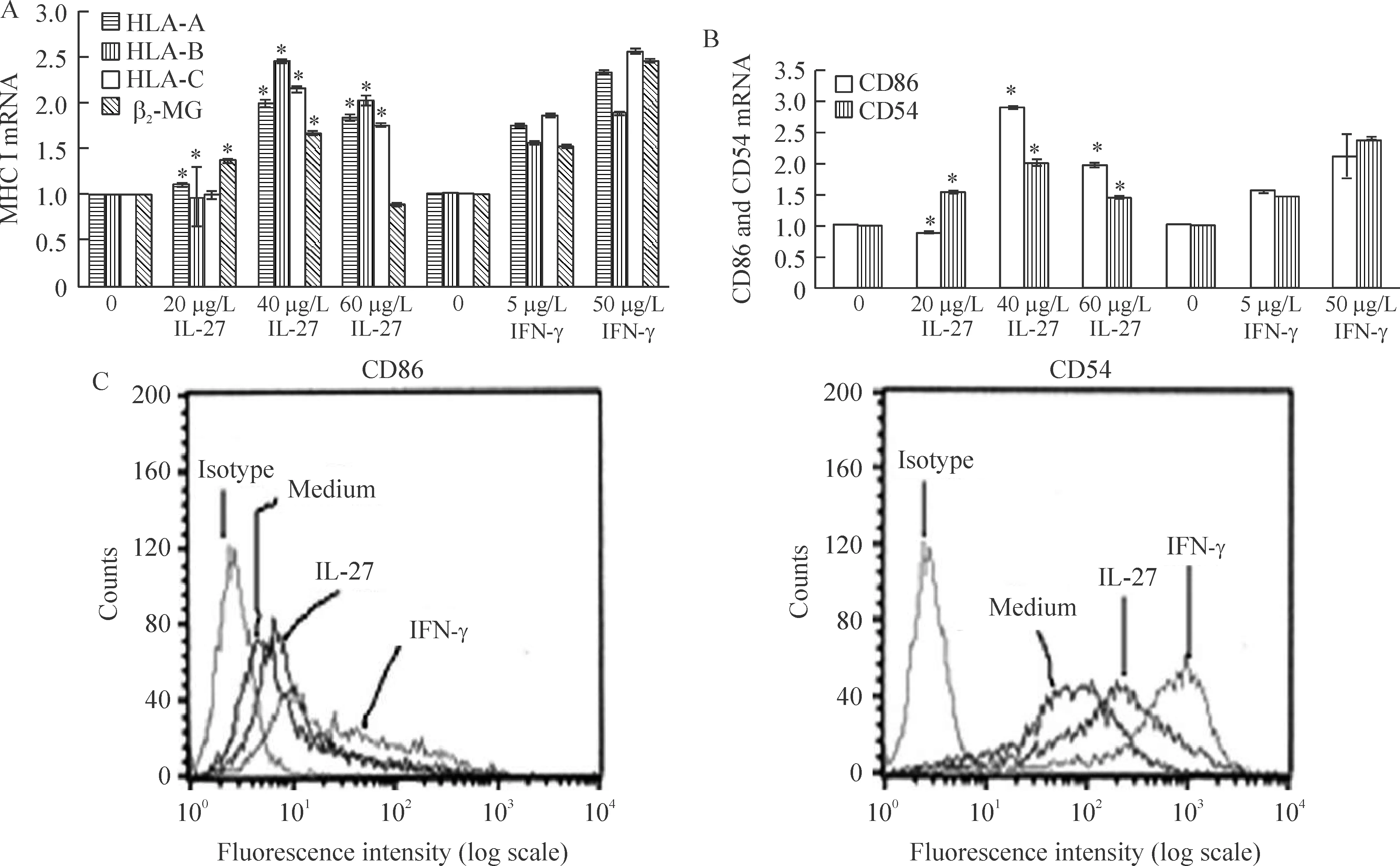
Figure 4.IL-27 increased expression of classⅠMHC mRNA and constimulatory molecules in U937 cells.A and B:expression of class Ⅰ MHC and constimulatory molecule were evaluated by real-time PCR after 24 h of stimulation with various of amounts of IL-27(0,20,40 and 60 μg/L) and IFN-γ (0,5 and 50 μg/L).C:surface expression of CD86 and CD54,as detected by flow cytometry,is shown after 48 h of incubation with medium alone,40 μg/L IL-27 or 50 μg/L IFN-γ.IFN-γ was used as a positive control in A,B and C±s.n=3.*Plt;0.05 vs control(0).
讨 论
近年来肿瘤生物治疗(biotherapy)已成为肿瘤治疗的一种新趋势,主要通过调动宿主的天然防御机制或给予天然(或基因工程)产生的靶向性很强的药物来获得抗肿瘤效应,包括肿瘤的免疫治疗和基因治疗,其理想机制一是诱导肿瘤细胞自身生长的停滞或凋亡;二是诱导机体内具有抗肿瘤特异性和细胞毒性的 T淋巴细胞产生,达到特异性攻击肿瘤的作用,不仅能提高宿主免疫功能,特异性杀伤肿瘤细胞,而且对正常组织有较少的毒副作用,受到了人们的关注。由于血液肿瘤与免疫学关系密切,近年来免疫治疗显示出良好的应用前景。
细胞因子(cytokine)是由多种免疫细胞分泌的具有调节细胞生长分化、调节机体免疫功能、参与炎症反应等功能的小分子多肽的统称。在天然及获得性免疫应答过程中,细胞因子表现出重要功能,重组细胞因子已成为生物应答调节剂(biological response modifier,BRM)中一类重要的治疗制剂,目前IL-2及IL-11等细胞因子的基因工程产品已获准生产并用于疾病的治疗,一些细胞因子(如IL-2、IL-12、IFN、TNF)应用于抗肿瘤治疗,已取得了一定的效果。
在肿瘤免疫中,细胞因子起到重要作用,IL-12就是一个很重要的肿瘤免疫因子,它诱导Th1细胞、CTL及NK细胞产生IFN-γ进而发挥抗肿瘤作用[5]。IL-27作为一种新发现的IL-12家族细胞因子,其抗肿瘤作用也是学者们关注的焦点,IL-27的强大抗肿瘤作用已经在多种实体瘤的动物实验模型中得到证实,经过IL-27刺激的肿瘤细胞在实验动物中形成的肿瘤体积明显较小,并且接种过表达IL-27肿瘤细胞的实验动物,对再次接种肿瘤细胞产生了免疫耐受;在这些动物中,学者们发现CD8+T细胞的数量增加,并且在肿瘤周围集聚,IFN-γ的表达量也明显增加,因此有学者提出,IL-27的抗肿瘤作用主要是依赖于有特异性杀伤作用的CD8+T细胞(CTL)和体内其它细胞产生的IFN-γ;也有学者提出,在低抗原性的肿瘤模型中IL-27的抗肿瘤活性是通过NK细胞实现的[9];另外,IL-27可以诱导抗血管生成细胞因子表达而抑制血管的生成,产生抗肿瘤作用[10];IL-27还可以诱导肿瘤细胞表面MHCⅠ类分子的表达,增加肿瘤细胞的抗原性及对特异性抗CTL的敏感性[9]。除此之外,IL-27对肿瘤细胞有直接增殖抑制作用也得到了证实。
本实验中,我们首次报道了IL-27可以诱导U937细胞中表达p53和bax mRNA表达增多,这种促凋亡基因的表达增加跟IL-27的剂量有关。这种凋亡基因的表达是否引起凋亡信号通路的激活呢?我们通过测定caspase-3 mRNA水平及其蛋白活性的改变来证实凋亡信号的激活。Caspase-3是细胞凋亡信号通路中的重要下游信号分子,其活性与细胞凋亡的发生有着极密切的关系[11,12]。我们发现经过IL-27刺激之后,caspase-3的活性有增加,并且和细胞的增殖抑制呈现一致性。我们推测IL-27诱导了的细胞中促凋亡基因的表达,启动凋亡信号,诱导凋亡相关蛋白caspase-3表达并活化,进而引起细胞凋亡。为了进一步证实IL-27的生物学作用,我们把IL-27和抗肿瘤药物Ara-C共同作用于U937细胞,测定细胞的增殖抑制率,发现IL-27除了可以直接抑制U937细胞的增殖,还可以和阿糖胞苷产生协同作用,这可能与IL-27诱导了U937细胞中的凋亡促进蛋白表达增加有关。
肿瘤细胞是一群失去正常调控机制发生恶变的自身细胞,机体自身的免疫机制可以对这种恶变细胞进行免疫防御。肿瘤特异性CTL对肿瘤的杀伤作用是机体肿瘤免疫的一个重要环节。CTL特异性杀伤肿瘤细胞,需要协同刺激分子CD86(CD80)和协同刺激分子CD54的辅助,来识别肿瘤细胞表面由MHCⅠ类分子提呈的肿瘤特异性抗原,但是由于肿瘤细胞表面MHCⅠ类分子的表达较低,导致肿瘤细胞的抗原性低,不能被特异性识别,这是肿瘤免疫逃逸的一个重要机制[13]。在本实验中,我们测定了U937细胞表面的的协同刺激分子CD86和黏附分子CD54,以及细胞中MHCⅠ类分子的表达,发现CD86和CD54在基因水平和蛋白水平的表达都有增加,这与之前学者的研究一致[13]。这种细胞表面MHCⅠ类分子及黏附分子、协同刺激分子的表达增加,增加了CTL对肿瘤细胞的敏感性,从而发生依赖CTL的特异性肿瘤杀伤作用,达到抗肿瘤作用。但是我们发现,在IL-27浓度为40 μg/L时,其诱导细胞表达协同刺激分子和黏附分子的作用达到最大,在MHCⅠ类分子发现了同样的趋势,这与之前IL-27诱导协同刺激分子表达与剂量呈正相关不同[13],可能跟IL-27复杂的生物学作用有关。
总之,我们的实验研究证明,IL-27有强大的抗肿瘤作用,它可以诱导U937细胞中促凋亡基因p53、bax表达增加,启动凋亡信号通路,诱导细胞中caspase-3表达,并活化caspase-3,直接诱导细胞凋亡。除了直接诱导U937细胞的凋亡,IL-27还可以跟抗肿瘤药Ara-C产生协同增殖抑制作用。另外,IL-27可以诱导U937细胞中的MHCⅠ类分子(HLA-A,B,C)、协同刺激分子CD86和黏附分子CD54的表达增加。
[1]Hamano S,Himeno K,Miyazaki Y,et al.WSX-1 is required for resistance toTrypanosomacruziinfection by regulation of proinflammatory cytokine production[J].Immunity,2003,19(5):657-667.
[2]Hibbert L,Pflanz S,de Waal Malefyt R,et al.IL-27 and IFN-α signal via Stat1 and Stat3 and induce T-Bet and IL-12Rβ2 in naive T cells[J].J Interferon Cytokine Res,2003,23(9):513-522.
[3]Takeda A,Hamano S,Yamanaka A,et al.Cutting edge: role of IL-27/WSX-1 signaling for induction of T-bet through activation of STAT1 during initial Th1 commitment[J].J Immunol,2003,170(10):4886-4890.
[4]Trinchieri G.Interleukin-12 and the regulation of innate resistance and adaptive immunity[J].Nat Rev Immunol,2003,3(2):133-146.
[5]Hisada M,Kamiya S,Fujita K,et al.Potent antitumor activity of interleukin-27[J].Cancer Res,2004,64(3):1152-1156.
[6]Yuan X,Hu J,Yoshimoto T,et al.Bone marrow derived neural stem-like cells expressing IL-27 exhibit antitumor activity in intracranial gliomas[J].Mol Ther,2005,11(Suppl 1):S268.
[7]Salcedo R,Stauffer JK,Lincoln E,et al.IL-27 mediates complete regression of orthotopic primary and metastatic murine neuroblastoma tumors: role for CD8+T cells[J].J Immunol,2004,173(12):7170-7182.
[8]Feng XM,Liu N,Yang SG,et al.Regulation of the class II and class I MHC pathways in human THP-1 monocytic cells by interleukin-27[J].Biochem Biophys Res Commun,2008,367(3):553-559.
[9]Yoshimoto T,Morishima N,Mizoguchi I,et al.Antiproliferative activity of IL-27 on melanoma[J].J Immunol,2008,180(10):6527-6535.
[10]Shimizu M,Shimamura M,Owaki T,et al.Antiangiogenic and antitumor activities of IL-27[J].J Immunol,2006,176(12):7317-7324.
[11]方 勇,吴金民,潘宏铭.Caspase-3抑制剂抑制长春碱诱导的人乳腺癌细胞凋亡及IκB-α降解[J].中国病理生理杂志,2009,25(2):215-219.
[12]陈晓春,朱元贵,王小众,等.一氧化氮和caspase-3在多巴胺诱导PC12细胞凋亡中的作用[J].中国病理生理杂志,2001,17(10):971-975.
[13]Laupéze B,Fardel O,Onno M,et al.Differential expression of major histocompatibility complex class Ia,Ib,and II molecules on monocytes-derived dendritic and macrophagic cells[J].Hum Immunol,1999,60(7):591-597.
EffectsofIL-27onacutemonocyticleukemiccelllineU937
(1DepartmentofHematology,TheThirdAffiliatedHospital,2InstituteofHematology,SunYat-senUniversity,Guangzhou510630,China.E-mail:lindongjun0168@163.com)
AIM: To investigate the effects of interleukin-27 (IL-27) on the U937 cell line of human acute monocytic leukemia and to explore the underlying mechanism.METHODSU937 cells were incubated with different concentrations of IL-27.Total RNA was isolated by Trizol.The expression levels of protein 53 (p53),Bcl-2 associated X protein (Bax),caspase-3,histocompatibility locus antigen-A (HLA-A),histocompatibility locus antigen-B (HLA-B),histocompatibility locus antigen-C (HLA-C),cluster of differentiation 86 (CD86) and cluster of differentiation 54 (CD54) were tested by real-time PCR.The expression of CD86 and CD54 on the cell surface was detected by flow cytometry.MTT method was used to determine the antiproliferative activity of IL-27.RESULTSThe results suggested that U937 cell growth was significantly inhibited by IL-27 in a dose-dependent manner.IL-27 induced the expression of pro-apoptotic genes,such asp53 andbax.The expression and activity of caspase-3 were also increased.IL-27 had antiproliferative activity and had an additive effect with arabinosylcytosine.After incubated with IL-27,high expression of class I major histocompatibility complex (MHC),CD86 and CD54 in U937 cells were induced.CONCLUSIONIL-27 induces the expression of pro-apoptotic genesp53 andbax,which may play the antiprolifetative functions directly in U937 cells.IL-27 also induces the expression of class I MHC,CD86 and CD54,indicating an important antitumor role of IL-27.
Interleukin-27; U937cells; Leukemia; Monocytes
1000-4718(2011)05-0869-06
R557+2
A
10.3969/j.issn.1000-4718.2011.05.008
2010-03-10
2011-03-17
广东省科技计划资助项目(No.2009B080701008)
△通讯作者Tel:020-85252389;E-mail: lindongjun0168@163.com

