大鼠心肌素慢病毒RNA干扰载体的构建及其对血管平滑肌细胞分化的影响*
揭 伟, 申志华, 王晓燕, 况 东, 王国平, 敖启林△
(1广东医学院基础学院病理教研室,广东 湛江 524023;2华中科技大学同济医学院附属同济医院病理研究所,湖北 武汉 430030)
·实验技术·
大鼠心肌素慢病毒RNA干扰载体的构建及其对血管平滑肌细胞分化的影响*
揭 伟1, 2, 申志华1, 王晓燕2, 况 东2, 王国平2, 敖启林2△
(1广东医学院基础学院病理教研室,广东 湛江 524023;2华中科技大学同济医学院附属同济医院病理研究所,湖北 武汉 430030)
目的构建大鼠心肌素(myocardin)慢病毒RNA干扰(RNAi)重组质粒,分析该RNAi质粒的干扰效果及其对血管平滑肌细胞(VSMCs)分化的影响。方法设计并合成3对针对大鼠myocardin的shRNA片段,退火后将双链oligo-DNA克隆入慢病毒质粒载体pGCSIL- GFP获得重组干扰质粒pGCSIL- GFP - shMyocd。以pEGFP - N1 / X124G表达载体构建含Flag标签的myocardin表达质粒pEGFP - N1- Myocd。将重组干扰质粒和过表达质粒共转染293T细胞,Western blotting分析Flag标签蛋白的表达,筛选出干扰效率最好的干扰质粒并大量扩增。干扰质粒转染大鼠主动脉VSMCs,RT - PCR和Western blotting检测myocardin及分化标志物SM22α的表达。结果成功构建大鼠myocardin的慢病毒干扰质粒pGCSIL- GFP - shMyocd和过表达质粒pEGFP - N1 - Myocd。上述2种质粒共转染293T细胞后,1号干扰质粒转染组Flag标签蛋白表达下降最显著。将1号质粒进行大包装,获得滴度为1×1012TU/L的慢病毒颗粒,该病毒转染VSMCs后,myocardin表达明显下调并伴随分化标志物SM22α表达的显著下降。结论成功构建大鼠myocardin慢病毒重组干扰质粒pGCSIL- GFP - shMyocd;抑制基因myocardin表达后伴随VSMCs分化的表达下降,提示myocardin在VSMCs分化过程中的重要性。pGCSIL- GFP - shMyocd重组质粒的成功构建为后续研究特定病理条件下(如动脉粥样硬化)VSMCs表型转变的分子机制奠定了基础。
心肌素; 载体构建; 慢病毒; 血管平滑肌细胞; 细胞分化
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是维持血管张力和功能的主要细胞成分,在血管壁病理过程中也发挥重要作用。在特定环境下,VSMCs可以发生表型转化,即由收缩型转变为合成型,合成型VSMCs的增殖和迁移能力明显增强并能分泌细胞外基质,这在动脉粥样硬化(atherosclerosis, AS)、血管损伤后狭窄等病灶的发生发展中起重要作用。迄今为止VSMCs表型转变的机制仍未得到有效阐明[1]。在VSMCs的分化发育过程中,一系列标志物顺序表达。大部分VSMCs标志基因在其启动子增强区域都包含1个至多个特异性CArG [CC(A/T)6GG] 序列,这些基因都由一种较广泛表达的顺式结合因子即血清反应因子(serum response factor, SRF)及其辅助激活因子心肌素即myocardin来调控[2]。
Myocardin是Wang[3]等用生物信息学方法从心脏特异性表达基因中发现的SRF的辅助因子。它不与DNA直接结合,而是通过与SRF结合形成三元复合物来调控依赖于CArG的基因转录[4]。Myocardin在干/祖细胞向平滑肌细胞分化过程中起重要作用,被认为是调节平滑肌细胞分化的分子开关成分之一[5]。前期我们发现高糖和低氧刺激诱导表型转变的VSMCs中myocardin表达下降,但具体调控机制尚不清楚[6, 7]。因而基于myocardin分子来探讨VSMCs表型转化具有显著的理论及潜在的临床意义。本实验基于慢病毒表达质粒pGCSIL - GFP构建了针对大鼠myocardin重组干扰载体,转染VSMCs后观察myocardin及分化标志物SM22α的表达改变,初步分析myocardin在VSMCs分化过程中作用,为进一步深入探讨myocardin在VSMCs表型转变中的作用的分子机制研究奠定基础。
材 料 和 方 法
1材料
1.1主要试剂 质粒pGCSIL- GFP、pHelper 1.0和pHelper 2.0,大肠杆菌菌株 DH5α和293T细胞由上海吉凯生物技术有限公司提供;pEGFP - N1 / X124G质粒和DNA ladder由上海捷瑞公司提供;质粒大量抽提试剂盒购自Qiagen;AgeI、EcoR I、KpnI、T4 DNA连接酶及buffer购自NEB;BCA试剂盒购自HyClone - Pierce;ECL-Plu sKit购自Amersham;DMEM培养基、胎牛血清和DMSO购自Gibco;Lipofectamine 2000和Opti - MEM购自Invitrogen;羊抗鼠myocardin、兔抗鼠IgG - HRP和兔抗羊IgG - HRP购自Santa Cruz;鼠抗Flag购自Sigma;小鼠抗β-actin购自碧云天。
2方法
2.1Myocardin慢病毒干扰质粒构建 根据大鼠myocardin mRNA(NM_182667)序列信息,结合设计经验和设计软件 (http://hydra1.wistar.upenn.Edu/Projects/siRNA/siRNAindex.htm )进行评估测定,经 BLAST表明不与大鼠其它 cDNA序列同源,合成3对干扰DNA序列和1对阴性对照(NC)序列(表1),其两端含酶切位点黏端。1号重组质粒靶序列:GAT GCA TTT GCC TTT GAA GAT;2号重组质粒靶序列:GAC ACA ATC CAG GAT CTC ACT;3号重组质粒靶序列:CAG AAA GTG ACA AGA ACG ATA;重组阴性对照(NC)质粒靶序列(scrambled sequence):TTC TCC GAA CGT GTC ACG T。将表1中的寡核苷酸各5 μL,缓冲液20 μL 和70 μL双蒸水混合,90 ℃ 4 min,70 ℃10 min,冷却至室温后经12 %非变性PAGE凝胶检测双链形成效率,T4噬菌体DNA连接酶将双链DNA 连接入经AgeI和EcoR I双酶切线性化的慢病毒pGCSIL- GFP载体,转化E.coliDH5α感受态细胞,阳性克隆经PCR和测序(ABI 3730,Invitrogen)鉴定。PCR上游引物5’- CCT ATT TCC CAT GAT TCC TTC ATA - 3’,下游引物5’- GTA ATA CGG TTA TCC ACG CG - 3’。阳性克隆进行质粒抽提,最后质粒DNA测定浓度后-20 ℃保存备用。
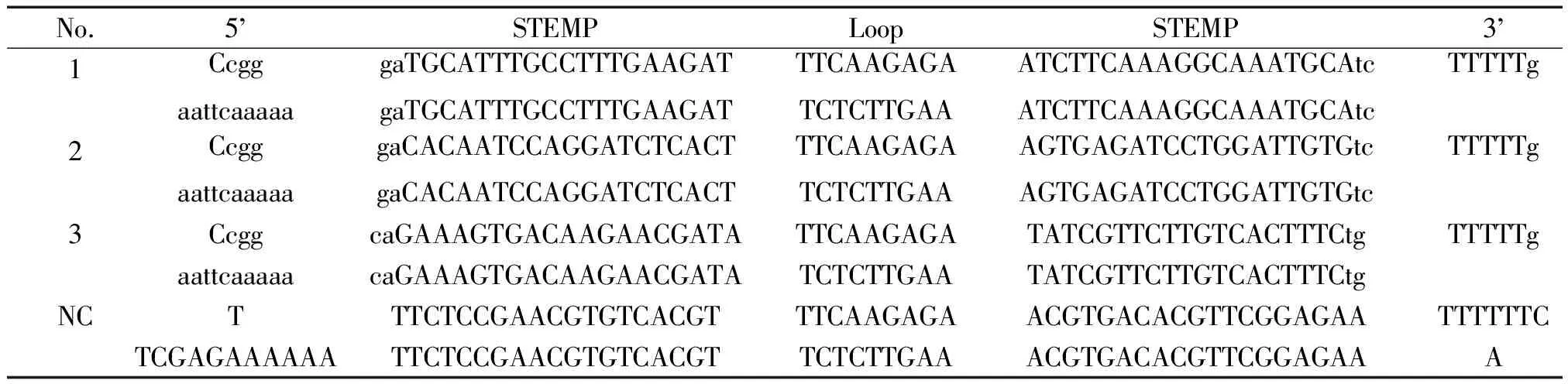
表1 病毒载体干扰序列
2.2Myocardin-GFP融合蛋白过表达质粒构建 大鼠myocardin mRNA CDS位于244-3 060 nt处,整个CDS区域序列较长,因此获得整个CDS区域表达质粒较困难。我们选择性人工合成一段从244-1 023 nt的RNA序列,该合成序列包含上述3对干扰序列作用靶点。将合成序列克隆入经EcoR II、KpnI双酶切的pEGFP-N1 / X124G质粒从而构建pEGFP - N1 - Myocd过表达质粒,表达蛋白质与GFP形成融合蛋白。将pEGFP - N1 - Myocd过表达质粒用Lipofectamine 2000转染293T细胞,转染48 h后,荧光显微镜下观察融合蛋白GFP的表达情况,判断pEGFP - N1 - Myocd过表达质粒构建成功与否。
2.3有效myocardin干扰靶点质粒筛选 生长良好的293T细胞按1×108cells/L 接种于24孔板,80 % - 90 %融合时换成400 μL Opti- MEM。细胞转染时,每孔表达载体的量均为0.5 μg,干扰质粒量分为0.25 μg和0.5 μg,Lipofectamine 2000体积均为1 μL。将质粒和Lipofectamine 2000分别溶解于Opti- MEM中,混匀,室温静置5 min,将稀释好的质粒和Lipofectamine 2000混匀,室温静置20 min,把质粒DNA与Lipofectamine 2000的混合液加入293T细胞中,37 ℃、5% CO2培养箱中培养8 h,换成新鲜的含10 %胎牛血清的完全培养液,转染后24 h荧光显微镜下观察预估转染率,48 h后收集细胞,抽提总蛋白进行Western blotting检测。
2.4Myocardin干扰载体慢病毒扩增及滴度测定 对数生长期293T 细胞以含10 %胎牛血清的培养基调整细胞密度为 6×108cells/L,接种于15 cm培养皿,常规培养24 h后达 70 % - 80 %融合可用于转染。转染前2 h换为无血清培养基。向一灭菌离心管中加入所制备的各DNA溶液(pGCSIL - Myocd 载体 20 μg,pHelper 1.0 载体 15 μg,pHelper 2.0 载体10 μg),与相应体积的 Opti- MEM 混合均匀,总体积为 2.5 mL,在室温下温育5 min。取 100 μL Lipofectamine 2000 试剂在另一管中与 2.4 mL Opti- MEM 混合,室温下温育 5 min。稀释后的 DNA与稀释后的Lipofectamine 2000 进行混合,室温下温育 20 min,以便形成 DNA与Lipofectamine 2000稀释液的转染复合物。将DNA与Lipofectamine 2000混合液转移至293T细胞的培养液中,混匀,常规培养8 h后弃去培养基,加入20 mL PBS洗涤。加入含10 %血清的细胞培养基 25 mL,继续常规培养 48 h,收集上清,于 4℃ 4 000 ×g离心10 min除去细胞碎片,0.45μm滤器过滤上清。把病毒粗提液加入到过滤杯中,盖上盖子,将过滤杯插到滤过液收集管中,在 4 000 ×g离心10 min - 15 min到需要的病毒浓缩体积,病毒分装后置于-80 ℃保存备用。取出1支病毒用逐孔稀释法测定病毒滴度。换算公式为:滴度 (103TU/L ) = 观察到带有荧光的细胞个数/病毒原液量。
2.5大鼠主动脉VSMCs慢病毒质粒转染及效果分析 雄性SD大鼠(250 g)由华中科技大学同济医学院实验动物中心提供。组织贴块法分离主动脉VSMCs并用α-平滑肌肌动蛋白免疫组化染色鉴定,实验用第3代。VSMCs接种24孔板后约70%融合时,按MOI = 120加入pGCSIL- GFP - shMyocd,每孔培养基总体积250 μL(含4 mg/L polybrene 1μL),转染8 h后更换新鲜培养液,48 h后收获细胞,提取蛋白和RNA,分别用RT - PCR和Western blotting 检测myocardin和SM22α的表达。
2.6mRNA表达分析 Trizol试剂抽提总RNA,2 μg RNA逆转录为cDNA。应用半定量PCR检测目的基因mRNA表达。Myocardin上游引物5’- GGG TCT GAA CAC TCT TTG C - 3’, 下游引物5’- ATT ACC GTG GAG GCT TGG A - 3’,产物大小254 bp;SM22α上游引物5’- AGC CAG TGA AGG TGC CTG AGA AC - 3’,下游引物5’- TGC CCA AAG CCA TTA GAG TCC TC - 3’,产物大小181 bp;β- actin上游引物5’- CAT TGT TGC CCA TCA ACG ACC - 3’,下游引物5’- TCA CAC CCA TCA CAA ACA TG - 3’,产物大小173 bp。PCR退火温度53 ℃。引物均由Invitrogen公司合成。产物经1.5 %琼脂糖凝胶电泳,紫外灯下观察并拍照(Gel Doc1 000, Bio - Rad)。实验重复3次。
2.7Western blotting 冰上裂解细胞15 min后将样品转移入EP管中,超声破碎仪破碎细胞(200 W共4次,每次5 s,间隔2 s),4 ℃ 12 000×g离心15 min,经BCA法测蛋白浓度后调整样品蛋白终浓度为2 g/L。蛋白经12 % SDS - PAGE后转移到PVDF膜,5 %脱脂牛奶的TBST溶液室温封闭PVDF膜1 h,Ⅰ抗4 ℃过夜孵育,TBST洗膜3次,每次10 min,Ⅱ抗室温下孵育2 h,TBST洗膜3次,每次10 min,ECL试剂显色后拍照。应用抗体为:小鼠抗Flag(F1804,1∶5 000),小鼠抗β-actin(AA128,1∶ 5 000),羊抗鼠IgG - HRP(sc-2005,1∶8 000),羊抗鼠myocardin(sc-21561,1∶500),兔抗羊IgG- HRP (sc-2030,1∶8 000)。
3统计学处理
结 果
1成功构建慢病毒干扰质粒
将合成的3对针对myocardin不同靶点序列和1对阴性对照双链oligo-DNA连接入经AgeI和EcoR I双酶切pGCSIL - GFP线性化慢病毒载体质粒,经氨苄西林抗性基因筛选,挑选出阳性克隆经PCR(图1)和测序验证(未发表资料)无误,证实合成的oligo-DNA正确连接入线性化pGCSIL- GFP载体;连接入shRNA片段的阳性克隆PCR片段大小为343 bp,没有连接入vshRNA片段的空载体克隆PCR片段大小为306 bp。电泳鉴定其大小在预期范围,证实成功构建了慢病毒干扰质粒,标记为pGCSIL- GFP - shMyocd和pGCSIL - GFP - NC。
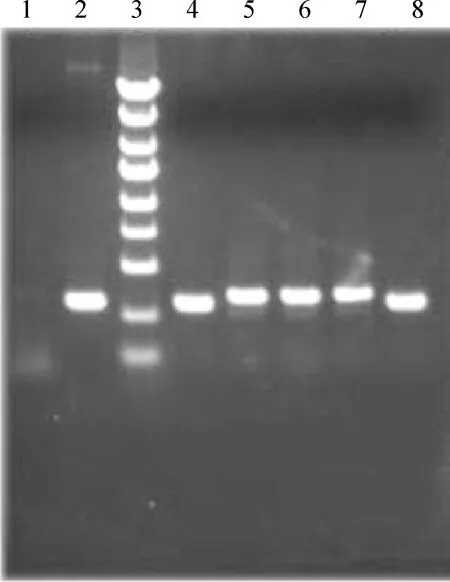
Figure 1. Electrophoresis of positive clones of recombinant pGCSIL-GFP vector. lane 1: ddH2O;lane 2: pGCSIL - GFP;lane 3: marker (5.0 kb, 3.0 kb, 2.0 kb, 1.5 kb, 1.0 kb, 750 bp, 500 bp, 250 bp, 100 bp);lane 4-8: positive clones.
2成功构建myocardin-Flag-GFP融合蛋白过表达质粒
pEGFP - N1 / X124G质粒经EcoR I和KpnI酶切后去除X124G过渡序列,接入myocardin(244 nt - 1 023 nt)和Flag表达序列后构建pEGFP - N1 - Myocd真核表达质粒,表达myocardin - Flag - GFP融合蛋白。该过表达载体转染293T细胞后,荧光显微镜下观察到绿色荧光,证实过表达载体正常工作,见图2。
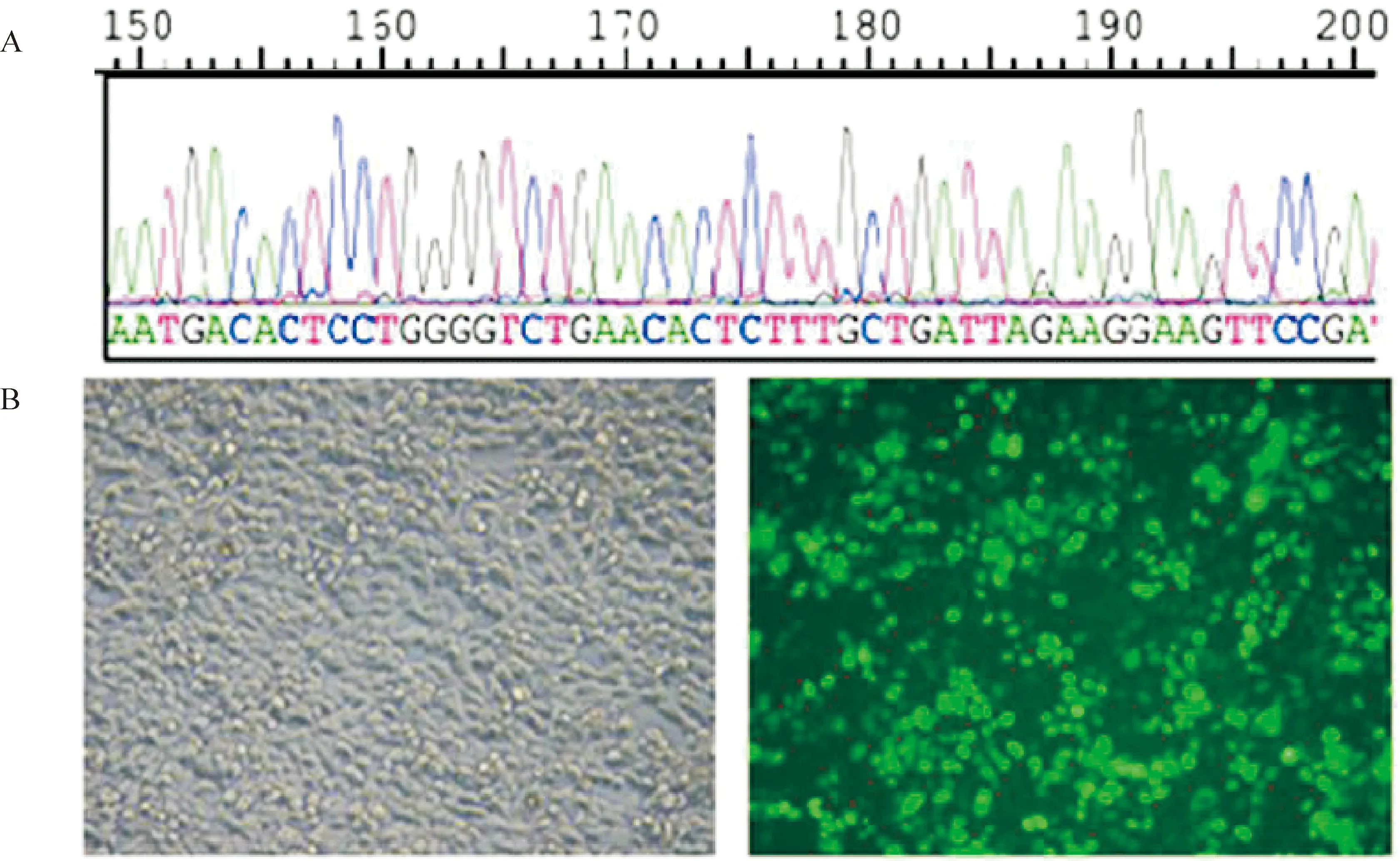
Figure 2. Construction and transfection of myocardin-overexpression vector.A: sequencing result of partial myocardin CDS (244 nt - 284 nt);B: green fluorescent was observed in 293T cells transfected with myocardin-overexpression vectors.
3有效干扰靶点慢病毒鉴定及扩增
将不同靶点pGCSIL - GFP - shMyocd载体和pEGFP - N1 - Myocd过表达载体共转染293T细胞,荧光显微镜下观察绿色荧光表达来判断转染效率;转染成功后的细胞经提取蛋白,Western blotting检测Flag的表达来判断干扰载体的敲减效应,结果证实设计的3个靶点中2个具有明显基因表达敲减效应,见图3。我们选择性包装了1号质粒(#1)和阴性对照质粒(NC),其滴度分别达到1×1012TU/L和5×1012TU/L。
4慢病毒干扰质粒降低VSMCs中myocardin和收缩基因表达
将包装的1号慢病毒干扰质粒转染VSMCs后,RT - PCR和Western blotting结果均显示pGCSIL - GFP - shMyocd质粒显著降低VSMCs中myocardin表达,同时伴随VSMCs收缩标志物SM22α mRNA和蛋白表达水平的显著下降,见图4。
讨 论
慢病毒RNA干扰系统是1型人类免疫缺陷病毒(human immunodeficiency virus type 1,HIV-1)为基础改造的病毒基因载体质粒,载体转入细胞后转录出的RNA链折叠成具有发夹结构的shRNA。shRNA发夹结构被Dicer切除后产生siRNA,在细胞内产生基因沉默。慢病毒载体不但可以感染非分裂期细胞,也可以感染分裂期细胞,还具有容纳外源性目的基因片段大、稳定整合持久表达、免疫反应小等优点[8]。慢病毒干扰系统是目前应用较多的一种RNAi体系。为探讨myocardin在VSMCs表型转变中的表达及作用,我们遵从RNAi设计的一般原则[9-12],设计并合成了针对大鼠myocardin 3个不同的靶点shRNA序列和1个阴性对照shRNA序列,并利用BLAST进行查询,确定其为特异性序列,合成的DNA两端设计有AgeI或EcoR I 酶切位点及黏端。将合成的双链shRNA通过DNA连接酶连接入慢病毒干扰空载体(pGCSIL - GFP),经抗性基因筛选,PCR和克隆测序证实了目的序列正确连接入克隆。
为验证设计的慢病毒干扰载体能正常工作,我们进一步构建了一个myocardin的过表达载体。Flag是一个由十几个氨基酸组成的蛋白标签,由目的蛋白和标签(tag)共同构成的蛋白嵌合体,常标记于重组蛋白质的氨基端以帮助分析靶蛋白的生物学功能,用于目的细胞暂时不易得到或目的细胞转染效率非常低基因靶点的筛选[11]。鉴于myocardin整个CDS碱基近3 000 bp,完整CDS克隆很难得到,根据文献[13,14],我们将Flag标记引入myocardin过表达质粒。我们将一段长800多bp的CDS序列(已经包含设计的3条干扰质粒序列)合成并克隆入经EcoR I和KpnI双酶切线性化pEGFP - N1 / X124G表达载体,该表达载体再接上Flag标签,合成后的过表达载体pEGFP - N1 -myocardin形成myocardin - GFP融合蛋白并表达Flag。合成后的表达质粒经转染293T工具细胞后,荧光显微镜下见到明显的绿色荧光,证实该过表达质粒正常工作。进一步将此myocardin过表达质粒与不同干扰位点的慢病毒干扰质粒共转染工具细胞,Western blotting检测工具细胞内Flag的表达情况,结果证实设计的3条针对myocardin的慢病毒干扰质粒有2个位点(#1和#3)具有明显的敲减效应,敲减效率gt;75%。我们选择了#1质粒进行慢病毒的大量包装,最后得到滴度分别为1×1012TU/L和5×1012TU/L的pGCSIL - GFP - shMyocd和对照lentivirus - GFP - NC病毒载体。
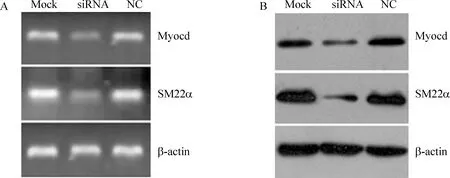
Figure 4. Myocardin lentiviral RNAi vector attenuated myocardin expression in VSMCs accompanied with the decrease of SM22α expression.A: RT - PCR;B: Western blotting. Mock: pGCSIL - GFP empty vector;siRNA: pGCSIL - GFP - shMyocd;NC: pGCSIL - GFP - NC.
将#1干扰病毒转染VSMCs后,发现其显著下调VSMCs中myocardin的表达,同时伴随VSMCs分化标志物SM22α的表达显著下降。提示该myocardin慢病毒干扰质粒能正常工作。SM22α是VSMCs典型的收缩标志物,其启动子区域含多个CArG序列。Myocardin与SRF形成三联复合物后,能调控具有CArG序列心肌细胞和平滑肌细胞基因的表达[3]。当共转染外源性SRF和myocardin过表达质粒后,VSMCs中包括SM22α在内的收缩标志物表达明显增加[15],在骨髓间充质干细胞向VSMCs诱导分化过程中也伴随myocardin及SM22α在内的收缩标志物表达的增加[16],因而提示myocardin在VSMCs分化过程起重要作用。我们前期的结果也证实这一点[6,7]。
VSMCs是一种表型可塑性细胞。在动脉粥样硬化、血管损伤后内膜增生、低氧性肺动脉重塑等血管疾病中VSMCs由收缩表型转化为合成表型。鉴于myocardin在VSMCs分化中的重要作用,预示着基于myocardin靶点对涉及VSMCs表型转化性血管疾病如动脉粥样硬化等血管重塑性疾病进行分子治疗的可能性。本研究中有关pGCSIL- GFP - shMyocd重组质粒的构建为进一步的研究奠定了基础。
[1] Owens GK, Kumar MS, Wamhoff BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease [J]. Physiol Rev, 2004,84(3):767-801.
[2] Yoshida T, Owens GK. Molecular determinants of vascular smooth muscle cell diversity [J]. Circ Res, 2005,96(3):280-291.
[3] Wang D, Chang PS, Wang Z, et al. Activation of cardiac gene expression by myocardin, a transcriptional cofactor for serum response factor [J]. Cell, 2001,105(7): 851-862.
[4] Wang Z, Wang DZ, Hockemeyer D, et al. Myocardin and ternary complex factors compete for SRF to control smooth muscle gene expression [J]. Nature, 2004,428(6979): 185-189.
[5] Chen J, Kitchen CM, Streb JW, et al. Myocardin: a component of a molecular switch for smooth muscle differentiation [J]. J Mol Cell Cardiol,2002,34(10):1345-1356.
[6] Jie W, Wang X, Zhang Y, et al. SDF-1α/CXCR4 axis is involved in glucose- potentiated proliferation and chemotaxis in rat vascular smooth muscle cells [J]. Int J Exp Pathol, 2010, 91(5):436-444.
[7] Jie W, Guo J, Shen Z, et al. Contribution of myocardin in the hypoxia-induced phenotypic switching of rat pulmonary arterial smooth muscle cells [J]. Exp Mol Pathol, 2010, 89(3):301-306.
[8] 主鸿鹄, 徐开林. 慢病毒载体的改进及其在血液病基因治疗中的应用[J]. 中国实验血液学杂志,2003,11(2):208-212.
[9] Berezhna SY, Supekova L, Supek F, et al. siRNA in human cells selectively localizes to target RNA sites [J]. Proc Natl Acad Sci USA,2006,103(20): 7682-7687.
[10]Matveeva O, Nechipurenko Y, Rossi L, et al. Comparison of approaches for rational siRNA design leading to a new efficient and transparent method [J]. Nucleic Acids Res, 2007,35(8):e63.
[11]Kurachi S, Koizumi N, Sakurai F, et al. Characterization of capsid- modified adenovirus vectors containing heterologous peptides in the fiber knob, protein IX, or hexon[J]. Gene Ther,2007,14(3): 266-274.
[12]陈 艳,邵建永,吴秋良,等. 线粒体细胞色素C氧化酶RNAi慢病毒载体的构建[J]. 中国病理生理杂志,2005, 21(6):1117-1123.
[13]史艳侠, 韩文杰, 彭柔君,等. 使用FLAG标签肽及慢病毒载体共同筛选小鼠foxp3基因RNA干扰的有效靶点[J]. 中山大学学报(医学科学版),2007,28(6): 641-644.
[14]Cordelier P, Strayer DS. Using gene delivery to protect HIV- susceptible CNS cells: inhibiting HIV replication in microglia [J]. Virus Res,2006,118(1-2): 87-97.
[15]许丽辉, 何 强. Myocardin在大鼠血管平滑肌细胞表型转化中的作用机制[J].中国老年病学杂志,2010,30(17):2483-2486.
[16]李 燕,瞿智玲,黄 冠,等. Myocardin在骨髓间充质干细胞向平滑肌细胞分化过程中的表达[J]. 中华病理学杂志,2008,37(10):680-686.
ConstructionofalentiviralRNAinterferencevectortargetingratmyocardinanditseffectonvascularsmoothmusclecelldifferentiation
JIE Wei1, 2, SHEN Zhi-hua1, WANG Xiao-yan2, KUANG Dong2, WANG Guo-ping2, AO Qi-lin2
(1DepartmentofPathology,SchoolofBasicMedicalScience,GuangdongMedicalCollege,Zhanjiang524023,China;2InstituteofPathology,TongjiHospital,HuazhongUniversityofScienceamp;Technology,Wuhan430030,China.E-mail:Aoqilin@126.com)
AIM: To construct a lentiviral RNA interference(RNAi)vector targeting rat myocardin mRNA and to investigate its effect on the differentiation of vascular smooth muscle cells(VSMCs).METHODSThree pairs of dsDNA targeting rat myocardin mRNA were designed, synthesized and cloned into lentiviral vector pGCSIL-GFP to generate pGCSIL-GFP-shMyocd lentvirus. A Flag-tagged myocardin-overexpression vector pEGFP-N1-Myocd was constructed with pEGFP-N1/X124G. After these two vectors were cotransfected into 293T cells, the flag protein was assessed by Western blotting to analyze the knockdown effect of pGCSIL-GFP-shMyocd. The expression of myocardin and SM22α was also detected by RT-PCR and Western blotting after the pGCSIL-GFP-shMyocd viruses were transfected into primary cultured rat aortal VSMCs.RESULTSThe rat myocardin lentviral RNAi vector pGCSIL-GFP-shMyocd and myocardin-overexpression vector pEGFP-N1-Myocd were successfully constructed. After these two kinds of vectors were cotransfected into 293T cells,the No.1 interfering vector displayed the highest inhibitory effect on flag expression.After the No.1 lentvirus at the titer of 1×1012TU/L was transfected into VSMCs, the myocardin and SM22α expression was significantly attenuated.CONCLUSIONThe lentiviral pGCSIL-GFP-shMyocd RNAi vector is successfully constructed, which is useful for further study regarding the molecular mechanism of the phenotypic switching in VSMCs under special pathological conditions such as atherosclerosis. Inhibition of myocardin expression in VSMCs leads to the decrease in the expression of differentiation marker, and implies a crucial role of myocardin in VSMCs differentiation.
Myocardin; Vector construction; Lentivirus; Vascular smooth muscle cells; Cell differentiation
1000-4718(2011)04-0823-06
R329.2
A
10.3969/j.issn.1000-4718.2011.04.040
2010-09-30
2011-01-19
国家自然科学基金资助项目(No.30400192)
△通讯作者Tel:027-83650551;E-mail: Aoqilin@126.com

