使用二重PCR方法快速检测单核细胞增生性李斯特氏菌的研究
吴晓薇 ,徐成刚 ,李 贺 ,江经纬 ,叶贺佳 ,区燕宜 ,徐小芹 ,廖 明
(1.华南农业大学兽医学院,广东广州 510642;2.广东检验检疫技术中心,广东广州 510623;3.广东省动物源性人兽共患病预防与控制重点实验室,广东广州 510642,4.南海出入境检验检疫局,广东佛山 528200)
单核细胞增生李斯特菌(L.monocytogenes,LM)是食品卫生上重要的病原菌。它广泛存在于自然界,可导致人和动物脑膜炎、流产、败血症等,病死率高达30%~70%,是目前人类最重要的食物源性病原菌之一[1-3],WHO将其列为20世纪90年代食品中四大致病菌之一[4]。也被列为21世纪对中国人卫生健康具有重大影响的12种病原微生物之一[3]。该菌生长温度范围较广,在4℃~6℃的冷藏情况下能较快生长和繁殖,引起冷藏食品包括冷藏肉品严重污染,因此该菌作为一种重要的食源性病原在各国已引起食品加工部门、公共卫生部门的高度重视和研究者的研究兴趣,许多国家都加强了对该菌的检测及研究工作。
李斯特菌的检测方法主要有细菌分离、血清学检测、ELISA技术、基因探针技术、PCR技术等[2],但现有各种方法都各有其优缺点。已知的LM毒力因子包括溶菌素基因(Hly)、iap基因、磷酸脂酶C基因(plcB)、actA基因、由转录激活调节蛋白基因(prfA基因)、内化素(Inl)、表面蛋白 P104等[4]。研究资料表明,编码溶菌素的Hly基因和编码内化素的Inl基因是LM最重要的致病基因,这2个致病基因的位点均在染色体内,两者缺一均无致病性[5]。巢国祥[6]、ROBIN L T[7]应用Hly基因作为扩增的靶基因来检测LM,徐宝梁等[8]、JUNG Y S等[9]应用InlA基因作为扩增的靶基因来检测LM,说明了检测Hly基因以及InlA基因,对LM具有鉴别意义。国内有LM的PCR的检测方法,但本研究以LM特异的Hly和InlA基因作为扩增靶目标,建立二重PCR方法用以检出和鉴别LM,具有更好的特异性、敏感性和通用性,为快速、准确检测食品中LM提供了更有力的检测手段。
1 材料与方法
1.1 菌株
单增李斯特菌标准株LM-C53003、LM-C53004和LM-C53005购自中国药品生物制品检定所;自禽类产品中分离的单增李斯特菌LM-47株、LM-233株和LM-814株,以及多杀性巴氏杆菌、大肠杆菌、沙门氏菌、副鸡嗜血杆菌由华南农业大学兽医学院禽病研究室鉴定和提供。
1.2 引物设计与合成
参考GenBank分别针对LM的Hly基因和InlA基因设计特异性引物,分别命名为Hly-L、Hly-U、inlA-L和inlA-U(表1)。引物由上海生工生物工程公司合成,用DEPC处理的去离子水稀释成25pmol/μL备用。

表 1 引物序列及理论扩增长度
1.3 针对LM的Hly基因和InlA基因的二重PCR方法的建立
将适量的指数生长期的LM标准株LM-C53005用细菌基因组DNA提取试剂盒(上海生工生物工程公司产品)提取基因组DNA。再分别用针对Hly基因的引物对Hly-L和Hly-U、针对InlA基因的引物对inlA-L和inlA-U,以及4条引物的等比例混合物对LM-C53005株基因组DNA进行PCR扩增,PCR反应条件为94℃ 4 min;94℃ 1 min,55℃ 1 min,72℃1 min,循环 30 次;72℃ 10 min。
1.4 二重PCR产物的鉴定和测序
将Hly基因和InlA特异性引物的PCR产物送上海生工生物工程技术服务有限公司进行序列测定。
1.5 二重PCR方法的特异性检测
参照1.3建立的二重PCR方法,检测单增李斯特菌标准菌株LM-C53005、多杀性巴氏杆菌、大肠杆菌、沙门氏菌,副鸡嗜血杆菌、英诺克李斯特菌。
1.6 二重PCR方法的敏感性检测
将LM标准菌株LM-C53005接种到10 mL TSB-YE肉汤中,35℃培养24 h,摇匀后取出1 mL菌液用灭菌生理盐水按照10倍稀释法,从原液连续稀释至10-5,参照1.3建立的二重PCR方法进行检测。同时用常规的菌落计数法对原液进行计数,并推导出各稀释浓度培养物中的细菌数。
1.7 二重PCR方法的重复性检测
以建立的二重PCR检测方法,重复3次,验证结果的可靠性。
1.8 二重PCR方法的通用性检测
用LM标准株LM-C53005、LM-C53004、LM-C53003,以及LM分离株LM-47、LM-233和LM-814作为检测对象,参照1.3建立的二重PCR方法进行检测,共重复3次。
1.9 临床样品的检测
按照(GB/T4789.30—2003)中LM攻毒小鼠试验的方法进行攻毒试验,将标准株LM-C53003、LM-C53004 株、LM-C53005、分离菌株 LM-47、LM-233、LM-814和英诺克李斯特菌别接种到10 mL TSB-YE中,35℃培养24 h后,将10 mL培养物全部转移到离心管中,以2500 r/min离心30 min,弃去上清液,用灭菌生理盐水制成浓度约为1010CFU/mL。各培养的菌株分别通过腹腔注射途径感染5只体重16-18g SPF级BABL/C小鼠,0.lmL/只(约109CFU)。同时用标准株LM-C53005作阳性对照,用英诺克李斯特菌作阴性对照组。将死亡小鼠组织(心、肝、脾、肺、肾和脑),直接放入TSB-YE肉汤中增菌,按照二重PCR的反应体系,对菌液进行二重PCR鉴定。
2 结果与分析
2.1 LM的Hly基因和InlA基因的二重PCR方法的建立
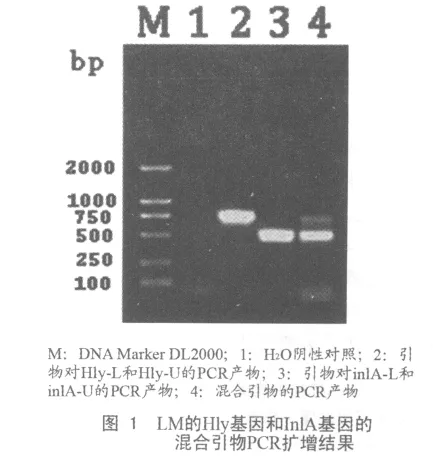
以LM标准菌株LM-C53005的基因组DNA为模板,用针对Hly基因和InlA基因的特异性引物及4条混合引物分别进行PCR扩增,Hly基因和InlA基因均扩增出清晰条带,大小分别为744 bp和520 bp,与预期结果相符(图1)。
2.2 LM的二重PCR的特异性检测
从图2可看出,采用该研究建立的LM的二重PCR方法能够顺利扩增出LM标准菌株LM-C53005的与试验设计相符合的Hly基因 744 bp和InlA基因520 bp的目的片段,而以多杀性巴氏杆菌、大肠杆菌、沙门氏菌、副鸡嗜血杆菌和英诺克李斯特菌的基因组DNA为模板均未扩增出任何特异产物。

2.3 LM的二重PCR方法的敏感性检测
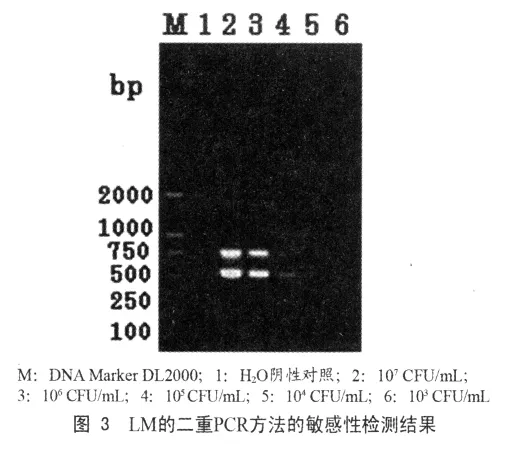
经检测,LM标准菌株LM-C53005的24 h培养物原液中细菌浓度为108 CFU/mL,新建立的LM的二重PCR方法的灵敏度为104CFU/mL(图3)。
2.4 LM的二重PCR方法的重复性检测
如图 4所示,以 LM标准株 LM-C53005、LM-C53004、LM-C53003 和 LM 分 离 株 LM-47、LM-233、LM-814的基因组DNA为模板,进行PCR扩增,均可得到清晰可见的目的条带。该试验重复3次,结果一致。
2.5 临床样品的检测结果
以死亡小鼠标准株LM-C53003株-心、LM-C53004株 -肝、LM-C53005株 -肺、LM-47-肺、LM-47-肝、LM-233-肺、LM-233-肝、LM-814-肺、LM-814-肝的TSB-YE肉汤中增菌培养液进行二重PCR鉴定,结果见图5。

菌液PCR结果中只出现一条特异性阳性条带的样品有标准株LM-C53003株-心、LM-C53004株-肝、LM-47-肺和LM-233-肺,用它们的培养物按照传统的方法进行分离纯化鉴定后确定为LM。
3 讨论与结论
传统的单增李斯特菌检验方法仍停留在常规增菌培养、血清和生化鉴定水平。这种鉴定方法检验周期较长,至少需要7 d左右,且结果不稳定、检出率低[10-11]。本试验在进行单增李斯特菌Hly基因和Inla基因单项PCR基础上通过对病毒引物、dntp、模板用量及反映温度的筛选,建立了检测单增李斯特菌的二重PCR快速特异性鉴别诊断方法。
新建的二重PCR方法作为LM的初步鉴定技术具有简便、快速、敏感、特异等特点。在试验过程中对临床样品,直接进行二重PCR检测,同时出现2条特异性的目的带可以直接确认为LM。部分样品不能同时出现2条特异性带,但只要出现其中的一条即可判定为疑似LM后可以用分离培养基培养纯化,再对纯培养物进行二重PCR方法鉴定或进行传统的分离培养进行鉴定。
二重PCR对纯培养的检测结果比较理想。因为直接对食品或禽类样品进行检测时,许多复杂成分会抑制Taq酶的活性。在二重PCR检测之前最好对样品进行增菌培养,一来可以提高目的DNA量,二来可稀释样品中的抑制成分,大大提高了检出率。
本研究针对单增李斯特菌溶血素基因和内化素基因保守的区域自行设计2对特异性引物,建立了相应的二重 PCR检测方法,经试验检验,本研究具有良好的特异性、敏感性和通用性,为快速、准确检测食品中LM提供了更有力的检测手段,同时为其防制工作的开展提供了强有力的技术支持。
[1]余淑冰,梁景涛,周强忠.单核细胞增生李斯特氏菌污染调查及快速检验方法的比较[J].中华预防医学杂志,1998,32(4):240-241.
[2]郁庆福,蔡宏道,何晓青.现代卫生微生物学[M].北京:人民卫生出版社,1995:116-117.
[3]梁锐萍,黄素珍,胡慧强.单核细胞增生性李斯特氏菌及其检验[J].动物科学与动物医,2004,21(11):48-49.
[4]王俊霞,王兴龙,秦兰柱.产单核细胞李斯特菌毒力因子及免疫预防研究进展[J].动物医学进展,2007,28(2):78-81.
[5]雷祚荣.细菌毒素分子生物学[M].北京:中国科学技术出版社,1993:190-198.
[6]巢国祥,徐勤,周晓辉,等.单核细胞增生性李斯特菌PCR快速检测方法建立及应用 [J].中国人兽共患病杂志,2004,20(9):797-799.
[7]Churchill R L,Lee H,Hall JC.Detection of Listeria monocytogenes and the toxin listeriolysin O in food[J].JMicrobiol Methods,2006,64(2):141-170
[8]徐宝梁,贾建会,陈颖,等.单核细胞增生李斯特氏菌的PCR检测方法[J].食品与发酵工,2004,30(6):100-103.
[9]Jung Y S,Frank JF,Brackett R E,et al.Polymerase chain reaction detection of Listeria monocytogenes on Frankfurters using oligo-nucleotide primers targeting the genes encoding internalin AB[J].JFood Prot,2003,66(2):237-241.
[10]Prazak A M,Murano EA,Mercado I,et al.Prevalence of Listeria monocytogenes during production and postharvest processing of cabbage[J].JFood Prot,2002,65(11):1728-1734.

