GST-LMO1融合蛋白表达载体的构建及其在原核细胞中的表达
顾卉,佟宇鑫,刘彤,李慧,李丹妮,袁正伟
(中国医科大学 1.附属盛京医院实验研究中心;2.基础医学院细胞生物教研室,细胞生物学教育部、卫生部重点实验室;3.第9 4期临床医学系,沈阳 1 1 0 0 0 1)
LMO家族是只包含LIM结构域的一类蛋白,由两个串联的LIM结构域构成。LIM结构域,大约有55个氨基酸,是一种高度保守的半胱氨酸富集的锌指结构基序。LMO家族包括4个成员(LMO1~4),其中LMO1是重要的一员,其编码序列全长为470个碱基,编码157个氨基酸。LMO1在核内与其它转录因子结合,参与细胞谱系的决定、细胞分化的调节、细胞增殖的控制。研究表明,LMO1与急性T淋巴细胞白血病、神经母细胞瘤及胃癌的发生发展密切相关[1~3]。
LMO1中的LIM结构域可作为蛋白质相互作用的表面,与其他蛋白如转录调节因子结合形成复合体,来间接影响基因的转录活性,因而成为细胞核内的辅助转录因子[4]。本研究旨在构建LMO1基因全长及其截短突变体的原核表达载体,并在原核细胞大肠埃希菌E.coli中表达其融合蛋白,为LMO1的结构功能及其信号通路的研究提供基础。
1 材料与方法
1.1 材料
原核表达载体pGEX-5X-2购自美国Clontech公司;E.coliDH5α和BL21均由实验室自行制备;PyrobestTMDNA聚合酶、BamHⅠ和EcoRⅠ内切酶、T4 DNA连接酶、电泳凝胶回收试剂盒均购于NEB公司;DNA marker、Protein marker 购于南京金斯瑞公司;异丙基硫代β-D-半乳糖苷(IPTG)购于Amresco公司;抗GST单克隆抗体购于Cell Signaling公司;HRP标记的羊抗鼠第二抗体购于中山公司;ECL试剂盒购于GE公司。引物合成与DNA序列测定由南京金斯瑞公司完成。

表1 构建L MO 1全长及截短突变体原核表达质粒所用引物序列T a b.1 T h e p r i me r s o f t h e p r o k a r y o t i c e x p r e s s i o n p l a s mi dL MO 1a n d i t s d e l e t i o n mu t a n t s
1.2 全长及截短突变体原核表达载体的构建
以质粒pcDNA-3.1/His A-LMO1为模板,PCR扩增LMO1基因全长及其截短片段(图1),所用PCR扩增引物见表1。PCR反应条件为95℃预变性5 min后,进行如下循环:95℃变性40 s,55℃退火45 s,72℃延伸2 min,循环30次,72℃再延伸10 min。将PCR产物进行琼脂糖凝胶电泳,纯化回收PCR产物后,用BamHⅠ和EcoRⅠ双酶切,再次电泳纯化回收后,与同样经过BamHⅠ和EcoRⅠ双酶切的原核表达载体pGEX-5X-2连接,4℃过夜后转化E.coliDH5α感受态细胞,37℃培养过夜后,挑取单克隆菌落,接种并培养过夜。用碱裂解法提取质粒后,用BamHⅠ和EcoRⅠ双酶切并用琼脂糖凝胶电泳鉴定正确,经进一步测序证实序列正确无突变后,将LMO1基因全长质粒命名为FL,各截短突变体质粒分别命名为A~E。
1.3 重组蛋白在原核细胞中的诱导表达
将全长及截短突变体质粒分别转化至感受态细胞E.coliBL21中,37℃培养过夜。挑取单克隆菌落,接种并37℃培养过夜,1∶200稀释菌液后继续培养至OD600为0.6左右时,加入终浓度为0.5 mmol/L的诱导剂IPTG,30℃诱导3 h后,收集菌液,进行SDS-PAGE电泳。将PAGE胶进行考马斯亮蓝染色,再经脱色后观察结果。
1.4 Western blot分析
将诱导成功的融合蛋白进行10%SDS-PAGE凝胶电泳,4℃转膜过夜,用5%脱脂奶粉封闭2 h,TBST 洗膜 3次,10 min,加入抗 GST 抗体(1∶1 000),室温慢慢摇晃杂交2 h,TBST洗膜3次,10 min,加辣根过氧化物酶标记的羊抗鼠二抗(1∶5 000),室温慢慢摇晃杂交1 h,TBST洗膜3次,10 min,ECL发光。
2 结果
2.1 LMO1全长及截短突变体原核表达载体的构建及鉴定
将构建的LMO1原核表达质粒FL,A~E经BamHⅠ和EcoRⅠ双酶切并琼脂糖凝胶电泳后分别得到约 5 kb 及 480,249,189,222,180,372 bp 的两条带,与预期结果一致(图2)。经进一步DNA测序鉴定序列正确,无突变。

图1L MO 1及其截短突变体模式图F i g.1 S c h e ma t i c d i a g r a ms o fL MO 1a n d t h e i r d e l e t i o n mu t a n t s

图2 重组质粒F L,A~E经B a mHⅠ/E c o RⅠ双酶切鉴定电泳结果F i g.2 B a mHⅠ/E c o RⅠd i g e s t i o na n de l e c t r o p h o r e s i sa n a l y s i so f t h e p l a s mi d s F L,A~E
2.2 LMO1重组质粒在原核细胞E.coli中的诱导表达
将LMO1重组质粒FL,A~E分别转化至E.coli BL21中,挑取单克隆,在 1 mmol/L IPTG,30℃,3 h的条件下诱导表达,经10%SDS-PAGE电泳进行分离,考马斯亮蓝染色后分别在 43,35,32,34,32 和39 kDa附近出现明显的特异性条带,其分子量分别与预期的重组融合蛋白FL,A~E相符(图3)。
2.3 GST-LMO1重组融合蛋白的Western blot鉴定
Western blot法鉴定LMO1全长及截短突变体融合蛋白的表达。结果可见在分子量分别约为43,35,32,34,32 和 39 kDa附近出现特异性条带(图4),为LMO1全长及截短片段分子量(分别为17,9,6,8,6和 13 kDa)与原核载体 pGEX-5X-2 中 GST 分子量(26 kDa)之和,说明LMO1的全长与截短突变体重组融合蛋白正确表达。
3 讨论

图3 S D S-P A G E分析G S T-L MO 1融合蛋白在原核细胞中的表达F i g.3 S D S-P A G Ea n a l y s i so f t h ee x p r e s s i o no f G S T-L MO 1f us i o n p r o t e i n s i n p r o k a r y o t i c c e l l
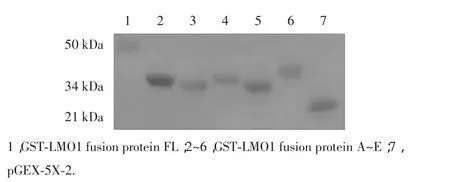
图4 We s t e r nb l o t法分析G S T-L MO 1全长及其截短突变体融合蛋白的表达F i g.4We s t e r nb l o t a n a l y s i so f G S T-L MO 1f u l l l e n g t ha n di t s d e l e t i o n mu t a n t f u s i o n p r o t e i n s
LMO是仅含LIM结构域的单纯LIM蛋白家族中的一类,它含有一个或多个LIM结构域。LIM结构域是一种高度保守的半胱氨酸富集的锌指结构基序,是胚胎发育过程中的重要调节蛋白,在决定细胞命运、控制细胞生长及分化中起着关键的作用[5]。研究证实,LMO1与肿瘤的发生发展有密切关系:过表达LMO1的转基因鼠发育不成熟,形成急性T淋巴细胞白血病,提示它是T淋巴细胞白血病的原癌基因[6];有报道表明LMO1与神经母细胞瘤的发生发展密切相关[2];并且参与胃癌中的凋亡过程[3]。
为了研究LMO1的结构与生物学功能,获得LMO1纯化蛋白,根据LMO1全长及截短序列,设计了6对特异性的引物,并在引物中引入了BamHⅠ和EcoRⅠ酶切位点,以质粒pcDNA-3.1/His ALMO1为模板,扩增出LMO1基因全长及其截短突变体序列,利用酶切电泳鉴定以及DNA测序的方法,证实了pGEX-5X-2-LMO1全长及其截短突变体重组质粒构建成功。并在IPTG诱导下表达了其重不好;胆碱酯酶复能剂吸收差,且只能在72 h内应用,对已经老化的胆碱酯酶无效。因此,寻找一种新的更为有效的减少有机磷中毒的死亡率和致残率的药物是该领域研究中急待解决的关键问题。上世纪80年代,人们提出有机磷生物清除剂的概念,即在有毒的有机磷到达靶器官前能够鳌合或中和它们的酶或拮抗剂,并且用很小的量就可以达到有机磷清除的目的。提出清除剂的理论后,人们把目光聚焦在对PON1—哺乳动物血浆内的一种在有机磷中毒的自然防御中发挥作用的天然催化清除剂,并称之为最有前景的有机磷生物清除剂[1,8,9]。
本研究中,DDVP毒代动力学的结果支持PON1可以水解DDVP,降低DDVP的血中浓度。但应用阿托品+PAM-CL后,血中DDVP浓度并没有降低。这说明阿托品+PAM-CL对DDVP没有水解作用,与之前的研究相一致。同时,PON1与阿托品+PAM-CL联合应用也没有比单独应用PON1水解疗效强,因此,PON1联合应用阿托品+PAM-CL对PON1的催化水解作用没有药物间相互作用,所以两种方法可以在临床上联合应用。
AUC、MRT和Cmax是评价毒代动力学的重要指标,AUC值用来评价药物的入血量,MRT用来评价药物在体内的保留时间,Cmax用来评价药物在体内的最高浓度。本研究结果显示,与染毒组大鼠相比,应用PON1后,AUC值明显降低,Cmax明显减小,体内DDVP的入血量明显降低,峰浓度降低。但对平均保留时间影响不大。
综上所述,纯化兔血清PON1可以明显改善大鼠体内胆碱酯酶抑制水平,并可以明显降低DDVP入血量,降低峰浓度。
[1]Rochu D,Chabrière E,Masson P.Human paraoxonase:a promising approach for pre-treatment and therapy of organophosphorus poisoning[J].Toxicology,2007,233(1-3):47-59.
[2] Costa LG,Cole TB,Furlong CE.Polymorphisms of paraoxonase(PON1)and their significance in clinical toxicology of organophosphates[J].J Toxicol Clin Toxicol,2003,41(1):37-45.
[3]Aharoni A,Gaidukov L,Khersonsky O,et al.The “evolvability”of promiscuous protein functions[J].Nat Genet,2005,37(1):73-76.
[4] Khersonsky O,Tawfik DS.Structure-reactivity studies of serum paraoxonase PON1 suggest that its native activity is lactonase[J].Biochemistry,2005,44(16):6371-6382.
[5]Maxwell DM,Brecht KM,Chang F,et al.Toxicodynamic modelling of highly toxic organophosphorus compound[J].J Mol Neurosci,2006,30(1-2):129-131.
[6]赵敏,崔玥,袁丽.纯化兔血清对氧磷酶的萃取和纯化[J].中国医科大学学报,2009,38(7):490-492.
[7]Eckerson HW,Romson J,Wyte C,et al.The human serum paraoxonase polymorphism:identification of Pphenotypes by their response to salts[J].Am J Hum Genet,1983,35(2):214-227.
[8]Shigeaki I,Takeshi S,Hiroyasu M,et al.Rapid simultaneous determination for organophosphorus pesticides in human serum by LC-MS[J].J Pharma Bio Ana,2007,44(1):258-264.
[9]Voss G,Sachsse,K.Red cell and plasma cholinesterase activities in microsamples of human and animal blood determined simultaneously by a modified acetylthiocholine/DTNB procedure[J].Toxicol Appl Pharmacol,1970,16(3):764-772.

