树脂固定化α-乙酰乳酸脱羧酶的初步研究
陈 卿,蔡国林,陆 健,*
(1.江南大学,工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
树脂固定化α-乙酰乳酸脱羧酶的初步研究
陈 卿1,2,蔡国林2,陆 健1,2,*
(1.江南大学,工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
采用7种树脂对α-乙酰乳酸脱羧酶进行固定化,并将固定化酶应用于啤酒发酵实验,从中筛选出降低发酵液中双乙酰能力较强的大孔弱碱性丙烯酸系阴离子交换树脂D314FD作为固定化的载体。通过单因素和正交实验确定固定化ALDC的最优条件为:每克树脂加入1.25mL原酶液,吸附时间10h,吸附pH7.5,吸附温度15℃,在此条件下固定化效率可达44%。发酵实验亦表明,固定化ALDC可以显著降低发酵液中双乙酰的含量,降低率达40%以上。
树脂,α-乙酰乳酸脱羧酶,固定化
在啤酒发酵过程中,双乙酰是影响啤酒风味成熟、熟化期长短的主要因素。当双乙酰含量超过阈值(0.15mg/L)时,会产生令人不愉快的馊酸味,严重影响啤酒的口味[1]。啤酒中双乙酰的来源复杂,主要是由渗漏到酵母细胞外的代谢产物α-乙酰乳酸,经非酶氧化脱羧作用产生。α-乙酰乳酸的非酶氧化脱羧反应是缓慢进行的,其速度比双乙酰还原速度约慢10倍,是双乙酰还原的限时步骤[2]。传统除双乙酰的方法是低温储存啤酒,依靠酵母双乙酰还原酶将其还原成乙偶姻,再由乙偶姻还原酶最终还原为2,3-丁二醇。乙偶姻和2,3-丁二醇的味阈值较高,对啤酒的风味几乎没有影响。而这一熟化过程通常需要3~6周时间[3]。α-乙酰乳酸脱羧酶(α-acetolactate decarboxylase,简称ALDC,EC 4.1.1.5)可以使啤酒发酵液中的α-乙酰乳酸不经双乙酰途径,快速直接脱羧为乙偶姻。因而能缩短双乙酰的还原时间,加速啤酒的成熟,并可有效控制啤酒在储藏过程中双乙酰的反弹[4-6]。将ALDC应用于啤酒发酵,虽可缩短生产周期,但ALDC却不能反复使用,增加生产成本。而酶的固定化技术可以克服游离ALDC的上述缺点[7]。目前固定化技术基本上都停留在实验室研究阶段,这主要是因为固定化所用的载体材料几乎都集中在海藻酸盐、壳聚糖等有机材料上,虽然固定化效果较好,但由于载体材料耐腐蚀性差、不抗压、易变形,且无法再生,因而限制了此技术的工业化应用。树脂是工业上使用最广泛的材料之一,其价格低廉、机械强度好、容易再生,作为固定化载体有着广阔的应用前景[8]。本文从7种树脂中筛选出固定化ALDC效果良好的载体D314FD,对ALDC的固定化条件和固定化酶的应用进行相关研究,期望能够为工业化经济、高效应用提供理论依据。
1 材料与方法
1.1 实验材料
ALDC 购自宁夏夏盛实业集团有限公司;树脂分别购自浙江争光树脂实业公司与上海摩速科学器材有限公司;乙偶姻、2-乙酰-2-甲基乙酰乙酸乙酯(底物) 购自Sigma公司;MES[2-(N-吗啉代)乙基磺酸]、氯化钠、Brij35(布里吉)、氢氧化钠、α-萘酚、肌酸等 均为分析纯,购自国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 固定化载体的预处理 离子交换树脂先用蒸馏水浸泡胀润、去杂,然后用HCl、NaOH交替处理,最后用蒸馏水冲洗至中性;吸附树脂采用乙醇、蒸馏水交替处理,最后用蒸馏水冲洗至中性,置于4℃冰箱保存备用。
1.2.2 载体的选择 取处理后树脂约1.00g,分别加入5mL含一定量原酶液的磷酸缓冲液(pH6.0、0.2mol/L)中,摇匀,在摇床上15℃,120r/min振摇12h后抽滤,用去离子水洗涤数次,至洗涤液中无蛋白检出。将所得固定化ALDC应用于啤酒发酵实验,根据固定化酶对发酵液中双乙酰的降低率进行固定化载体的选择。
1.2.3 ALDC固定化条件的优化 取适量预处理树脂,用滤纸吸干表面的水分,称取0.20g,加入不同体积的原酶液,并用0.2mol/L,pH5.0~8.5的磷酸缓冲液补充至5mL,在5~25℃,120r/min下吸附固定1~12h。抽滤,并用去离子水反复洗涤树脂,抽滤得到固定化酶,置于冰箱保存备用。
1.2.4 游离酶活力测定 将样品酶液进行稀释,取20μL稀释酶液于试管中,加 MES缓冲液300μL,30℃水浴预热10min,将底物混合液同时放入30℃水浴预热10min;在反应管中加入80μL底物混合液,迅速混匀后立即置于30℃恒温水浴中,精确反应20min后,迅速加入4.6mL显色剂(0.1%肌酸,1% α-萘酚的1mol/L NaOH溶液),混匀,置30℃显色40min后于522nm处读取吸光值。用MES缓冲液代替样品酶液的反应管作为空白对照。
酶活力定义:在pH6.0,30℃条件下,每分钟水解出1μmol乙偶姻的量定义为一个酶活单位(U)。
1.2.5 固定化酶活力测定 取适量固定化酶代替20μL稀释酶液于试管中,之后步骤同1.2.4。
1.2.6 双乙酰、酒精度、外观浓度、真正浓度、α-FAN的测定 参考文献[9]。
1.2.7 计算方法[10]相对酶活力:以同组样品中酶活力的最大值作为100%,其它值与最大值的百分比即为相对活力;固定化效率(%)=(加入酶总活力-上清液酶总活力)/加入酶总活力×100%;双乙酰降低率(%)=(加酶前双乙酰含量-加酶后双乙酰含量)/加酶前双乙酰含量×100%
1.2.8 正交实验数据处理方法 本实验需要考察两个指标,一个是固定化酶活力(x),另一个是固定化效率(y)。这两个指标的重要性有所不同,固定化酶活力的重要性比固定化效率的重要性大,因而确定二者的权重系数分别为2/3和1/3,按照加权平均法进行数据处理,通过公式z=(2/3)x+(1/3)y,得到综合评分z。
1.2.9 常规发酵实验方法 主酵使用下面酵母,11℃将酵母接入11°P左右的麦汁中,按照图1的发酵工艺进行发酵。
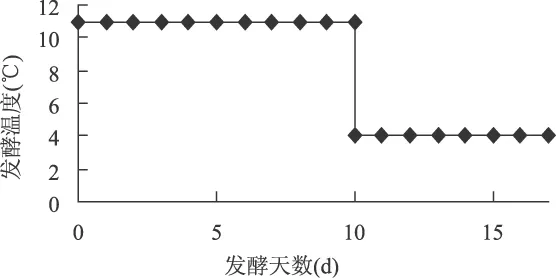
图1 发酵工艺曲线
1.2.10 固定化ALDC啤酒连续发酵方法 按照图1所示的方法,待发酵至后酵2.5d时,将发酵液存于缓冲罐1中,通过恒流泵2将其以一定的流速泵入固定化ALDC酶反应柱3中,进行啤酒连续发酵,还原其中的双乙酰,最终所得啤酒存于贮罐4中。将该系统放于生化培养箱中,控制系统的反应温度,并在酶反应柱进、出口处分别设有取样口。
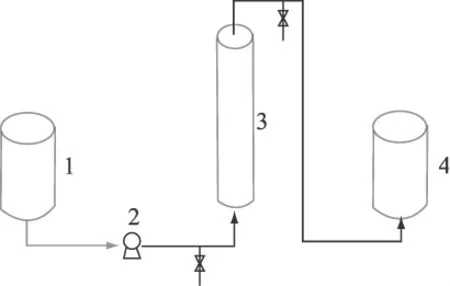
图2 固定化α-乙酰乳酸脱羧酶啤酒连续发酵系统
2 结果与讨论
2.1 树脂载体的选择
本实验中采用物理结合法对ALDC进行固定化,其是依靠离子键、氢键、范德华力等结合的一种固定化方法,该方法载体价廉易得,安全无毒,操作条件温和简单,易于工业化放大生产应用。所选用载体的物理化学性质对酶的固定化效果有重大影响,不同树脂对ALDC固定化效果的影响如表1所示。从表1中可以看出,不同载体对ALDC的固定化效果差别显著,其中丙烯酸系大孔弱碱性阴离子交换树脂D314FD固定ALDC,可以有效地降低发酵液中的双乙酰的含量,双乙酰降低率达50%以上,降低效果显著。通过重复实验,最终确定选择D314FD作为ALDC的固定化载体,并对其最适固定化条件做了进一步的研究。
2.2 单因素实验研究反应条件对ALDC固定化的影响
2.2.1 加酶量对固定化效果的影响 按照1.2.3方法,恒定其他条件(pH6.0,温度15℃,吸附时间8h),选择不同的原酶液添加量(0.25、0.50、1.00、1.25、1.50、2.00、2.50mL)分别制备固定化ALDC,测定固定化酶活力。研究不同加酶量对固定化效果的影响,结果如图3所示。从图3可知,随着加酶量的增加,固定化酶的相对酶活力和固定化效率均有所增加,当5mL酶液中原酶液的添加量为1.25mL时,相对酶活力增幅缓慢;在此添加量之后,随着加酶量的增加,载体上酶分子密度增大,位阻效应加剧,底物和产物的扩散受到某种程度的限制,导致固定化效率开始呈降低趋势[11],兼顾固定化酶相对活力和固定化效率这两者,选择5mL酶液中原酶液的添加量为1.25mL,此时ALDC的固定化效率可达43%。
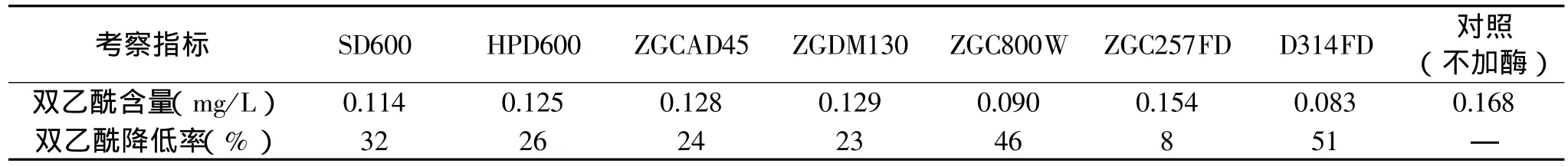
表1 不同树脂对α-乙酰乳酸脱羧酶固定化效果的影响
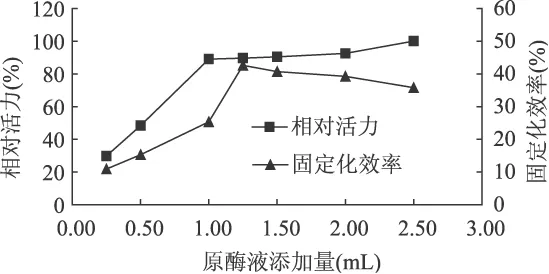
图3 加酶量对固定化效果的影响
2.2.2 吸附时间对固定化效果的影响 在上述实验基础上,研究不同吸附时间(1、2、4、6、8、10、12h)对固定化酶活力和固定化效率的影响,结果见图4。
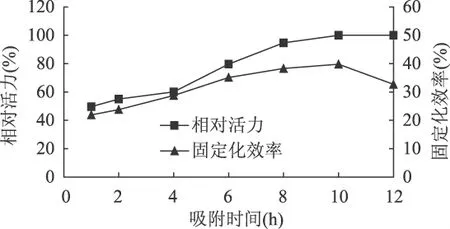
图4 吸附时间对固定化效果的影响
从图4可以看出,10h为最佳吸附时间。10h之前,随着吸附时间的延长,酶的相对活力和固定化效率呈上升趋势;当吸附时间高于10h时,随着时间的延长,固定化效率呈下降趋势。一方面是因为10h时,固定化酶的相对活力不再增加,树脂吸附ALDC达到饱和;另一方面,随着吸附时间的延长,游离酶活力下降。因此选择 10h作为 D314FD固定化ALDC的吸附时间。
2.2.3 吸附温度对固定化效果的影响 在上述实验基础上,研究不同吸附温度(5、10、15、20、25℃)对固定化酶活力和固定化效率的影响,结果如图5所示。从图5可知,当吸附温度在10~15℃时,吸附温度的微小变化不会引起固定化酶相对活力和固定化效率的急剧变化;当温度大于15℃时,固定化酶相对活力和固定化效率降低速度加快。其原因可能是,长时间的振荡,使得部分ALDC活力有所下降[12]。鉴于蛋白质的吸附是一个吸热过程,因此选择15℃作为ALDC的固定化温度。
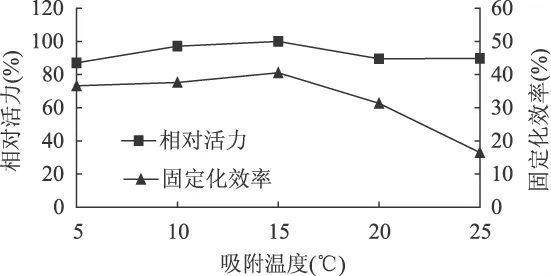
图5 吸附温度对固定化效果的影响
2.2.4 吸附pH对固定化效果的影响 在上述实验基础上,即每克树脂加1.25mL原酶液,15℃,吸附10h条件下,改变吸附pH,研究不同pH(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5)对固定化效果的影响,结果如图6所示。从图6可知,pH在7.0~7.5时,固定化效果最好。低于或高于此pH,固定化效率都有所降低。这主要是因为缓冲液pH的改变,会造成载体表面、酶分子表面的电荷分布以及载体与酶分子之间作用力的改变。已知所使用ALDC的等电点为4.5,所以一定要保证吸附pH大于4.5,使酶蛋白带负电荷,与阴离子交换树脂进行离子交换将其吸附到载体上;但若pH过高,也会影响ALDC的活性中心进而使固定化酶活力降低。
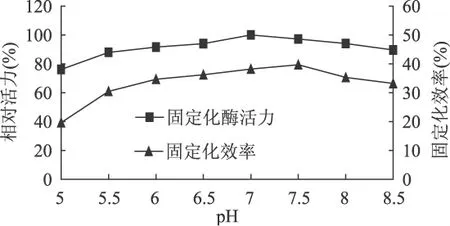
图6 吸附pH对固定化效果的影响
2.3 正交实验确定ALDC固定化最优条件
在单因素实验的基础上,以加酶量、吸附时间、温度、pH四个因素的不同水平进行正交实验,考察不同因素之间对固定化效果影响的综合效应,确定ALDC固定化的最优条件,结果见表2和表3。
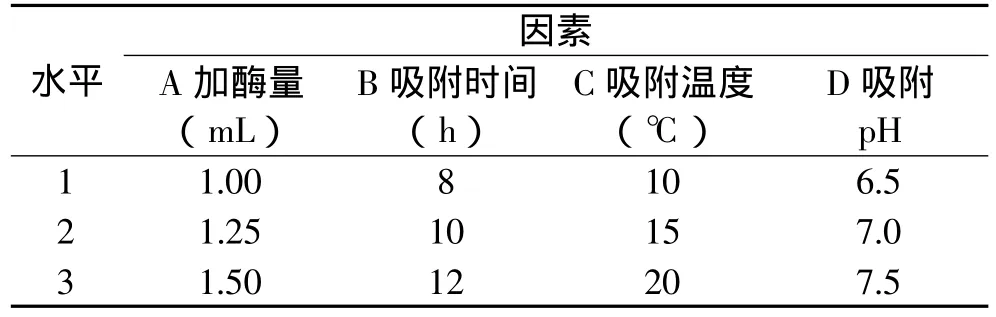
表2 正交实验因素水平
从表3数据可以看出,不同的固定化条件,所制得的固定化ALDC的酶活力和固定化效率有一定的差别。其中第4组实验的综合得分最高,固定化酶的活力最高,固定化效率为42.72%,实验条件为A2B1C2D3。根据正交实验的极差分析可知:C因素(吸附温度)的极差值6.776最大,故其对ALDC固定化效果的影响也最大;D因素(吸附pH)的极差值2.800最小,对固定化效果的影响也较小。四个因素对ALDC固定化效果影响的主次顺序为:吸附温度>加酶量>吸附时间>吸附pH。通过K值确定最优水平组合为:A2B2C2D3,即加酶量1.25mL,吸附时间10h,吸附温度15℃,pH7.5。而该条件在表3所列的实验中并没有出现,因此需要对此条件进行验证。以最优组合进行实验,测定固定化酶活力和计算固定化效率,结果表明:固定化酶的相对活力为105%,固定化效率为44%,其综合评分(z)为84.67,最高。通过验证实验,说明正交实验的结论是正确的。
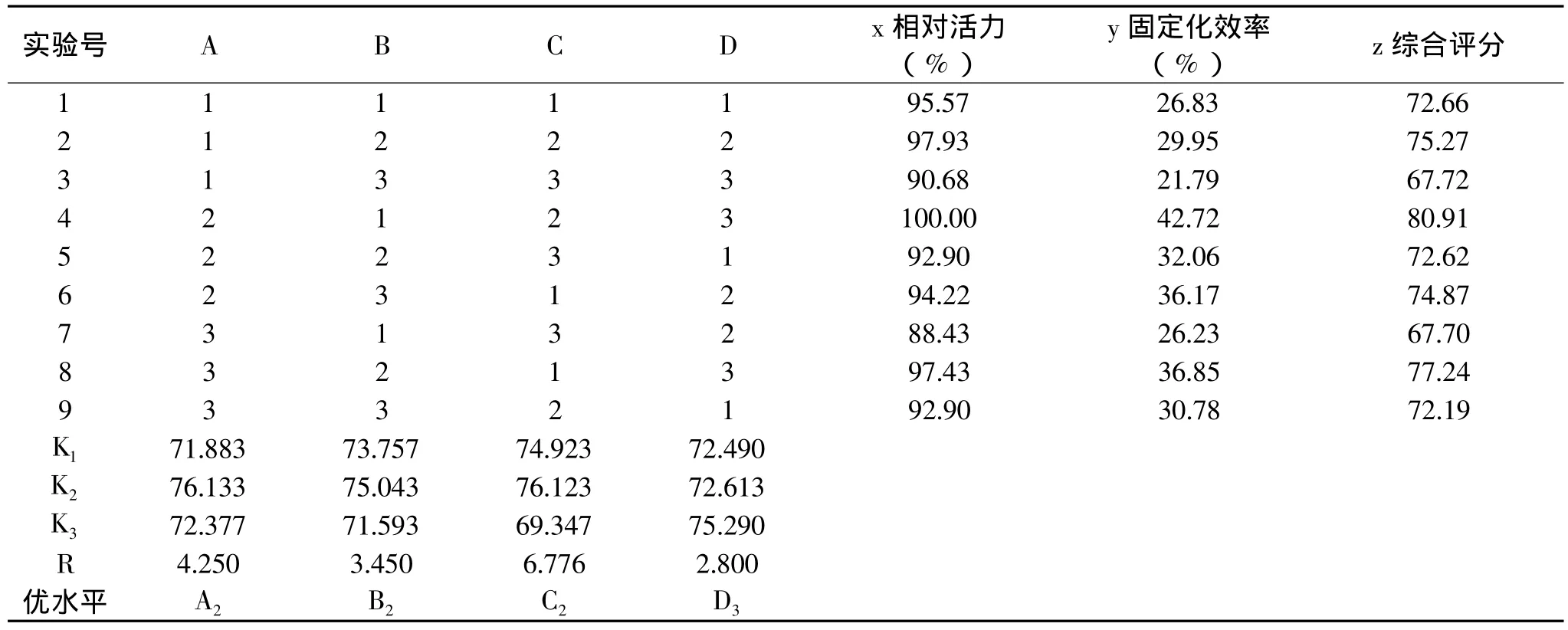
表3 正交实验结果
2.4 固定化ALDC在酿造啤酒上的应用
为了进一步验证ALDC的固定化效果,并初步探索固定化ALDC在啤酒酿造中的应用模式及其工艺,本文设计了重复分批酶解实验和连续酶解实验。2.4.1 重复分批酶解实验 在250mL三角瓶中加入200mL发酵一定时间的嫩啤酒发酵液和10g(以湿重计)固定化ALDC,在6℃,80r/min条件下反应72h。反应结束后,取样测定双乙酰的含量,计算双乙酰降低率。同时将分离出来的固定化ALDC,用无菌水反复洗涤数次后,添加到新的发酵液中进行下一批次的酶解反应。如此重复进行8次实验,结果如图7所示。
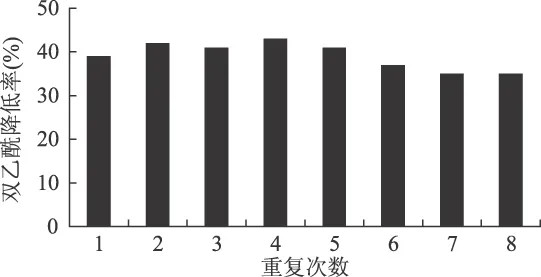
图7 固定化α-乙酰乳酸脱羧酶重复分批酶解实验结果
从图7中可知,随着固定化ALDC使用次数的增加,其双乙酰降低率由43%降至35%,降幅较小。所以,通过固定化条件的优化,所制备的固定化ALDC的催化性能相当稳定,且催化活力较高。这一结果对于提高酶的重复利用率,降低生产成本具有重大意义。
2.4.2 连续发酵实验 在120mL自制玻璃柱中装填湿重35g固定化ALDC,将发酵至后酵2.5d的嫩啤酒发酵液通过恒流泵以0.165mL/min的流速由底部进料,顶部出料,此时反应体系的保留时间约为12h,待系统达到稳态后,对流出样进行常规理化指标的测定(多次测定,取平均值),与实验室传统后酵发酵液相应指标进行比较。并通过t检验,比较了柱前、柱后发酵液常规理化指标间的差异性,结果如表4和表5所示。
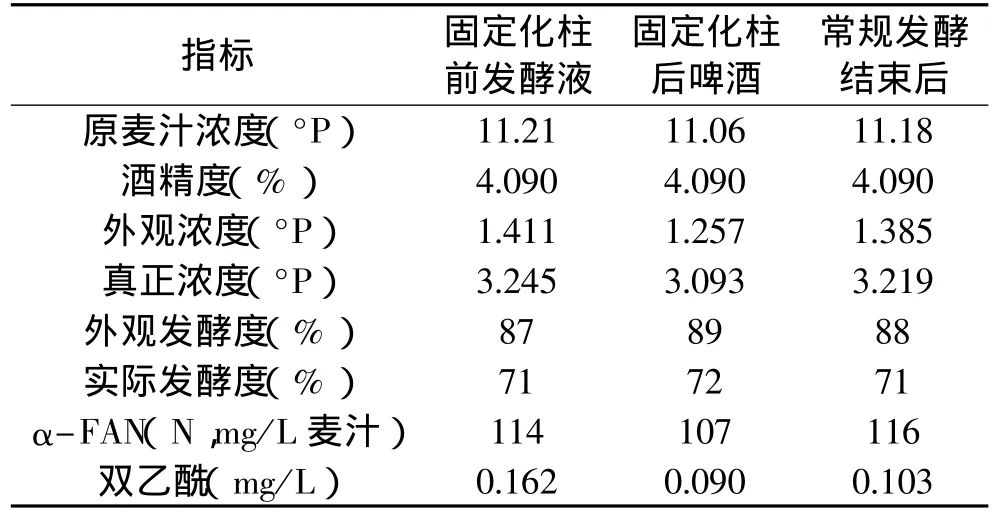
表4 啤酒主要理化指标的比较
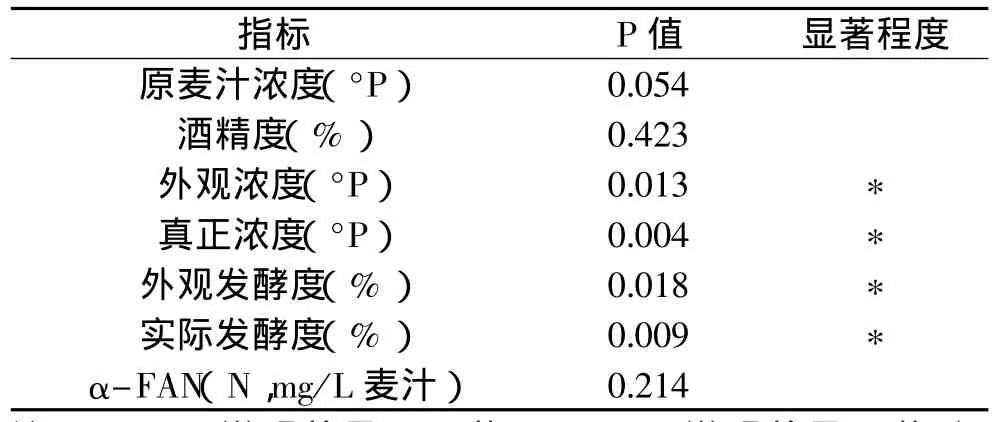
表5 反应柱前与柱后发酵液常规理化指标间t检验结果
从表4可知,固定化ALDC反应柱前和柱后发酵液中双乙酰含量差别显著,在保留时间为12h后,固定化柱流出液中的双乙酰含量为0.090mg/L,双乙酰降低率达44%。通过对反应柱前与柱后发酵液其他常规理化指标进行t检验(表5),结果表明:在外观浓度和真正浓度这两项指标上柱前与柱后发酵液间存在差异,从表4亦可知,固定化柱后比柱前发酵液的外观浓度和真正浓度平均低约0.2°P;而外观发酵度和实际发酵度是通过外观浓度和真正浓度计算得出,故而也存在一定的差异。这主要是因为树脂部分吸附发酵液中蛋白质的缘故所致。实验室常规后酵工艺至少需要7d才可以将双乙酰含量降至0.100mg/L,而采用固定化ALDC新工艺酿造啤酒达到相同的双乙酰含量水平时只需要3d左右即可,故而采用新工艺可以明显缩短发酵时间。从表4可知,使用固定化酶连续工艺生产的啤酒,其主要理化指标(除双乙酰)与常规工艺生产的啤酒比较接近。
3 结论
据相关文献报道,已经研究了壳聚糖、聚乙烯醇、磁性淀粉和IMMOPORE(一种多孔玻璃)等材料作为固定化 ALDC的载体[3,13-15],而用树脂进行ALDC固定化的报道甚少。由于ALDC主要应用于酿酒行业,本文所选用的ALDC固定化载体D314FD树脂,属于食品级树脂,因而使得固定化ALDC在使用上具有安全性。
本文应用吸附法固定化ALDC,方法简单,操作容易。通过单因素和正交实验得出固定化ALDC的最优条件为:在pH7.5磷酸缓冲液下,每克树脂加入1.25mL原酶液,15℃吸附10h。在此条件下固定化ALDC的固定化效率可达44%。
将采用优化条件制得的固定化ALDC初步应用于啤酒酿造实验,发现固定化ALDC的催化效率较高,性能稳定,重复使用8次后双乙酰降低率降幅较小。采用固定化ALDC反应柱系统进行啤酒连续发酵,在保留时间为12h时,该工艺所得的发酵液与常规工艺的发酵液,在常规理化指标上比较接近,并没有显著差异。ALDC固定化的成功为其在工业上的应用提供了参考。
[1]管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,1998:373.
[2]Lewis K F,Weinhouse S.Studies in valine biosynthesis,αacetolactate formation in microorganism[J].J Am Chem Soc,1958,80:4913-4915.
[3]New Results with an Immobilized Yeast System Secondary Fermentation with IMMOPORE[C].World Brewing Congress,San Diego,California,USA,2004.
[4]Shovers J,Shorewood W S,Sanding W E.Enzymatic removal of diacetyl from fermented beverages[J].U S Patent,1973(3):205,733.
[5]Claire Dulieu.Improved performances and control of beer Fermentation Using Encapsulated α-Acetolactate Decarboxylase and Modeling Biotechnol[J].Pron,2000,16:958-965.
[6]赵春海,阚振荣.乙酰乳酸脱羧酶的储存初探[J].酿酒科技,2007(3):28-31.
[7]陈乃用.α-乙酰乳酸脱羧酶加速啤酒成熟的研究进展与应用[J].工业微生物,2001,31(3):54-57.
[8]张树政.酶制剂工业(上册)[M].北京:科学出版社,1998.
[9]管敦仪.啤酒工业手册(中册)[M].北京:轻工业出版社,1982:190,215,234.
[10]赵林果,李丽娟,王平,等.海藻酸钠固定化β-葡萄糖苷酶的研究[J].生物加工过程,2007,5(4):25-31.
[11]邢晓慧,吕晓玲.胰蛋白酶的固定化及其性质的研究[J].食品研究与开发,2002,23(1):17-19.
[12]宋宝东,宋丽,庞春霞,等.树脂吸附法固定化Candida rugosa脂肪酶[J].化学工程,2009,37(4):8-10.
[13]王健华,朱宝成.壳聚糖固定化α-乙酰乳酸脱羧酶的研究[J].天津科技大学学报,2005,20(4):25-27.
[14]臧姝,钱斯日古楞,王红英,等.α-乙酰乳酸脱羧酶的磁性固定化条件研究[J].大连轻工业学院学报,2007,26(1):15-17.
[15]邱广亮,邱广明,等.磁性淀粉微球固定化乙酰乳酸脱羧酶及应用[J].广州化工,2000,28(4):24-27.
Preliminary study on immobilization of α-acetolactate decarboxylase by resin
CHEN Qing1,2,CAI Guo-lin2,LU Jian1,2,*
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Alpha-acetolactate decarboxylase was immobilized on 7 kinds of resins through adsorption,and then they were used in beer maturation.Among them,weak macroporous ion-exchange resin D314FD was selected as immobilized carrier for its good ability on reducing the content of diacetyl.The results showed that the optimum conditions for α-acetolactate decarboxylase immobilized as follows:1.25mL liquid α-acetolactate decarboxylase was added into one gram of pretreated resin,stirred for 10h at 15℃ in buffer of pH7.5.Under the optimal conditions,the immobilization efficiency could reach 44%.Fermentation trial also showed that immobilized ALDC could significantly reduce the content of diacetyl,and the rate of reducing was up to 40%.
resin;α-acetolactate decarboxylase;immobilization
TS201.2+5
A
1002-0306(2011)02-0154-05
2010-03-04 *通讯联系人
陈卿(1985-),女,硕士研究生,研究方向:发酵工程。
国家“十一五”支撑重点项目资助(2008BAI63B06);国家“十一五”支撑计划项目(2007BAK36B01);江苏省“青蓝工程”资助项目。

