对氯苯氧乙酰改性壳聚糖的制备、抑菌及机理研究
李小芳,冯小强,伏国庆,杨 声,*,王廷璞,苏中兴
(1.天水师范学院生命科学与化学学院,甘肃天水741001;2.天水市中医医院化验科,甘肃天水741001;3.兰州大学化学化工学院,甘肃兰州730000)
对氯苯氧乙酰改性壳聚糖的制备、抑菌及机理研究
李小芳1,冯小强1,伏国庆2,杨 声1,*,王廷璞1,苏中兴3
(1.天水师范学院生命科学与化学学院,甘肃天水741001;2.天水市中医医院化验科,甘肃天水741001;3.兰州大学化学化工学院,甘肃兰州730000)
采用红外、紫外和荧光光谱对合成的对氯苯氧乙酰改性壳聚糖进行了表征,研究了壳聚糖及对氯苯氧乙酰改性壳聚糖对六种常见细菌生长的影响。此外,考察了对氯苯氧乙酰改性壳聚糖对枯草芽孢杆菌细胞膜蛋白及其质粒DNA的影响。结果表明:对氯苯氧乙酰改性壳聚糖对阴沟肠杆菌和枯草芽孢杆菌的抑菌性能比壳聚糖本身增强;对粪肠杆菌和肺炎克罗伯杆菌,起初抑制效果较好,但随着作用时间的延长,却失去了抑菌能力;对金黄色葡萄球菌作用24h后,才有微弱的抑菌活性;而对大肠杆菌几乎没有抑制作用。对氯苯氧乙酰改性壳聚糖对枯草芽孢杆菌的抑菌作用,可能是猝灭了其细胞膜蛋白的内源荧光,而改变了膜蛋白的结构,并且破坏质粒DNA的双螺旋结构所引起的。
对氯苯氧乙酰壳聚糖,抑菌,机理
壳聚糖(简称CTS)能有效抑制细菌和真菌的生长[1-2],与一般抑菌剂相比,壳聚糖具有抑菌活性高、广谱、杀灭率高及对哺乳动物细胞毒性低等优点[3]。壳聚糖只能溶解于酸性溶剂,这极大地限制了它的应用范围。苯氧乙酸及其衍生物是一种传统的杀菌剂,又是一种植物生长调节剂,已被广泛用作农业除草剂。将两种具有生物活性的物质键联,期望得到的化合物能发挥两者的独特性能或协同效应。本文合成了水溶性良好的对氯苯氧乙酰改性壳聚糖(CPOAC),研究了它对六种细菌生长的影响,并考察了对氯苯氧乙酰改性壳聚糖对枯草芽孢杆菌细胞膜蛋白及其质粒DNA的影响,旨在探求一种水溶性和抑菌性能良好的抑菌剂。
1 材料与方法
1.1 材料和仪器
壳聚糖 分子量50000,DD95%,浙江玉环壳聚糖有限公司。
UV-2450紫外光谱仪 日本岛津;Spectrum One傅立叶红外光谱仪 Perkin Elmer。
1.2 实验方法
1.2.1 制备和表征 在 100mL烧瓶中依次加入0.01mol对氯苯氧乙酸、10.0mL甲苯和10.0mL新蒸的二氯亚砜,加热搅拌回流1.5h,除去过量的二氯亚砜,得淡黄色透明清液为中间体对氯苯氧乙酰。向其中缓慢滴入含1.0g CTS的1%醋酸溶液25mL,控制在30min内滴加完,在0~15℃内继续搅拌5h后,加入30g碎冰以终止反应。酸混合液透析1d,除去多余的酸,而后用碳酸氢钠调节pH至7.0,最后,将混合物再次透析3d,冷冻干燥,得到对氯苯氧乙酰改性壳聚糖。
采用KBr压片,对CTS及CPOAC进行红外光谱测试;CTS溶解于1.0%(v/v)的HAc,CPOAC溶解于二次蒸馏水,测定紫外光谱;设定激发和发射狭缝宽度均为5nm,λex=320nm,测定荧光光谱。
1.2.2 CPOAC对微生物生长的影响 将活化后的受试菌种用接种环挑取置于生理盐水中,制成OD610nm= 0.7的菌悬液备用。1mL的菌悬液接入含有4mL CTS或CPOAC的15mL液体培养基中,使CTS或CPOAC(溶于1.0%HAc)最终浓度为1mg/mL;以4mL 1.0% HAc溶液为空白对照,37℃下摇床振荡培养24h,测定不同时间内的OD610nm值。光密度越小,抑菌性能越强。
1.2.3 对细胞膜蛋白的影响 收获枯草芽孢杆菌,用生理盐水洗涤三次并重新悬浮,使菌悬液在610nm的吸收值为0.5。吸取1.0mL菌悬液和3.0mL CTS或CPOAC溶液混合,37℃下培养24h后,在300~450nm范围内扫描荧光光谱。设定激发和发射狭缝宽度均为3nm,λex=280nm。
1.2.4 对质粒DNA的影响 于10mL比色管中,分别加入4.0mL的Na2HPO4/NaH2PO4缓冲液、2×10-5mol/L枯草芽孢杆菌质粒 DNA溶液(A260/A280= 1.87)2.0mL和2.0mL 5mg/mL的CTS或CPOAC溶液,以二次蒸馏水定容,混合均匀后测定紫外吸收光谱。
2 结果与讨论
2.1 CTS及CPOAC的表征
2.1.1 红外光谱 CTS及CPOAC的红外光谱如图1所示。CTS原位于3446cm-1左右的-OH与-NH的伸缩振动吸收缔合峰,改性后峰形变窄;1664.51cm-1处较强的酰胺吸收峰,改性后位移至1640.98cm-1处,并且在1774.27cm-1处也有一吸收峰,归属为酸酐中-C=O的伸缩振动吸收峰,证明产物中既有酰胺,也有酸酐;1600.13cm-1左右的吸收峰为CTS中-NH2面内弯曲振动,改性后移动到 1616.94cm-1;位于1152.84cm-1处仲羟基的C-O伸缩振动吸收峰,发生改性后移动到1156.58cm-1,位于1084.18cm-1处的伯羟基的C-O伸缩振动吸收峰消失。说明CTS中的-OH与-NH2都参与了反应。另外,CPOAC在1492.64cm-1有一弱吸收峰,归属为芳环C-C骨架的伸缩振动,879.95cm-1的弱吸收峰归属为苯环中= C-H的弯曲振动吸收峰。

图1 CTS及CPOAC红外光谱
2.1.2 紫外光谱 壳聚糖的醋酸溶液在200nm处有紫外吸收,将对氯苯氧乙酰接枝到壳聚糖分子上形成酰胺或酸酐键后,由于酰胺、碳氧双键、苯环等生色团的影响,对氯苯氧乙酰改性壳聚糖紫外吸收与壳聚糖本身相比,200nm的峰发生明显的蓝移,并在250nm左右有微弱吸收。
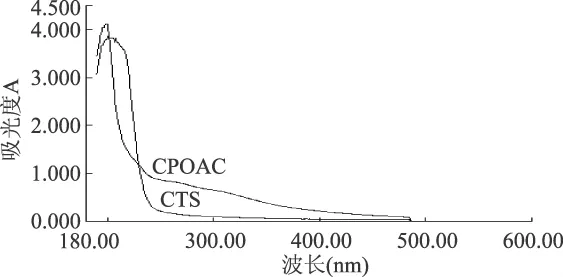
图2 CTS和CPOAC的紫外光谱
2.1.3 荧光光谱 CTS自身荧光强度很弱,在激发光源的作用下,在362nm和640nm产生两个发射峰,其荧光强度分别为152和205。对氯苯氧乙酰接枝到CTS分子上后,在421nm和642nm产生两个发射峰,荧光强度分别为798和381,较CTS大大增强。是由于CPOAC中引入了酰胺、碳氧双键、苯环,增大了分子内的电荷密度,降低了分子内电荷转移态的能量,发光量子产率增大,则会使荧光强度增强。

图3 CTS和CPOAC的荧光光谱
2.2 CTS及CPOAC的抑菌性能
CTS及CPOAC的抑菌活性如图4所示。CTS作用阴沟肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、粪肠杆菌、肺炎克罗伯杆菌和大肠杆菌一定时间后,对应的光密度值均小于对照组,表明CTS具有较好的抑菌性能,且随着时间的延长这种趋势比较稳定。与CTS相比,对氯苯氧乙酰改性壳聚糖对阴沟肠杆菌和枯草芽孢杆菌的抑菌性能比壳聚糖本身增强;对粪肠杆菌和肺炎克罗伯杆菌的抑制作用,起初抑制效果较好,但随着作用时间的延长,失去了抑菌能力;对金黄色葡萄球菌作用24h后,才有微弱的抑菌活性;而对大肠杆菌几乎没有抑制作用。

图4 CTS和CPOAC抑菌作用
2.3 CTS及CPOAC对细胞膜蛋白的影响
蛋白质分子中因含有色氨酸、酪氨酸和苯丙氨酸等氨基酸残基而产生内源性荧光。在大多数情况下,可以认为蛋白质所显示的荧光主要来自色氨酸残基的贡献,而且含色氨酸残基的蛋白质的天然荧光及其变化直接反映了蛋白质中色氨酸残基本身及其周围环境的变化。向枯草芽孢杆菌菌悬液中加入壳聚糖或CPOAC溶液,结果如图5所示:在激发波长为280nm时,菌悬液的最大发射波长在339nm;而壳聚糖在λem=339nm无荧光产生。随着壳聚糖加入,菌悬液内源荧光强度降低,荧光的最大发射波长蓝移,表明色氨酸疏水性增强[4];加入CPOAC后,菌悬液内源荧光强度也降低,且较加入CTS后荧光强度降低的更多,发射峰位的位置和峰形变化不大,这说明CTS和CPOAC对枯草芽孢杆菌细胞膜蛋白的荧光都具有猝灭作用,且CPOAC的荧光猝灭作用更强,进而改变了细胞膜蛋白的结构,这与抑菌实验结论相一致。

图5 CTS和CPOAC对膜蛋白荧光的影响
2.4 CTS及CPOAC对质粒DNA的影响
由于核酸分子本身有光吸收活性,许多外来分子与核酸结合后,对核酸或外来分子的吸收都有影响。含有碱基生色团双螺旋结构的DNA分子,其UV-vis吸收光谱在260nm附近有一强的吸收峰,某些小分子亦有吸收谱带,可根据相互作用前后DNA或其他分子的吸收谱带的变化对二者相互作用模式进行判断。对DNA的吸收光谱来说,如果导致分子的轴向变化即其构象变化,则产生减色效应及红移现象,且作用越强,减色效应越明显;如果导致DNA双螺旋结构的破坏,则产生增色效应[5]。
DNA在 260nm处有一强吸收峰,而 CTS和CPOAC在260nm附近没有紫外吸收。随着DNA溶液中加入相同浓度的CTS或CPOAC,其吸收光谱发生了明显的增色效应,并且加入CPOAC后紫外吸收峰强度强于加入壳聚糖,如图6所示,表明CTS和CPOAC均与DNA之间发生相互作用而形成了新的复合物,导致DNA双螺旋结构破坏,且CPOAC的破坏作用比CTS更强,这与抑菌实验和荧光实验结论相一致。

图6 加入CTS或CPOAC后DNA溶液的紫外光谱
3 结论
3.1 对氯苯氧乙酰改性壳聚糖对阴沟肠杆菌和枯草芽孢杆菌的抑菌性能比壳聚糖本身增强;对粪肠杆菌和肺炎克罗伯杆菌的抑制作用,起初抑制效果较好,但随着作用时间的延长,失去了抑菌能力;对金黄色葡萄球菌作用24h后,才有微弱的抑菌活性;而对大肠杆菌几乎没有抑制作用。
3.2 对氯苯氧乙酰改性壳聚糖对肺炎克罗伯杆菌的抑菌作用是通过猝灭细胞膜蛋白,改变了膜蛋白的结构,并且破坏DNA的双螺旋结构而引起的。
[1]Xiao-fang Li,Xiao-qiang Feng,Sheng Yang,et al.Effects of Molecular Weight and Concentration of Chitosan on Antifungal Activity Against Aspergillus Niger[J].Iranian Polymer Journal,2008,17(11):843-852.
[2]Chung YC,Chen CY.Antibacterial characteristic chitosan and activity of acid-soluble chitosan[J].Bioresource Technology,2008,99:2806-2814.
[3]Chun-Ho Kim,So-Yeou Kim,Kyu-Suk Choi.Synthesis and Antibacterial Activity of Water-soluble Chitin Derivatives[J]. Polymers of Advanced Technologies,1997(8):319-325.
[4]Hu Y J,Liu Y,Zhao R M,et al.Interaction of colchicine with human serum albumin investigated by spectroscopic methods[J]. Int J Biol Macromol,2005,37:122.
[5]杜江燕,黄晓华,徐飞,等.硫堇与DNA分子作用机理的光谱研究[J].光谱学与光谱分析,2005,25(9):1435.
Synthesis,antibacterial activity and mechanism of para chlorinepenoxyacetyl chitosan
LI Xiao-fang1,FENG Xiao-qiang1,FU Guo-qing2,YANG Sheng1,*,WANG Ting-pu1,SU Zhong-xing3
(1.College of Life Science and Chemistry,Tianshui Normal University,Tianshui 741001,China;2.Traditional Medical Hospital of Tianshui,Tianshui 741001,China;3.College of Chemistry and Chemical Engineering,Lanzhou University,Lanzhou 730000,China)
Para Chlorinepenoxyacetyl chitosan(CPOAC)was prepared and characterized by lR,UV spectra and fluorescence spectra.Antibacterial activity of CPOAC was evaluated against six species of bacteria in vitro. Moreover,the effect of CPOAC on cell membrane protein and plasmid DNA were investigated to illustrate the antibacterial mechanism.The results showed that the antibacterial activity of CPOAC against E.cloacae,B.subtilis was better than chitosan.The antibacterial activity was better than chitosan at first against E.faecalis and S.pneumoniae,but lost the antibacterial activity with the prolong of time.There was low antibacterial activity against S.aureus for 24h later,while CPOAC showed no antibacterial activity against E.coli.The antibacterial activity of CPOAC against B.subtilis was resulted by quenching the fluorescence intensity of cell membrane protein,altering the structure of cell membrane protein and damaging the two-helical structure of plasmid DNA.
para chlorinepenoxyacetyl chitosan;antibacterial activity;mechanism
TS201.1
A
1002-0306(2011)02-0133-03
2010-02-26 *通讯联系人
李小芳(1983-),女,硕士研究生,研究方向:天然高分子。
甘肃天水师范学院物理无机化学重点学科基金。

