喷雾干燥对发酵乳杆菌KLDS1.0709存活影响的研究
郭 云,孟祥晨
(东北农业大学乳品科学教育部重点实验室/食品学院,黑龙江哈尔滨150030)
喷雾干燥对发酵乳杆菌KLDS1.0709存活影响的研究
郭 云,孟祥晨*
(东北农业大学乳品科学教育部重点实验室/食品学院,黑龙江哈尔滨150030)
研究喷雾干燥对高抗氧化活性发酵乳杆菌KLDS1.0709存活的影响。以脱脂乳为菌体悬浮基质,研究不同出风温度对该菌喷雾干燥后菌体存活率的影响,然后在脱脂乳中添加不同比例的海藻糖和蔗糖,比较不同基质对菌体存活率的影响。结果表明,随出风温度的升高,菌体存活率和水分含量均降低;当出风温度为75℃时,菌体存活率为62.98%,残留水分含量为5.80%。以10%脱脂乳+5%海藻糖+5%蔗糖为基质进行喷雾干燥,菌体存活率最高达73.90%,表明海藻糖和蔗糖与脱脂乳混合作为基质时可提高该菌喷雾干燥后的存活率。
喷雾干燥,脱脂乳,发酵乳杆菌,海藻糖,蔗糖
乳酸杆菌是人类有益肠道菌群的重要组成菌种之一,具有许多重要的生理功能[1],抗氧化活性是其重要的生理功能之一,具有抗氧化活性的乳杆菌能够在摄取食物的过程中降低活性氧聚积,减少超氧负离子和过氧化氢的含量[2]。Kullisaar等人报道了从健康的婴儿肠道中分离出两株具有抗氧化活性的发酵乳杆菌E-3和E-18,它们含有大量的谷胱甘肽和过氧化物歧化酶(SOD),能够抑制脂质过氧化物反应,减少过氧化氢含量,维护肠道生态系统并抑制内源性和外源性的氧化应激反应[3]。本研究前期从50株益生菌中已筛选出一株具有抗氧化活性的发酵乳杆菌KLDS1.0709,将这株具有抗氧化活性的益生菌制备成菌粉,目前常用的两种方法是冷冻干燥和喷雾干燥[4]。在食品工业中,与冷冻干燥相比,喷雾干燥具有设备简单、成本低等优点,适合益生菌大规模生产、运输和储存,是商业化制备益生菌产品普遍采用的方法。许多研究报道了喷雾干燥技术在制备益生菌产品中的应用[5]。然而在喷雾干燥过程中,益生菌与高温空气充分接触,尽管时间短,但热力作用还是会导致菌体死亡,制备的干燥菌粉活菌数较低。因此,采用喷雾干燥制备益生菌粉时需考虑菌体的存活率问题。本研究的主要目的是通过优化喷雾干燥参数和使用不同菌体悬浮基质来减少喷雾干燥对发酵乳杆菌存活率的影响,为该菌的商业化应用奠定基础。
1 材料与方法
1.1 材料与仪器
发酵乳杆菌(Lactobacillus fermentum)KLDS1.0709乳品科学教育部重点实验室保藏;优化后的玉米浆液体培养基 玉米浆粉100g,葡萄糖40g,吐温-80 2g,K2HPO46g,柠檬酸钠6g,MgSO40.6g,MnSO40.6g,蒸馏水2L,调pH到6.0,121℃灭菌15min;MRS培养基;脱脂乳 蛋白质含量为35%,新西兰;海藻糖纯度≥99%,上海倍翔;蔗糖 食品级,天津光复科技;其它试剂 均为分析纯。
Delta320 pH计 瑞士梅特勒-托利多集团;HVE-50高温高压灭菌锅 日本平山公司;DHP-9272电热恒温培养箱 上海一恒科技有限公司;VD-1320洁净工作台 北京东联哈尔滨仪器制造有限公司;GL-21高速冷冻离心机 上海市离心机械研究所;瑞士比欧KLF2000型发酵罐 瑞士比欧生物工程公司;XK96-A快速混匀振荡器 姜堰市新康医疗器械有限公司;B-290喷雾干燥仪 瑞士Buchi(布奇)公司;S-3400N扫描电子显微镜 日本Hitachi公司。
1.2 实验方法
1.2.1 菌种的活化及发酵培养 将发酵乳杆菌KLDS1.0709接种于MRS液体培养基中,于恒温箱中35℃培养12h,连续活化三代,以提高菌株活力。
配制玉米浆液体培养基,然后将其倒入3.7L发酵罐,121℃灭菌15min,当温度降至30℃时,以1%接种量接种发酵乳杆菌KLDS1.0709培养液,在35℃恒 pH6.0条件下发酵培养 12h,搅拌速度为100r/min。
1.2.2 菌悬液的制备 发酵结束放罐后,将发酵液在4℃、6000×g离心10min后,倾倒上清液,获得的菌体细胞再用PBS缓冲溶液清洗两次,将最后获得的菌体细胞通过混匀振荡器悬浮在相应的基质中。
1.2.3 基质的制备 按照表1制备相应的菌体悬浮基质。

表1 喷雾干燥基质的配比
1.2.4 喷雾干燥 参考Ananta E(2005)的方法进行喷雾干燥,进料速度恒定为5mL/min,通过调节进风温度使出风温度在70~90℃之间[6],干粉样品从旋风分离器下收集。
1.2.5 活菌计数 采用平板菌落计数法[7]。
1.2.6 存活率测定 发酵乳杆菌存活率(%)=(喷雾干燥后发酵乳杆菌的活菌数/喷雾干燥前发酵乳杆菌的活菌数)×100%
1.2.7 水分含量测定 采用烘干方法测定产品的水分含量,将装有3g样品的铝盒放入(102±2℃)的烘箱中加热,直至恒量,重复上述操作,直到两次连续称量质量之差不超过0.0005g(GB/T 5413.8-1997)。

式中,m1:加入样品后铝盒和盖的最初质量,g;m2:样品烘干后两次称量获得的最小质量,g;m3:样品的质量,g。
1.2.8 产品微观结构的观测 制备后的菌粉样品采用扫描电子显微镜的方法观察其微观结构特征。具体操作步骤如下:a.粘样:将少许样品均匀地粘贴在扫描电镜样品台上;b.镀膜:用W-1010(Giko)型离子溅射镀膜仪在样品表面上镀上一层1500nm厚的金属膜(金或铂膜);c.将处理好的样品放入样品盒中待检;d.开机,采用加速电压20kV测量样品。
2 结果与讨论
2.1 不同出风温度对喷雾干燥后菌体存活的影响
以20%脱脂乳为基质进行喷雾干燥,不同的出风温度对喷雾干燥后发酵乳杆菌KLDS 1.0709存活率的影响见图1。
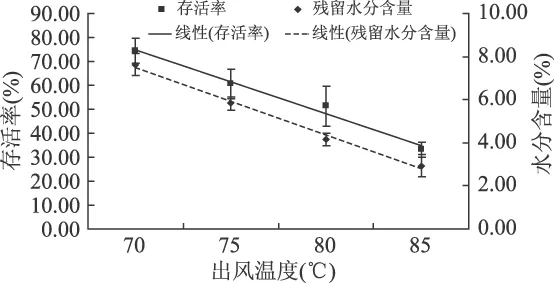
图1 不同出风温度对发酵乳杆菌KLDS1.0709喷雾干燥后存活率及残留水分含量的影响
从图1中可以看出:随出风温度的升高,菌体的存活率呈线性下降,当出风温度从70℃升高到85℃时,菌体存活率从74.37%急剧降低到33.18%。菌粉的水分含量也随出风温度的升高而从7.63%降至2.94%。从食品储藏玻璃化温度的角度考虑,25℃适宜乳粉储藏的残留水分含量的临界值为7%[8]。产品干燥后残留水分含量低于7%能减少储藏过程中产生的不良影响,例如乳糖结晶等。而且根据实际情况,应该选择高存活率和低水分含量的参数,因此综合考虑上述因素,确定适合发酵乳杆菌KLDS1.0709喷雾干燥的出风温度为75℃,此时的菌体存活率为62.98%,残留水分含量为5.80%。
Gardiner G E等研究了喷雾干燥对副干酪乳杆菌NFBC338和唾液乳杆菌UCC118的存活率的影响[9],同样以脱脂乳为基质,不同出风温度的实验显示,出风温度在75℃最佳,该温度下获得菌粉的残留水分含量为5%左右,NFBC338和UCC118的存活率分别为66%和1%。本研究采用的发酵乳杆菌KLDS1.0709在最适出风温度75℃时菌体存活率为60%左右,与副干酪乳杆菌接近。
2.2 不同基质对喷雾干燥后菌体存活的影响
将蔗糖和/或海藻糖添加至脱脂乳中,作为菌体悬浮基质在出风温度为75℃的条件下进行喷雾干燥,结果如图2所示。
从图中可以看出,以20%脱脂乳为基质时菌体的存活率可达60.22%,当以10%脱脂乳与10%蔗糖混合为基质时,菌体存活率提高5.68%,当以10%脱脂乳与10%海藻糖混合为基质时,菌体存活率提高8.52%,当海藻糖和蔗糖分别以5%混合添加至10%脱脂乳中时,菌体的存活率达最高,为73.90%,比20%脱脂乳为基质时的存活率提高13.68%。
从上述结果可以看出,海藻糖和蔗糖在喷雾干燥脱水的过程中对菌体具有一定的保护作用,与Zaye等人研究利用海藻糖和蔗糖作为唾液乳杆菌唾液亚种(UCC500)冻干保护基质的结果相似,在脱脂1-20%脱脂乳;2-10%脱脂乳+10%海藻糖;3-10%脱脂乳+10%蔗糖;4-10%脱脂乳+5%海藻糖+5%蔗糖乳中添加海藻糖或蔗糖比不添加的菌体冻干存活率要高,而且当海藻糖和蔗糖两者混合添加到脱脂乳中比两者单独分别添加到脱脂乳中保护效果要好[10]。
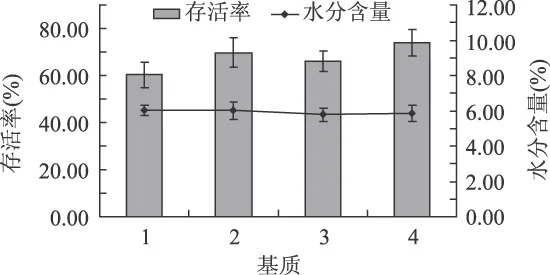
图2 不同喷雾干燥基质对发酵乳杆菌KLDS1.0709存活率及水分含量的影响
研究表明,糖类物质由于具有替代水分子以及形成玻璃态的能力,在冻结和干燥过程中对细胞膜有很好的保护作用,同时对蛋白质、脂质体、原核细胞等生物系统的冷冻干燥和喷雾干燥有抑制损伤的作用,Leslie SB等人发现,海藻糖和蔗糖在冷冻干燥过程中对大肠杆菌和苏云芽孢杆菌起到了很好的保护作用,主要是由于海藻糖和蔗糖在干燥阶段能够保护细胞膜维持蛋白质结构的稳定[11]。
2.3 喷雾干燥菌粉的表征
不同悬浮基质喷雾干燥后形成菌粉的扫描电镜观察如图3所示,干燥后的微粒都大体呈球形,与Charpenntier[12]的观察相似,以脱脂乳为主要基质的微球表面有裂缝出现,这些裂缝有利于干燥后颗粒内部热量的排出,减少热对内部菌体的伤害。

图3 四种基质喷雾干燥菌粉的微观结构(放大3000倍)
从图中可以看出,5%海藻糖+5%蔗糖+10%脱脂乳悬浮基质喷雾干燥后形成的微粒比其他三种基质的微粒形态更圆润,而10%蔗糖+10%脱脂乳为基质的微粒和20%脱脂乳为基质的微粒表面有明显干燥脱水后行成的凹坑。
3 结论
综合考虑喷雾干燥菌体存活率和残留水分含量,选择最佳的喷雾干燥出风温度为75℃,此时的菌体存活率为62.98%,残留水分含量为5.80%。
当海藻糖和蔗糖与脱脂乳混合为喷雾干燥基质时可提高菌体的存活率,其中10%脱脂乳+5%海藻糖+5%蔗糖为喷雾干燥基质时,菌体的存活率最高,达73.90%。
由扫描电镜可知菌粉微粒大体呈球型,微球表面有裂缝并且凸凹不平,粒径分布不均匀,大体在30~500μm之间。
[1]Fuller R.Probiotics in human medicine[J].Gut,1991(32):439-451.
[2]Kaizu M M,Sasaki M,Nakajima H,et al.Effect of antioxidative lactic acid bacteria on rats fed a diet deficient in vitamin E[J].Journal of Dairy Science,1993(76):2493-2499.
[3]Kullisaar T,Zilmer M,Mikelsaar M,et al.Two antioxidative lactobacilli strains as promising probiotics[J].International Journal of Food Microbiology,2002(72):215-224.
[4]Meng X C,Stanton C,Fitzgerald G F,et al.Anhydrobiotics:The challenges of drying probiotic cultures[J].Food Chemistry,2008,106:1406-1416.
[5]曲微,范俊华,霍贵成.益生菌喷雾干燥技术的研究进展[J].中国乳业,2008(4):36-38.
[6]Ananta E,Volkert M,Knorr D.Cellular injuries and storage stability of spray-dried Lactobacillusrhamnosus GG[J]. International Dairy Journal,2005(15):399-409.
[7]沈萍,范秀容,李广武,等.微生物学实验[M].第三版.北京:高等教育出版社,2005:92-95.
[8]Collins G F,Ross J K,R P,et al.Comparative survival rates of human-derived probiotic Lactoba-cillus paracasei and L. salivarius strains during heat treatment and spray drying[J]. Applied Environmental and Microbiology,2000(66):2605-2612.
[9]Gardiner G E,O′Sullivan E,Kelly J,et al.Comparative survival rates of human derived probiotic Lactobacillus paracasei and L.salivarius strains during heat treatment and spray drying[J].Applied and Environmental Microbiology,2000(6):2605 -2612.
[10]Zayed G,Roos Y H.Influence of trehalose and moisture content on survival of Lactobacillus salivarius subjected to freezedrying and storage[J].Process Biochemistry,2004(39):1081 -1088.
[11]Leslie SB,Israeli E,Lighthart B,et al.Trehalose and sucrose protect both membrane and proteins in intact bacteria during drying[J].Applied Environmental and Microbiology,1995,61:3592-3597.
[12] Charpentier C A,Gadille P,Digat B,et al. Microencapsulation of rhizobacteria by spray drying:formulation and survival studies[J].Journal of Microencapsulation,1998,15:639-659.
Survival of Lactobacillus fermentum KLDS1.0709 after spray-drying
GUO Yun,MENG Xiang-chen*
(Key Laboratory of Dairy Science,Ministry of Education,Food Scienceamp;Technology College,Northeast Agricultural University,Harbin 150030,China)
Lactobacillus fermentum KLDS1.0709 was first spray-dried with skim milk at different outlet temperatrure to investigate the microbial survival rate.Furthermore,trehalose or/and sucrose was/were included in the skim milk to assess their protection capacity.The results indicated that the survival rate and the residual moisture content decreased with increasing outlet temperatures.A microbial survival rate of 62.98%and a residual moisture content of 5.80%were achieved at an outlet temperature of 75℃.5%trehalose+5%sucrose in addition to skim milk were the most efficient materials giving a survival rate of 73.90%after spray-dring.Trehalose and sucrose greatly enhanced survival rate when they were used together with skim milk.
spray-drying;skim milk;Lactobacillus fermentum;trehalose;sucrose
TS201.1
A
1002-0306(2011)02-0109-03
2010-01-20 *通讯联系人
郭云(1983-),女,硕士,研究方向:食品微生物。
国家863项目(2008AA10Z335)资助。

