分子印迹聚合物及其在药物分离中的应用研究进展
贺倩倩,张高奎,贺利民
(华南农业大学兽医学院兽医药理研究室,广州 510642)
采用生物技术制备的免疫亲和萃取(immuno-affinity extraction,IAE)柱和分子印迹技术(molecular imprinting technique,MIT)制备的分子印迹固相萃取(molecularly imprinted solid-phase extraction,MISPE)柱均具有高度的选择性和特异识别能力,是复杂生物样品净化,特别是药物残留分离、净化和富集的理想选择[1-2]。IAE技术是基于抗体-抗原(主体-客体)特异性作用原理,用于单一化合物或化合物族的选择性萃取和富集,Delaunay等[3]对IAE在复杂样品痕量组分分析和药物残留检测的富集、净化处理中的应用进行了很好总结。尽管IAE技术有高选择性和强特异性识别能力,但抗体制备时间长,费用高,又因抗体是哺乳动物对外来物应答产生的一种蛋白质——受检测体系酸碱性、离子强度、温度及有机溶剂等严重影响[4],近20年来迅速发展的 MISPE技术可以有效解决IAE技术应用中的这些不足。以分子印迹聚合物(molecularly imprinted polymers,MIP)为吸附剂的MISPE柱,不仅具有与IAE柱相似的专一识别能力和高选择性;同时,因其为高分子合成材料,而且具有耐各种恶劣应用环境的能力,克服了IAE柱的缺点(表1)。MIP俗称“塑料抗体”,MISPE技术是化学改造的IAE技术,具有广阔的应用前景。

表1 分子印迹聚合物与生物抗体优缺点
1 分子印迹技术的起源
分子印迹技术是合成对特定分子具有专一识别性能的聚合物技术。一直以来,普遍认为MIT的出现主要是受人们对抗原-抗体、酶-底物、受体-配体等生物大分子专一识别的启发而产生的,但MIT的起源是受生物大分子的专一识别和无机聚合物(硅胶)的选择性吸附的共同启发,更符合实际发展。生物大分子专一识别(抗体-抗原结合)机制的认识经历了“肯定-否定 -再肯定 -再否定……”的不断发展过程。从最初的“侧链学说”机制到20世纪30年代初被Breinl等提出的“模板学说”否定[5],随后 Mudd[6]、Pauling[7]和 Burnet[8]等又对这一学说相继进行了补充和完善,而到20世纪50年代中叶的“细胞选择学说”和后期的“克隆选择学说”又彻底否定了主宰免疫学分子识别机制20多年的“模板学说”。
但“模板学说”提出以抗原为模板来合成抗体的设想,并试图用锁-钥理论来解释免疫体系,大大启发了广大科研工作者。另一方面,当免疫“模板学说”尚在争论中的时候,1931年,前苏联化学家Polyakov[9]在无机大分子(硅胶)对小分子选择性识别方面已做了重要工作,他用各种有机溶剂添加剂(模板分子)与硅胶混合,发现硅胶干燥后再吸附该溶剂的能力与该有机溶剂的化学特性和结构非常相关,这可以说是现代分子印迹技术的雏型。1949年,“模板学说”完善者 Pauling 的学生Dickey[10]将甲基橙等染料和水玻璃(硅酸钠)混合,用冰乙酸处理制备硅凝胶,进一步老化、洗涤、干燥后得到固体颗粒硅胶,用甲醇洗去硅胶中的染料分子,再评价该硅胶对甲基橙等染料的吸附能力。实验结果表明,制备硅胶的吸附具有特异性,对不同染料(模板)的吸附能力有显著差异,被认为是首先提出“分子印迹”概念的人,但由于受到当时人们认识水平限制,对这一概念并没有引起足够的重视。直到1972 年,Wulff团队[11]和 Klotz研究小组[12]各自独立制备了具有专一识别能力的共价型有机分子印迹聚合物——甲基橙-MIP和D-甘油酸-MIP以后,MIT才逐渐被人们所接受,每年发表的论文数量也逐渐增多。20世纪80年代后非共价型模板印迹聚合物的出现[13],尤其是1993年Mosbach研究小组在Nature上发表具有开拓性的关于制备非共价型茶碱-MIP的报道,使MIT的研究得到迅猛发展,每年发表的相关论文数量呈指数增加[14]。MIT之所以受到研究者如此关注,主要是因为它对模板分子的识别具有构效预定性、特异识别性和广泛的实用性,使之在固相萃取[15-19]、色谱对映体分离[20-21]、人工抗体模拟[22]、生物化学传感器[23]和选择性催化剂[24]等方面得到广泛应用。
2 分子印迹技术的概念、原理和特征
分子印迹技术是指为获得在空间结构和结合位点上与某一分子(模板分子)完全匹配的聚合物的制备技术。目前,分子印迹过程的详细机理还不明确,尚有待系统的深入研究。从本质上来说,MIP对分子的识别源于它与模板(印迹)分子之间在化学基团以及三维空间结构上的相互匹配,即MIP的选择性与印迹分子和功能单体之间相互作用力的性质、数量与强度以及印迹分子的结构有关。Nicholls等[25]认为,MIP复合物的形成过程以及MIP与印迹分子之间识别过程均受热力学定律制约,功能单体和模板分子之间形成复合物的自由能变化可通过下式计算:
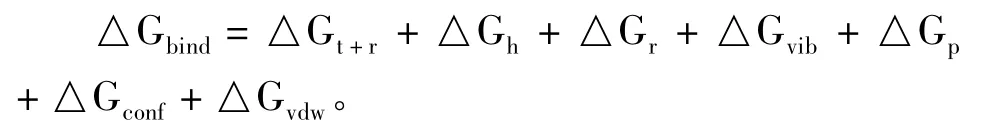
在上面方程式中△Gbind是形成复合物时Gibbs自由能的改变;△Gt+r是分子位移自由转动时损失的自由能;△Gr是分子内旋被“冻结”时损失的自由能;△Gh是疏水性相互作用获得的自由能;△Gvib是基团振动方式自由能;△Gp是偶极基团相互作用总的自由能的贡献;△Gconf是由构型变化引起的自由能改变;△Gvdw是由非范德华力相互作用损失的自由能。根据上式可以分析影响MIP形成和识别过程的诸因素,并进而改善MIP的设计与制备,但分子印迹过程非常复杂,现在还很难定量估计某一因素对结合能的贡献。尽管如此,实际中大量的MIP的制备都可以通过以下方法实现:(1)首先将具有适当功能基的功能单体与模板分子混合,形成单体-模板分子复合物;(2)选择适当的交联剂将功能单体互相交联起来形成网状聚合物,从而使功能单体上的功能基在空间排列和空间定向上固定下来;(3)通过一定的方法把模板分子脱去。结果在聚合物中留下一个与模板分子在空间结构上完全匹配,并含有与模板分子专一结合的功能基的三维空穴(图1)。此三维聚合物空穴可以选择性地重新与模板分子结合,即对模板分子具有专一性识别作用。

图1 分子印迹原理示意图(摘自文献[26])
这个三维空穴的空间结构由功能单体的种类、模板分子的结构和性质所决定。由于用不同的模板分子制备的MIP具有不同的结构和性质,所以一种MIP只能与一种分子结合,也就是说MIP对该分子具有选择性结合作用。由此可见,MIP具有的特点有预定性,即它可以根据不同的目的制备不同的MIP,以满足各种不同的需要;识别性,即MIP是按照模板分子“量身定做”的,可专一地识别印迹分子;实用性,即它可以与天然的生物分子识别系统如酶与底物、抗原与抗体、受体与激素相比拟。但由于它是由化学合成方法制备的,因此又有天然分子识别系统所不具备的抗恶劣环境(高温、高压、强酸、强碱和有机溶剂等)的能力,从而表现出高度的稳定性和长的使用寿命。
3 分子印迹聚合物制备方式和方法
3.1 分子印迹聚合物制备方式 根据印迹分子与功能单体间作用力的性质,通常将MIP分为共价结合型(预组装型)、非共价结合型(自组装型)两类。共价结合型MIP最早由Wulff[27]提出,聚合前印迹分子与功能单体反应,形成硼酸酯、席夫碱、亚胺、缩醛等衍生物,再通过交联剂聚合产生高分子聚合物,用水解等方法除去印迹分子即得到共价结合型MIP。目前已获得针对一些糖类及其衍生物、氨基酸及其衍生物、扁桃酸、芳香酮、二醛类、铁转移蛋白、辅酶和甾类等化合物的MIP。共价结合型MIP的限制较大,并且共价作用较强,结合与解离速度缓慢,难以达到热力学平衡,操作复杂。制备共价结合型MIP供选择的功能单体较少,主要有4-乙烯苯硼酸、4-乙烯苯甲醛、4-乙烯苯胺、4-乙烯苯酚等,其中硼酸基团与邻二醇基团形成的酯键效果较好,易于形成或断裂,在糖类及其衍生物MIP的制备中有重要价值[28-29]。
Mosbach研究小组[14]首次制备了非共价结合型MIP。聚合前印迹分子通过分子间作用力(如氢键、偶极、静电、电荷转移、金属配位、疏水作用等),与功能单体形成超分子复合物,再进一步聚合交联和除去印迹分子,得到非共价结合型MIP。可供制备非共价型MIP的功能单体较多,以甲基丙烯酸(MAA)为代表的羧酸类单体最常用。MAA分子中的羧基能与许多官能团发生较强的分子间作用,如与羟基、醚、羧基、酰胺、脲等形成氢键以及与氨基发生离子交换作用。其他较常用的单体主要有酸性的丙磺酸类、碱性的含氮杂环类(如乙烯基吡啶、乙烯基咪唑等)及中性的丙烯酰胺和羟乙基甲基丙烯酸酯等。实际中也可以将不同类型的功能单体混合使用,也取得了很好的效果[13,30-33]。
3.2 分子印迹聚合物制备方法 MIP最初的制备方法属于本体聚合法(bulk polymerization)。该法制备的MIP对模板底物(印迹分子)具有良好的选择和识别特性,而且合成操作条件易于控制,实验装置简单,便于普及,迄今为止仍为MIP制备的主要方法。其中封管聚合是一种最为常用的方法,将印迹分子、功能单体、交联剂按一定比例(通常摩尔比是1∶4∶20)溶解在溶剂(致孔剂)中,并加入适量的引发剂,移入反应管中,采用超声波脱气、通氮气除氧,在真空下封管经热引发或紫外光照射引发,聚合得到块状聚合物。聚合物再经粉碎、磨细、筛选等过程获得合适大小的粒子,洗脱除去模板分子,干燥后备用,一般最终得到合格粒径范围的聚合物的产率较低。这种方法聚合过程简单,但后续工作繁琐,研筛过程中产品有所损失,所得的颗粒形状不规则,分散性较差,用作色谱固定相时其载流量和柱效率都不是很理想,在其他应用方面也不便于使用。
Matsui等[34]首先将原位聚合法(in situ polymerization)引入MIP的制备中,在色谱柱内直接合成MIP固定相,避免了封管聚合中研磨、过筛和沉降等环节,实验过程大大简化,方法具有直接、简便的优点。但为了使原位聚合的色谱柱有良好的流动性,制备时必须加入合适的致孔剂。聚合反应程度的控制也非常重要,若聚合时间过长,合成的聚合物太致密,色谱柱的流动性差,表现为柱压高,流速低;聚合时间太短,合成的聚合物中选择性结合位点少,色谱柱柱效低。黄晓冬等[35]采用原位聚合法直接在毛细管柱中合成了辛可宁-印迹聚合物,采用压力辅助毛细管电色谱模式拆分了非对映异构体辛可宁和辛可尼丁抗疟药物,柱效远高于其在高效液相色谱分离中的柱效。将分子印迹聚合物制成薄膜,则是另一类原位聚合方法,Mosbach研究小组最先合成以L-苯丙酰胺为模板分子的分子印迹聚合物膜[36]。
近年来,分子印迹聚合物微球的制备成为研究的热点。球形分子印迹聚合物(spherical molecular imprinted polymer)的制备主要有三种方法:悬浮聚合(suspension polymerization)、沉淀聚合(precipitation polymerization)和多步溶胀聚合(multi-step swelling polymerization)。采用这几种方法制备的MIP球形聚合物主要用作柱色谱和毛细管色谱固定相的填充材料以及免疫分析的吸附材料。瑞典的Mosbach研究小组最早制备了微球形的MIP[37];日本的 Hosoya 等[38]、Yoshida 等[39]在这方面也做了卓有成效的工作,他们分别采用不同的方法成功制备了MIP微球,并将它们应用于分离技术之中。但MIP微球的聚合操作较复杂,微球性能对聚合条件的依赖性较大,收率低等方面都有待深入研究。
多功能单体和组合功能单体的出现突破了传统分子印迹制备技术中功能单体使用的单一性问题,使功能单体源的选择具有了多样性。Araki等[40]在表面印迹中使用双功能单体成功制备了氨基酸衍生物苯苄谷氨酸-MIP。Zheng等[41]采用丙烯酰胺和4-乙烯基吡啶组合功能单体制备出磺胺药物-MIP,作为色谱固定相使用时,无论在水相还是有机相中,均表现出比单独使用丙烯酰胺或4-乙烯基吡啶所制备的MIP更强的磺胺药物亲和识别性。
目前MIP的制备和使用大多只能在有机相中进行,而实际样品通常都富含水分,MIP的应用受到很大限制。因此,开展在水相或极性介质中制备MIP的研究具有重大实际意义。近几年出现了不少在水-醇体系合成MIP的报道[42-45],实验结果表明,在水兼容性介质中制备的MIP应用于富水试样中,目标物的选择性萃取获得理想的效果。
将MIP制成具有生物活性的纳米颗粒用于生物系统,显示了其在药理学、生物技术和制药等方面的应用前景,引起了研究者的高度兴趣。Vaihinger等[46]采用微乳液聚合合成了印迹纳米微球作为亲和受体。
4 分子印迹聚合物在分离技术中的应用
由于MIP独特的性能,近年来在化合物的分离、净化和富集中得到了广泛的应用,如在固相萃取、手性色谱、膜分离、生物传感器及高效毛细血管电泳等分离技术中。
4.1 在固相萃取中的应用 MIP具有从复杂样品中高选择性地吸附模板分子或与其结构相近的某一族化合物的能力,克服了传统SPE技术常常发生的共萃取现象,因此它非常适合用作固相萃取吸附剂来分离、富集复杂试样中痕量的分析物,达到分离、纯化的目的,从而降低检测限,提高分析的精密度和准确性。Sellergren[15]首次报道了将MIP用于固相萃取,他以Pentanamidie(PAM)为模板制备PAM-印迹聚合物,进行固相萃取,取得了很好的效果。随着对MIP研究的深入,MIP在SPE方面己经广泛应用于选择性固相萃取尿样[47-49]、血液[50-53]、水 样[42,54-55]、动 物 组 织[18,56-57]、牛奶[58-60]、饲料[61-62]等基质中的目标分析物。
4.2 在色谱分析中的应用 MIP在色谱中的应用主要是作为色谱固定相用于手性药物的分离拆分。早在1977年,Wulff等就报道了以α-D-甘露吡喃糖苷为模板制备的MIP作为HPLC固定相拆分其外消旋体,通过改变色谱操作条件,实现了外消旋体的完全拆分。目前手性药物分离的主要方法是通过手性色谱柱进行分离,而色谱中使用的手性固定相一般为带有固载化的手性基团,这些普通手性固定相虽然能将对映异构体完全分开,但难以预测其洗脱顺序。与普通手性固定相相比,MIP具有高度预定的选择性。以某一对对映体作模板分子制备的MIP,对此异构体的保留时间最长,最后被洗脱,因此以MIP作为手性固定相用于色谱拆分手性药物,不仅可以完全分离一对异构体,同时可预测手性药物的洗脱顺序,于是省去了测定洗脱物手性的过程。目前,MIP作为色谱固定相除已用于氨基酸及其衍生物、甾醇、β-阻断剂、杀虫剂和糖及其衍生物的分离研究外,还用于茶碱、辛可宁、金鸡纳等生物碱的分离研究[21,63-66]。
4.3 在膜分离中的应用 由于MIP所具有的刚性块状结构,目前它主要的用途是作为色谱固定相和固相萃取吸附剂。MIP良好的操作稳定性及识别性质不受酸、碱、热、有机溶剂等各种环境因素影响的特点,制备具有分子印迹功能的分子印迹薄膜将是功能分离材料研究领域中一个重要的发展方向[67]。但这方面的研究工作起步较晚,文献报道也不多[68]。
Kobayashi等[69]采用相转移方法,让丙烯腈-丙烯酸共聚体在含有模板分子的溶液中固化制得的MIP薄膜,对茶碱等生物碱具有很高的立体选择性。
4.4 在高效毛细管电泳中的应用 高效毛细管电泳(HPCE)具有分辨率高、分离时间短、花费低的优点。把MIP与HPCE相结合,可克服高效液相色谱MIP柱柱效过低的缺点。Schweitz等[70]采用原位聚合法制备了MIP涂层毛细管,用于高效毛细管电泳分离异构体,取得了很好的分离效果。
MIP除在以上几种分离技术中得到广泛应用外,MIP作为吸附剂、离子交换树脂的研究也引起了化学分析工作者的关注。孟子晖等[71]以沙林为模板分子,采用不同单体和交联剂制备了一系列对沙林毒气具有很强吸附能力的MIP。Castro等[72]用硫芴砜(DBTS)为模板分子合成的三种MIP,能从燃料中优先吸附DBTS,从而达到分离纯化的目的。
5 目前分子印迹技术尚存在的问题
5.1 在基础理论研究方面 分子印迹和识别的机理目前仍处于定性和半定量的水平,结合位点的作用机理、聚合物孔穴形态、形成结合位点的数量和传质机理仍有待进一步研究。
5.2 在制备方式方法方面 目前可选择和供使用的功能单体、交联剂较少,本体聚合、原位聚合法在工艺和技术上有待进一步完善和改进,新型实用聚合方法亟待研究开发,以满足不断发展的分子印迹识别要求。
5.3 在应用领域方面 分子印迹技术的应用领域有待于进一步拓宽。从目前的研究工作来看,MIT主要在小分子化合物分离、纯化、富集方面取得较大进展,已有商品化的分子印迹固相萃取小柱销售,但在蛋白质、多肽和酶等生物大分子甚至整个细胞的研究方面报道不多,效果也还不够理想。MIT在气体小分子方面的研究尚未见报道,随着MIT研究的逐渐深入和应用的日益广泛,气相中采用MIT高选择性识别目标分析物也将成为研究的重要方向之一。
6 展望
自从1972年Wulff团队和Klotz研究小组各自几乎同时报道人工合成MIP以来,在短短近40年中,MIT得到了飞速的发展。MIP凭借其优良的物理化学性能及对印迹分子的专一识别能力,在固相萃取、手性色谱分离、模拟生物抗体、仿生传感器、催化及有机合成等方面得到了广泛的应用。MIT技术目前虽然尚存在许多问题,但从技术上予以解决是可行的,如为解决“模板泄露”对低水平目标物定量检测的影响而产生了“虚拟模板”技术[73];为了克服印迹过程中印迹分子洗脱困难、印迹效率低等问题,Zimmerman等[74]创立了单分子印迹新技术。可以预言,随着合成手段、现代分析检测手段、生物技术和电子技术的迅猛发展,MIP的制备、表征和理论体系将日臻完善,其应用范围将更加广泛。许多药物小分子的MISPE柱已实现商业化,手性分离和手性药物以及仿生传感器即将步入商业化阶段,不久的将来,MIT所取得成果将广泛应用于日常生活的方方面面,发挥其重要作用。
[1]Weller M G.Immunochromatographic Techniques—a Critical Review[J].Fresenius J Anal Chem,2000,336:635-645.
[2]Hennion M C,Pichon V.Immuno-based Sample Preparation for Trace Analysis[J].J Chromatogr A,2003,1000:29-52.
[3]Delaunay N,Pichon V,Hennion M C.Immunoaffinity Solidphase Extraction for the Trace-analysis of Low-molecularmass Analytes in Complex Sample Matrices[J].J Chromatogr B,2000,745(1):15-37.
[4]Kurstak E.In Enzyme Immunodiagnosis[M].London:Academic Publishers,1986:5-11.
[5]Breinl F,Haurowitz F.Chemical Examinations on the Precipitate from Haemoglobin and Anti-haemoglobin Serum and Comments on the Nature of Antibodies[J].Z Physiol Chem,1930,192:45-57.
[6]Mudd S.A Hypothetical Mechanism of Antibody Formation[J].J Immun,1932,23:423-427.
[7]Pauling L.A Theory of the Formation of Antibodies[J].J Ameri Chem Soc,1940,62:2643-2657.
[8]Burnet F M.The Clonal Selection Theory of Acquired Immunity[M].Cambridge:Cambridge University Publishers,1959.
[9]Polyakov M.Adsorption Properties and Structure of Silica Gel[J].Zhurnal Fizicheskoi Khimii,1931,2:799-905.
[10] Dickey F H.The Preparation of Specific Adsorbents[J].Proceedings of the National Academy of Sciences(USA),1949,35(5):227-229.
[11] Wulff G,Sarhan A.On the Use of Enzyme-analogue Designed Polymers for Racemate Separations[J].Angewandte Chemieinternational Edition,1972,11:341-344.
[12] Takagishi T,Klotz I M.Macromolecule-small Molecule Interactions;Introduction of Additional Binding Sites in Polyethyleneimine by Disulfide Cross-linkages[J].Biopolymers,1972,11:483-491.
[13] Arshady R,Mosbach K.Synthesis of Substrate-selective Polymers by Host-Guest Polymerization[J].Macromol Chem Phys,1981,182:687-692.
[14] Vlatakis G,Andersson L I,Muller R,et al.Drug Assay Using Antibody Mimics Made by Molecular Imprinting[J].Nature,1993,361:645-647.
[15] Sellergren B.Direct Drug Determination by Selective Sample Enrichment on an Imprinted Polymer[J].Anal Chem,1994,66:1578-1582.
[16] Muldoon M T,Stanker L H.Molecularly Imprinted Solid Phase Extraction of Atrazine from Beef Liver Extracts[J].Anal Chem,1997,69:803-808.
[17] Blomgren A,Berggren C,Holmberg A,et al.Extraction of Clenbuterol from Calf Urine Using a Molecularly Imprinted Polymer Followed by Quantitation by High-performance Liquid Chromatography with UV Detection[J].J Chromatogr A,2002,975:157-164.
[18] Caro E,Marce R M,Cormack P A G.Synthesis and Application of an Oxytetracycline Imprinted Polymer for the Solid-phase Extraction of Tetracycline Antibiotics[J].Anal Chim Acta,2005,552:81-86.
[19] Yan H Y,Rowa K H,Yang G L.Water-compatible Molecularly Imprinted Polymers for Selective Extraction of Ciprofloxacin from Human Urine[J].Talanta,2008,75:227-232.
[20] Kempe M,Mosbach K.Molecular Imprinting Used for Chiral Separations[J].J Chromatogr A,1995,694:3-13.
[21] Yin J,Yang G,Chen Y.Rapid and Efficient Chiral Separation of Nateglinide and Its L-enantiomer on Monolithic Molecularly Imprinted Polymers[J].J Chromatogr A,2005,1090(1/2):68-75.
[22] Hayden O,Dickert F L.Selective Microorganism Detection with Cell Surface Imprinted Polymers[J].Adv Mater,2001,13:1480-1483.
[23] Haupt K,Mosbach K.Molecularly Imprinted Polymers and Their Use in Biomimetic Sensors[J].Chem Rev,2000,100:2495-2504.
[24] Sellergren B,Shea K J.Enantioselective Ester Hydrolysis Catalyzed by Imprinted Polymers[J].Tetrahedron Asymmetry,1994,5:1403-1406.
[25] Nicholls I A,Adbo K,Andersson H S,et al.Can We Rationally Design Molecularly Imprinted Polymers[J].Anal Chim Acta,2001,425:9-18.
[26] Alexander C,Andersson H S,Andersson L I,et al.Molecular Imprinting Science and Technology:a Survey of the Literature for the Years up to and Including 2003[J].J Mol Recog,2006,19:106-180.
[27] Wulff G.Selective Binding to Polymers via Covalent Bonds—the Construction of Chiral Cavities as Specific Receptor-sites[J].Pure Appl Chem,1982,54:2093-2102.
[28] Damen J,Neckers D C.Memory of Synthesized Vinyl Polymers for Their Origins[J].J Org Chem,1980,45:1382-1387.
[29] Shea K J,Stoddard G J,Shavelle D M,et al.Synthesis and Characterization of Highly Crosslinked Polyacrylamides and Polymethacrylamides—a New Class of Macroporous Polyamides[J].Macromol,1990,23:4497-4507.
[30] Sellergren B.Noncovalent Molecular Imprinting:Antibody-like Molecular Recognition in Polymeric Network Materials[J].Trends in Anal Chem,1997,16:310-320.
[31] Yu C,Mosbach K.Insights into the Origins of Binding and the Recognition Properties of Molecularly Imprinted Polymers Prepared Using an Amide as the Hydrogen-bonding Functional Group[J].J Mol Recogn,1998,11:69-74.
[32] Zhang T L,Liu F,Chen W,et al.Influence of Intramolecular Hydrogen Bond of Templates on Molecular Recognition of Molecularly Imprinted Polymers[J].Anal Chim Acta,2001,450:53-61.
[33] Puoci F,Garreffa C,Iemma F,et al.Molecularly Imprinted Solid Phase Extraction for Detection of Sudan I in Food Matrices[J].Food Chem,2005,93:349-353.
[34] Matsui J,Kato T,Takeuchi T,et al.Molecular Recognition in Continuous Polymer Rods Prepared by a Molecular Imprinting Technique[J].Anal Chem,1993,65:2223-2224.
[35]黄晓冬,孔 亮,厉 欣,等.原位分子印迹毛细管电色谱柱的制备及其对非对映异构体的分离[J].色谱,2003,21(3):195-198.
[36] Hedborg E,Winquist F,Lundstrom I,et al.Some Studies of Molecularly-imprinted Polymer Membranes in Combination with Field-effect Devices[J].Sensors and Actuators A:Physical,1993,37(2):796-799.
[37] Ye L,Ramstrom O,Mosbach K.Molecularly Imprinted Polymeric Adsorbents for Byproduct Removal[J].Anal Chem,1998,70(14):2789-2795.
[38] Hosoya K,Yoshizako K,Shirasu Y,et al.Molecularly Imprinted Uniform-size Polymer-based Stationary Phase for High-performance Liquid Chromatography Structural Contribution of Crosslinked Polymer Network on Specific Molecular Recognition[J].J Chromatogr A,1996,728(1):139-147.
[39] Yoshida M,Uezu K,Goto M,et al.Metal Ion Imprinted Microsphere Prepared by Surface Molecular Imprinting Technique Using Water-in-oil-in-water Emulsions[J].J Appl Poly Sci,1999,73(7):1223-1230.
[40] Araki K,Goto M,Furusaki S.Enantioselective Polymer Prepared by Surface Imprinting Technique Using a Bifunctional Molecule[J].Anal Chim Acta,2002,469:173-181.
[41] Zheng N,Li Y Z,Chang W B,et al.Sulfonamide Imprinted Polymers Using Co-functional Monomers[J].Anal Chim Acta,2002,452:277-283.
[42] Caro E,Marce R M,Cormack P A G,et al.Molecularly Imprinted Solid-phase Extraction of Naphthalene Sulfonates from Water[J].J Chromatogr A,2004,1047(2):175-180.
[43]苏立强,王俊涛,何丹风.水杨酸分子印迹分离介质的水相制备及色谱行为[J].化学通报,2006,22(3):216-219.
[44] Sun H,Qiao F.Recognition Mechanism of Water-compatible Molecularly Imprinted Solid-phase Extraction and Determination of Nine Quinolones in Urine by High-performance Liquid Chromatography[J].J Chromatogr A,2008,1212(1/2):1-9.
[45] Benito-Pena E,Urraca J L,Sellergren B,et al.Solid-phase Extraction of Fluoroquinolones from Aqueous Samples Using a Water-compatible Stoichiometrically Imprinted Polymer[J].J Chromatogr A,2008,1208(1/2):62-70.
[46] Vaihinger D,Landfester K,Krauter I,et al.Molecularly Imprinted Polymer Nanospheres as Synthetic Affinity Receptors Obtained by Miniemulsion Polymerization[J].Macromol Chem Phys,2002,203:1965-1973.
[47] Beltran A,Caro E,Marc'e R M,et al.Synthesis and Application of a Carbamazepine-imprinted Polymer for Solid-phase Extraction from Urine and Wastewater[J].Anal Chim Acta,2007,597(1):6-11.
[48]王培龙,范 理,宋 荣,等.动物尿液中盐酸克仑特罗的分子印迹固相萃取 -气相色谱-质谱法研究[J].分析化学,2007,35(9):1319-1322.
[49] Mirmahdieh S,Mardihallaj A,Hashemian Z,et al.Analysis of Testosterone in Human Urine Using Molecularly Imprinted Solidphase Extraction and Corona Discharge Ion Mobility Spectrometry[J].J Sep Sci,2011,34(1):107-112.
[50] Martin P D,Jones G R,Stringer F,et al.Comparison of Normal and Reversed-phase Solid Phase Extraction Methods for Extraction of β-blockers from Plasma Using Molecularly Imprinted Polymers[J].Analyst,2003,128:345-350.
[51] Javanbakht M,Ataran A A M,Namjoumanesh M H,et al.Solidphase Extraction of Tramadol from Plasma and Urine Samples Using a Novel Water-compatible Molecularly Imprinted Polymer[J].J Chromatogr B,2010,878(20):1700-1706.
[52] Gholivand M B,Khodadadian M,Ahmadi F.Computer Aidedmolecular Design and Synthesis of a High Selective Molecularly Imprinted Polymer for Solid-phase Extraction of Furosemide from Human Plasma[J].Anal Chim Acta,2010,658(2):225-232.
[53] Moein M M,Javanbakht M,Akbari-adergani B.Molecularly Imprinted Polymer Cartridges Coupled on-line with Highperformance Liquid Chromatography forSimple and Rapid Analysis of Dextromethorphan in Human Plasma Samples[J].J Chromatogr B,2011,879(11/12):777-782.
[54] Koeber R,Fleischer C,Lanza F,et al.Evaluation of a Multidimensional Solid-phase Extraction Platform for Highly Selective on-line Cleanup and High-throughput LC-MS Analysis of Triazines in River Water Samples Using Molecularly Imprinted Polymers[J].Anal Chem,2001,73(11):2437-2444.
[55] Shen Z L,Yuan D,Su Q D,et al.Selective Solid-phase Extraction Using Molecularly Imprinted PolymerforAnalysisof Methamidophos in Water and Soil Samples[J].Biosci Biotechnol Biochem,2011,75(3):473-479.
[56] Shi X,Wu A,Zheng S,et al.Molecularly Imprinted Polymer Microspheres for Solid-phase Extraction of Chloramphenicol Residues in Foods[J].J Chromatogr B,2007,850:24-30.
[57] Hu Y L,Liu R J,Li Y W,et al.Investigation of Ractopamineimprinted Polymer for Dispersive Solid-phase Extraction of Trace β -agonists in Pig Tissues[J].J Sep Sci,2010,33(13):2017-2025.
[58] Yan H Y,Tian M L,Row K H.Determination of Enrofloxacin and Ciprofloxacin in Milk Using Molecularly Imprinted Solid-phase Extraction[J].J Sep Sci,2008,31:3015-3020.
[59] De Prada A G V,Martínez-Ruiz P,Reviejo A J,et al.Solidphase Molecularly Imprinted on-line Preconcentration and Voltammetric Determination of Sulfamethazine in Milk[J].Anal Chim Acta,2005,539:125-132.
[60] He L M,Su Y J,Zheng Y Q,et al.Novel Cyromazine Imprinted Polymer Applied to the Solid-phase Extraction of Melamine from Feed and Milk Samples[J].J Chromatogr A,2009,1216(34):6196-6203.
[61] Urraca J L,Marazuela M D,Moreno-Bondi M C.Molecularly Imprinted Polymers Applied to the Clean-up of Zearalenone and Alpha-zearalenol from Cereal and Swine Feed Sample Extracts[J].Anal Bioanal Chem,2006,385(7):1155-1161.
[62] Zheng Y Q,Liu Y H,He L M,et al.Molecularly Imprinted Solid-phase Extraction for Determination of Tilmicosin in Feed Using High Performance Liquid Chromatography[J].Anal Chim Acta,2011,690(2):269-274.
[63] Matsui J,Nicholls I A,Takeuchi T.Molecular Recognition in Cinchona Alkaloid Molecular Imprinted Polymer Rods[J].Anal Chim Acta,1998,365:89-93.
[64] Takeuchi T,Matsui J.Miniaturized Molecularly Imprinted Continuous Polymer Rods[J].J High Resolut Chromatogr,2000,23(1):44-46.
[65] Theodoridis G,Manesiotis P.Selective Solid-phase Extraction Sorbent for Caffeine Made by Molecular Imprinting[J].J Chromatogr A,2002,948(1/2):163-169.
[66] Huang X D,Zou H F,Chen X M,et al.Molecularly Imprinted Monolithic Stationary Phases for Liquid Chromatographic Separation of Enantiomers and Diastereomers[J].J Chromatogr A,2003,984(2):273-282.
[67] Luo W,Zhu L H,Chen Y,et al.Synthesis of Surface Molecularly Imprinted Silica Micro-particles in Aqueous Solution and the Usage for Selective off-line Solid-phase Extraction of 2,4-dinitrophenol from Water Matrixes[J].Anal Chim Acta,2008,618(2):147-156.
[68] Zhu X,Su Q,Cai J,et al.Molecularly Imprinted Polymer Membranes for Substance-selective Solid-phase Extraction from Aqueous Solutions[J].J Appl Poly Sci,2006,101:4468-4473.
[69] Kobayashi T,Wang H Y,Fujii N.Molecular Imprinting of Theophylline in Acrylonitrile-acrylic Acid Copolymer Membrane[J].Chem Lett,1995,24(10):927-928.
[70] Schweitz L,Andersson L I,Nilsson S.Molecular Imprinting for Chiral Separations and Drug Screening Purposes Using Monolithic Stationary Phases in CEC[J].Chromatogr,1999,49:S93-S94.
[71]孟子晖,周永新,冯建林,等.分子烙印聚合物吸附有机磷毒剂的研究[J].分析化学,2000,28(4):432-435.
[72] Castro B,Whitcombe M J,Vulfson E N,et al.Molecular Imprinting for the Selective Adsorption of Organosulphur Compounds Present in Fuels[J].Anal Chim Acta,2001,435:83-90.
[73] Dandekar T,Argos P.Drug Assay Using Antibody Mimics Made by Molecular Imprinting Chemtracts[J].Biochem Mol Biol,1993,4(2):75-76.
[74] Zimmerman S C,Wendland M S,Rakow N A,et al.Synthetic Hosts by Monomolecular Imprinting Inside Dendrimers[J].Nature,2002,418:399-403.

