兽药粉剂中氯霉素类和硝基呋喃类药物的液相色谱-串联质谱分析方法的研究
刘正才,杨 方,余孔捷,张 琼,林永辉,陈瑞清
(1.福建出入境检验检疫局,福州 350001;2.福建省农产品质量安全检验检测中心,福州 350003)
氯霉素类和硝基呋喃类药物是水产和畜牧养殖中常用的广谱抗菌药物,临床上使用的主要有氯霉素、甲砜霉素、氟甲砜霉素、呋喃西林、呋喃妥因、呋喃唑酮、呋喃它酮等药物。由于这些药物在动物体内残留的原药或代谢产物会给人类健康造成一定的毒性,世界上绝大部分国家(包括欧盟、美国、日本等)规定在动物食用组织中不允许有氯霉素和硝基呋喃类药物残留,我国在农业部193号公告中把氯霉素和硝基呋喃类列为养殖禁用物质[1]。然而,一些不法兽药生产企业受经济利益的驱使,在允许使用的兽药制剂中非法添加禁用化学药物,由于这种添加往往是隐形的,虽然可能增强药效,但存在药物残留的隐患,所以对此类药物的检测势在必行。目前测定氯霉素类和硝基呋喃类药物的标准和方法很多[2-7],这些标准所适应的范围包括动物源性食品、饲料(预混合饲料)、蜂产品、肠衣等。对硝基呋喃类药物,现有的标准均为检测其残留代谢物标示物,而对于兽药的检测,由于没有经过动物基体的吸收,因此只需检测其母体原药。目前很少有适应于兽药制剂中氯霉素类和硝基呋喃类原药等兽药测定的标准和检测方法。由于兽药制剂成分复杂,提取和分离困难,基质干扰严重,常规的饲料、动物组织中的化学药物分析方法难于直接用于兽药制剂的分析,所以建立一套有效的分析方法是非常必要的。本方法在参考相关文献的基础上[8-9],建立了兽药制剂中三种氯霉素类药物(氯霉素、甲砜霉素、氟甲砜霉素)和四种硝基呋喃类原药(呋喃西林、呋喃妥因、呋喃唑酮、呋喃它酮)的液相色谱-串联质谱定性检测方法。该方法灵敏度高、效果好,可满足市场上常规兽药粉剂中氯霉素类和硝基呋喃类药物定性筛查需求。
1 材料与方法
1.1 药品和试剂 标准品呋喃西林、呋喃妥因、呋喃唑酮、呋喃它酮、氯霉素、甲砜霉素、氟甲砜霉素纯度≥99.0%,购自Sigma公司;乙腈、甲醇均为色谱纯,购自北京振翔公司;乙酸乙酯为分析纯,购自上海试剂一厂;实验用水应符合GB/T 6682一级水的要求。
1.2 仪器 液相色谱-串联质谱仪:配有电喷雾离子源,4000 Q Trap,美国Applied Biosystems公司;涡旋混合器,上海医科大学仪器厂;离心机,ANKE TDL-5,上海安亭科学仪器厂;MilliQ纯水系统,Millipore公司;Oasis HLB固相萃取小柱(3 cc/60 mg),Waters公司。
1.3 溶液的配制 标准储备液:分别称取硝基呋喃类、氯霉素类各标准品10 mg(准确至0.01 mg),分别用甲醇溶解并转移至100 mL容量瓶中,用甲醇定容至刻度,溶液浓度为100.0 μg/mL,4 ℃以下保存,保存期为6个月。混合工作液:分别取7种硝基呋喃类、氯霉素类标准储备液各1 mL,用甲醇稀释定容至100 mL容量瓶中,置4℃以下保存。
1.4 试验方法
1.4.1 液相色谱条件 色谱柱:Luna 3μ C18(2)150 mm ×3.0 mm(Phenomen公司);柱温30 ℃;进样量 10 μL;流速 0.3 mL/min;流动相 A:水,流动相B:乙腈,按梯度程序(表1)进行分析。
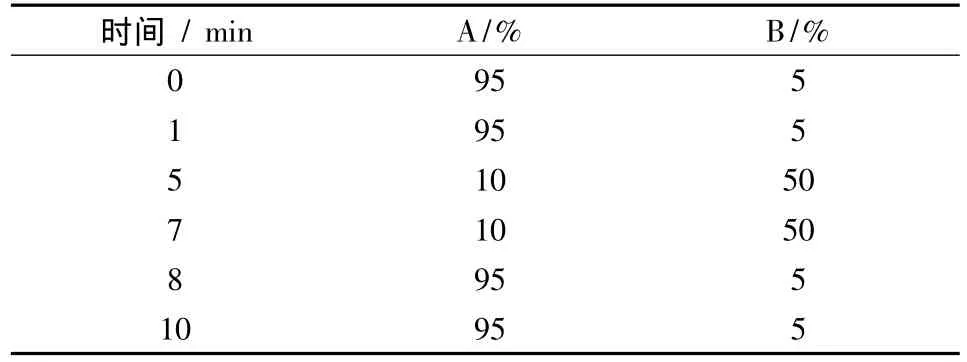
表1 梯度洗脱条件
1.4.2 质谱条件 电喷雾离子源(ESI);扫描方式为正负离子切换模式;采集方式为多反应监测(MRM),电喷雾电压(IS):5 000 V;气帘气压力(CUR):0.172 MPa(氮气);离子源温度(TEM):550℃;雾化气压力0.379 MPa;辅助气压力0.379 MPa;其他质谱参数如表2所示。

表2 被测物的简写、电离模式、母离子、子离子以及碰撞电压等参数
1.5 样品处理 称取1 g(精确到0.01 g)样品于100 mL容量瓶中,加入约50 mL水充分溶解,再用甲醇-水(50∶50,V/V)混合溶液准确定容至刻度,充分混匀后静止5 min。分取10 mL溶解液,用10 mL乙酸乙酯提取两次,合并乙酸乙酯,于40℃避光旋转蒸发至近干,加10 mL水,摇匀后过HLB固相萃取柱,10 mL水淋洗后,减压抽干5 min。用5 mL甲醇洗脱,有机相在40℃以下避光氮吹至近干,用乙腈-水(1∶9,V/V)溶解残渣并定容至1.0 mL,过0.22 μm滤膜后供液相色谱-串联质谱仪分析。
2 结果与分析
2.1 仪器条件的选择 由于待测的化合物性质差别较大,在质谱上电离方式差异较大,氯霉素类、呋喃西林和呋喃妥因采用ESI(-)获得很好的响应值,而呋喃唑酮和呋喃它酮ESI(+)获得很好的响应值,因此采用乙腈与水作为流动相,其洗脱梯度如表1所示,所测化合物在10 min内获得较好的分离。
2.2 提取与净化方式的选择 兽药粉剂基体比较复杂,含有大量的盐和乳化剂,样品溶解后直接用水稀释过HLB固相萃取小柱回收率低,基体质谱抑制大。本实验先用有机溶剂(乙酸乙酯)提取,避免了样品中有机盐分的干扰,获得了较好的过柱回收率(表3)。

表3 各种抗菌药物在复方氨苄西林粉中的回收率比较(n=6)
2.3 标准曲线与检测限 以各组分定量离子的色谱峰面积为纵坐标(y轴),质量浓度(x轴,ng/mL)为横坐标,绘制标准曲线。各组分的标准曲线方程及相关系数(r)如表4所示。选择不含待测化合物的样品,按照上述的实验步骤进行测定,得到空白基质溶液,以此溶液稀释各标准工作液进样,得到各抗菌药物的基质质谱图,按照3倍信噪比(S/N)计算所对应化合物的浓度为检测限,其结果如表4所示。从表中可以看出,每种化合物的检测限均小于0.5 mg/kg,因此利用该方法可比较满意地检测到兽药粉剂中添加的微量抗菌药物。

表4 7种药物标准曲线、线性范围、相关系数以及检测限
2.4 定性判断 由于所分析的兽药制剂成分复杂,对每个样品的基体性质差别较大,而且对所分析化合物的浓度含量低,定量结果的变异系数较大,因此此方法可作为定性筛选分析,判断依据分别参考保留时间定性的原理以及欧盟委员会第2002/657/EC号决议《欧盟委员会关于分析方法评价和结果解释的决定》中关于串联质谱残留分析4个识别点要求和丰度比的定性确证的要求[9](表5)。
在上述操作条件下,用流动相平衡系统平衡,待仪器稳定后,注入标准溶液和空白样品溶液以及加标样液,以液相色谱-串联质谱MRM扫描模式进行测定,根据各化合物标样的保留时间和主要碎片离子丰度比进行定性。仅在完全同时满足以下3个条件时,才判断为阳性:(1)未知物的保留时间与标准溶液的保留时间相差不超过0.2 min;(2)未知物两个子离子响应信号的信噪比均大于3;(3)如果检出的质量色谱峰保留时间与标准样品一致,并且在扣除背景后的样品谱图中,各定性离子的相对丰度与浓度接近的同样条件下得到的标准溶液谱图相比,误差不超过表5中规定的范围。
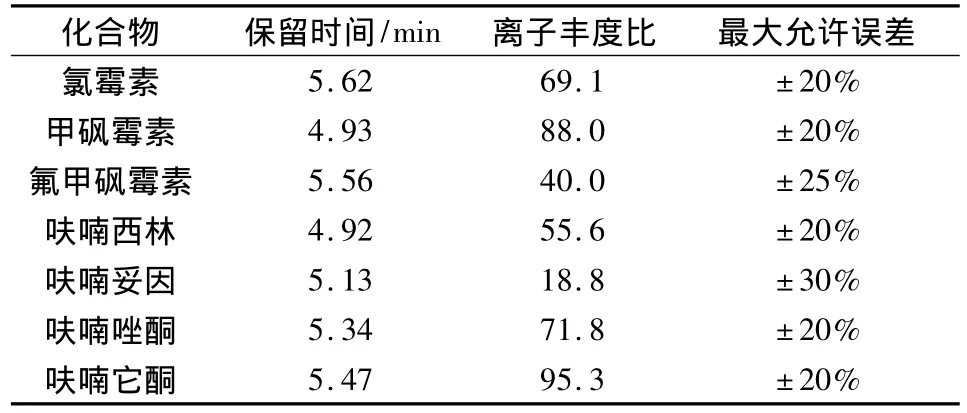
表5 被测物的保留时间以及定性确证时相对离子丰度的最大允许误差
2.5 检测限和专属性方法学验证实验 参考美国FDA分析方法验证指南中关于各类检测的推荐验证项目要求[8],本方法主要验证的内容为检测限和专属性。称取不同的阴性样品,考虑到非法添加的程度不一样,按微量、衡量添加水平估算,分别为1.0、2.0、100.0 倍检测限(LOD)的标准液,按以上操作步骤进行测试(图1)。统计结果参照文献定性方法以检出概率表示,检出概率(POD,Probability of detection)[10]:对于给定基体与特定分析物水平或浓度来说,是检出阳性分析结果在所有检测结果中所占比例。公式为:POD=,其中x为检出阳性结果次数,N为测定总次数,结果如表6所示。同时还对阴性样品“复方氨苄西林粉”(主成分氨苄西林)、“铁杆无敌”(主成分林可霉素)、“肠毒清”(主成分林可霉素)进行了同样的测试,结果表明,在1.0、2.0、100.0 倍 LOD 水平上都有检出,表明此方法专属性良好,灵敏度较高,可满足兽药制剂中对氯霉素类、硝基呋喃类物质定性筛选的要求。

表6 添加实验结果(n=20,基体为硫酸粘杆菌素预混剂)
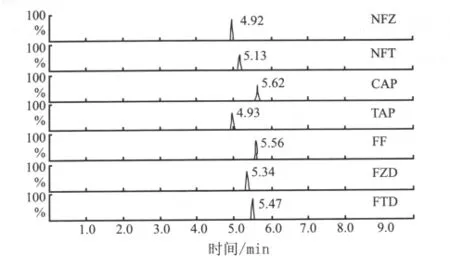
图1 在检测限水平上的加标样品色谱图(基体为硫酸粘杆菌素预混剂)
2.6 实际样品的测定 采用此方法对市售常用兽药200个批次进行检测,监测的兽药商品名有硫酸安普霉素可溶性粉、三和新和奇、氨苄青霉素钠可溶性粉、盐酸多西环素、阿奇霉素可溶性粉、菌痢王、炎迪、癸氧喹酯预混剂等非主要检测成分的兽药,其中1个批次检出氯霉素,18个批次检出氟甲砜霉素。
3 结论
实验结果表明,本文建立的高效液相色谱-串联质谱法可同时快速分析和监测7种兽药制剂中氯霉素类、硝基呋喃类化合物,该方法具有灵敏、快速、简单等优点,为企业更好控制在用药物提供了一定参考,为管理部门监控禁用物质的非法添加提供检测方法参考。
[1]Commission Regulation(EC)No 1442/95.Commission Regulation(EC)No 1442/95 of 26 June 1995 Amending Annexes I,II,III and IV of Council Regulation(EEC)No 2377/90 Laying down a Community Procedure for the Establishment of Maxmum Residue Limits of Veterinary Medicinal Products in Food[S].
[2]葛宝坤,王云风,常春艳.测定鸡肉、水产品中四种硝基呋喃类药物残留量的固相萃取-液相色谱法[J].分析测试学报,2003,22(5):91-93.
[3]林黎明,林回春,刘心同.固相萃取高效液相色谱-质谱法测定动物组织中硝基呋喃代谢产物[J].分析化学,2005,33(5):707-710.
[4]蒋 原,丁 涛.液相色谱-电喷雾质谱联用检测蜂蜜中四种硝基呋喃类代谢物[J].畜牧与兽医,2005,37(3):12-15.
[5]彭 涛,李淑娟,储晓刚,等.高效液相色谱/串联质谱法同时测定虾中氯霉素、甲砜霉素和氟甲砜霉素残留量[J].分析化学,2005,33(4):463-466.
[6]陈小霞,岳振峰,吉彩霓,等.高效液相色谱-电喷雾电离三级四极杆质谱测定鸡肉中氯霉素、甲砜霉素和氟甲砜霉素的残留量[J].色谱,2005,23(1):92-95.
[7]谢 文,丁慧瑛,黄雷芳,等.高效液相色谱-电喷雾电离三级四极杆质谱检测动物源食品中氯霉素、甲砜霉素、氟苯尼考残留量[J].分析试验室,2007,25:1-4.
[8]Feldsine P,Abeyta C,Andrews W H.AOAC International Methods Committee Guidelines for Validation of Qualitative and Quantitative Food Microbiological Official Methods of Analysis[J].J AOAC Int,2002,85(5):1187-1200.
[9]Commission Decision 2002/657/EC of 12 August 2002 Implementing Council Directive 96/23/EC Concerning the Performance of Analytical Methods and the Interpretation of Result(Official Journal L221,17 August 2002,pp.:8-36).
[10] ISO 16140.Microbiology of Food and Animal Feeding Staffs-Protocol for the Validation of Alternative Methods[S].

