广东省外观健康犬携带狂犬病毒情况调查结果分析*
谷文喜,袁 洁,陈 晶,颜 瑾,邓小玲,柯昌文,何剑锋
2.中山大学公共卫生学院,广州 510080;
3.广东省农业科学院兽医研究所,广州 510640
狂犬病是由狂犬病病毒引起的急性致死性人兽共患传染病,主要侵害中枢神经系统,造成受害动物极度兴奋、狂躁不安和意识障碍,一旦发病,病死率100%。我国是世界上狂犬病第二严重国家,疫情主要集中在南方各省,广东省是我国狂犬病高发省之一,犬是广东省狂犬病的主要传播动物。调查发现,在发病者中有 81.51%~95.7%的感染都来自犬[1-6],说明在狂犬病的流行中,犬在其中起着重要的作用。为了了解健康犬对人潜在的威胁程度,我们对广东省境内外表健康犬的狂犬病毒带毒率进行了调查。
1 实验材料和方法
1.1 标本的采集 于2008年在广东省境内随机抽取10个地市,对待销售的食用犬及流浪犬进行犬脑(海马回、小脑、中脑和大脑)的采集,标本冷链送往广东省CDC检测。
1.2 方法 用WHO推荐的狂犬病实验室诊断方法直接免疫荧光法(DFA)对所有犬脑组织样品进行狂犬病病毒抗原筛查检测,阳性样品再用巢氏聚合酶链反应(RT-PCR)和小鼠感染法(MIT)进行复核检测。阳性RT-PCR产物纯化(QIA quick PCR Purification Kit)后,直接进行测序并和部分已发表狂犬病病毒序列进行比对。
1.2.1 DFA检测犬脑组织中病毒抗原
1.2.1.1 制备脑组织印片 取大脑、中脑和小脑3个部分的横断面,均匀涂印于酒精处理过的干燥载玻片上,室温干燥后,冷丙酮(-20℃)固定过夜。
1.2.1.2 荧光染色 固定好的载玻片取出吹干,将稀释好的狂犬病毒荧光抗体(Rabies IFA Reagent,美国Chemicon公司)滴加在脑组织印迹上(确保完全覆盖),然后放入湿盒中,37℃,30min,用缓流冲洗抗原片15s,再用PBS振洗2遍,浸泡1遍,吹干,90%甘油(PBS)封片。
1.2.1.3 荧光显微镜观察 仔细观察每个视野的荧光强度,结合其分布状况进行判定。以观察到特异性翠绿色点状荧光判为阳性,否则为阴性。
1.2.2 RT-PCR法检测DFA阳性及可疑阳性样本中的病毒核酸 对DFA初检中的阳性和可疑阳性样本进行狂犬病毒特异性核蛋白基因(N)片段的检测,引物序列及相关信息见表1。
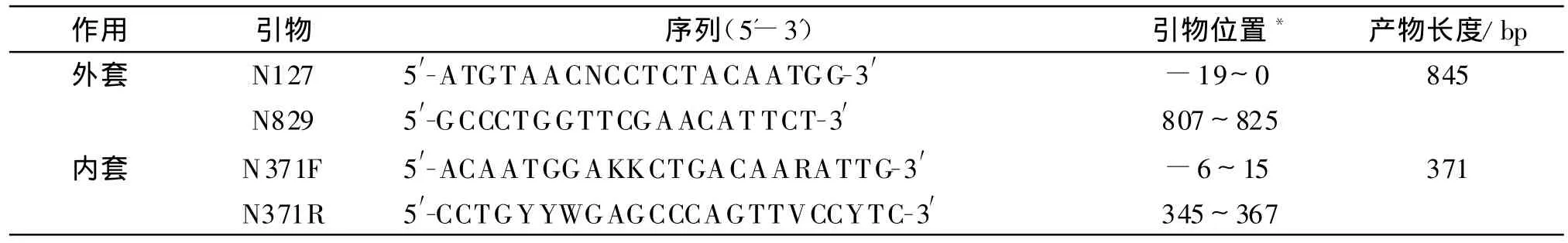
表1 PCR扩增引物及相关信息Table 1 Primers sequences used for the PCR
1.2.2.1 标本RNA的提取 取DFA阳性犬的不同部位脑组织共约100 mg,加入200 μ L Trizol(美国 Invitrogen公司),研磨机研磨均匀,补Trizol加至1 000 μ L,快速颠倒离心管30~40次充分混匀内容物,室温放置5 min;加 200 μ L氯仿,快速颠倒离心管数次(30 s),使其呈淡粉红色,室温放置3 min;4℃离心,12 000 r/min,15 min;取离心后水相600 μ L,加入到已有 600 μ L异丙醇的新的离心管中,轻柔混匀。室温放置10 min;4℃离心,12 000 r/min,10 min;缓缓倒掉上清,用枪头轻轻吸去残存液体,可见少量沉淀;加1 mL 75%乙醇(DEPC H2O新鲜配制)洗涤沉淀;4℃离心,12 000 r/min,10 min;缓缓倒掉上清,用枪头轻轻吸去残存液体,室温干燥数分钟;沉淀溶于70 μ L DEPC水中,分装于2个离心管中,直接进行逆转录或-70℃储存。
1.2.2.2 逆转录合成cDNA Pd(N)6稀释至0.2 μ g/μ L。水浴预热至65 ℃,33 μ L RNA 液 65 ℃水浴 10 min,冰浴 2 min,瞬时离心 ;将 32 μ L RNA 液转移至逆转录反应管(Ready-To-GO You-Prime First-Strand Beads,美国Amersham 公司)中,加入1 μ L随机引物Pd(N)6(Takara公司),使总体积达到 33 μ L;室温放置1 min,混匀,瞬时离心;37 ℃水浴,60 min,得到cDNA,-20℃或-70℃保存。
1.2.2.3 RT-PCR 将上游引物N127,下游引物N829和cDNA加入Go Taq Green Mix(美国Promega公司)中,进行第一次 PCR循环,条件为:94℃预变性2 min;94℃变性30 s,56℃退火30s,72℃延伸40 s,共35个循环;72℃延伸10 min。以第1次反应产物作为模板,并加入上游引物N371F和下游引物N371R,进行第二次PCR反应,反应条件与第一次反应条件相同。以DL2000(Takara公司)为Marker,在2%琼脂糖凝胶上电泳,观察结果。
1.2.3 MIT试验 采用RT-PCR检测阳性犬的脑组织2份,分别加缓冲盐水研磨,制成20%的悬液,脑内10 μ L接种5只乳鼠,接种后继续由母鼠喂养,每天观察发病情况,在9~17d内出现震颤、麻痹或死亡者,取出脑组织,做 DFA和 RT-PCR检测验证。
1.2.4 核酸测序 PCR阳性扩增产物用Qiagen公司胶回收试剂盒纯化,用PCR引物进行测序反应并纯化产物,再用ABI PRISM○R3130测序仪进行测序。测序结果的比对及基因系统进化树的构建均使用MEGA 4软件包以邻位相连法(NJ)完成。所用参考毒株N基因序列来源于GenBank数据库,具体信息见表2。
2 结 果
所有1 833份脑组织样本先用DFA法进行初筛,共检出阳性和可疑阳性样本325份,阳性率为17.73%。对这325份脑组织阳性或可疑样本进行RT-PCR法检测,得到阳性结果2份,占 1 833份的0.11%。把这2份阳性样品分别用MIT法再次检验,结果都为狂犬病病毒阳性。
2.1 DFA法检测结果 共有325份标本脑印片观察到翠绿色点状荧光。狂犬病病毒抗原阳性和阴性照片见图1。
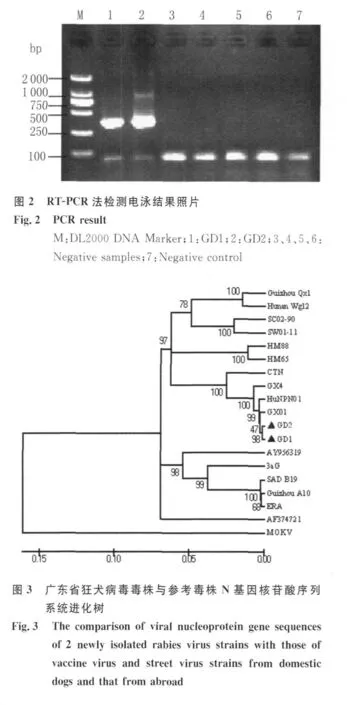
2.2 RT-PCR法检测结果 对325份DFA阳性样本进行RT-PCR检测,有2份样本电泳显示得到与目的片段(371bp)大小一致的条带,其它样本均无条带,见图 2。

表2 广东省分离狂犬病毒毒株与参考毒株相关信息Table 2 Information of viruses'gene used in this study

图1 DFA法检测狂犬病病毒抗原照片Fig.1 The picture of rabies antigen by DFA:positive(left),negative(right)
2.3 MIT法检测结果 发病及死亡鼠脑组织做DFA检测,镜检观察到典型的翠绿色尼基氏小体,且RT-PCR电泳也出现了371 bp的目的大小条带,可以证明确实是狂犬病毒感染。
2.4 核蛋白基因(N)片段序列分析 对广东分离株与参考毒株的N基因片段做进一步测序分析,结果显示广东分离的2个毒株都属于狂犬病毒I型,与其它部分已发表毒株基因序列的系统进化树关系如图3,广东分离株GD1和GD2同源性为99.8%;与湖南株GX01同源性最高分别为99.4%和99.3%;在四个疫苗株中,广东分离株与CTN株的同源性最高分别为94.6%和94.5%,与印度、印度尼西亚和泰国分离株比较,与泰国分离株同源性最高为88.5%~89%。
3 讨 论
近几年狂犬病在我国呈高发态势。由于犬与人类的接触最为密切,且犬仍然是狂犬病流行的重要宿主动物和传染源[7],因此掌握外观健康犬的带毒情况对狂犬病的防控有着重要意义。通过序列分析显示广东分离到的两毒株同源性在99.8%,表明它们有着共同的来源;广东株与湖南株HuNPN01、广西株GX01处于同一分支中,亲缘关系最近,考虑到三省互临,我们推测该类狂犬病毒在三省间可能呈循环传播。值得注意的是,虽然湖南株HuNPN01分离自猪,但流行病学资料显示,此次猪群间爆发的狂犬病是由猪场主邻居家一条发病犬窜入猪场咬伤猪只而引起的[8],这至少说明此型病毒依然主要是在犬中流行;在我国目前使用的 4个疫苗株中,CTN与广东毒株亲缘关系最近,提示在病毒分离地区使用CTN株疫苗对犬只进行免疫应能取得较好的保护效果;与东南亚三个邻国毒株序列的比较,发现广东株与泰国株和印度尼西亚株的同源性最为接近,预示三地间狂犬病毒有一定的联系,需要做更深入的流行病学研究。
直接荧光抗体法(DFA)是WHO推荐的实验室诊断方法,也是我国狂犬病诊断标准(WS281-2007)中指定的狂犬病病毒抗原检测方法之一。我国狂犬病诊断标准规定,临床确诊病例加上以下的任何一项,即DFA或ELISA检测狂犬病病毒阳性、RT-PCR检测狂犬病病毒核酸阳性或细胞培养分离到狂犬病病毒,就可以做为实验室确诊病例。本研究中由于检测的是外观健康犬(非发病犬),因此使用了DFA和RT-PCR两种方法结合进行检测,其优点是DFA法成本低、操作简便、快速,便于进行批量筛查检测,RT-PCR法敏感、准确、结果客观。本研究1 833份样本中DFA检测阳性325份,阳性率为17.73%,这一结果与此前报道广东省外观健康犬的带毒率为17.7%[9]一致。而后对这325份DFA阳性样本进行RT-PCR法检测,阳性结果2份,计算得出总体阳性率为0.11%。两种检测方法的结果差异非常大,造成这种DFA方法检测阳性率过高现象的原因可能是:此前报道的带毒率为17.7%的研究方法与本研究中的DFA法原理相似,都是利用免疫荧光原理对狂犬病病毒抗原进行检测,但是在制片过程中如果印片过厚或冲洗不彻底易发生荧光染料非特异性堆积,进而造成假阳性结果[10];由于是对非发病犬样本进行检测,即使样本含有病毒颗粒也可能数量较少,这在结果判定上不易区分非特异残存荧光颗粒和这种弱阳性荧光颗粒之间的差异,往往容易把少量存在的非特异残存荧光颗粒判定为弱阳性;就DFA方法本身而言,对于可疑阳性样本的判定,观察者主观因素的影响是很大的,有报道在同一实验室由于操作者和试剂不同,其前后两次的DFA结果也不同[11]。基于以上原因,对DFA可疑阳性样本有必要再用 RT-PCR法进行复核检测,最终应以两种方法都为阳性者判为阳性结果,这种组合检测方法已被越来越多的实验室用于组织样本中狂犬病毒抗原的检测[12-15]。而本研究中使用的RVN371巢式PCR法扩增的特异性N基因片段具有很高的特异性,其序列通过分析能够反映出不同毒株间的遗传衍化关系[16-18],可对狂犬病毒的核酸进行有效检测。
广东省是我国狂犬病发病最严重的省份之一,防控狂犬病刻不容缓。除了要继续加大对狂犬病的预防控制和宣传力度外,也要加强对狂犬病的监测能力,要让狂犬病的监测做到常态化,及时掌握广东省内及周边省份乃至邻国的狂犬病流行动态,为可能爆发的疫情做好准备。
[1]钟文钊,黄新华.阳山县 1980-2004年狂犬病流行病学分析[J].热带医学杂志,2005,5(5):727-728.
[2]孔祥钦,周荣群.五华县 2001-2007年狂犬病流行病学分析[J].职业与健康,2009,25(11),1170-1171.
[3]林燕锋,黄金英,孙小康.清远市2001-2005年狂犬病流行病学分析[J].热带医学杂志,2006,6(12):1305-1306.
[4]刘雪梅,梁立环,薛妙钦.惠州市2006-2007年狂犬病暴露人群监测结果[J].实用预防医学,2009,16(1):102-103.
[5]林宏波,林伟波,池建源,等.2005-2007年广东省揭阳市狂犬病流行情况分析[J].疾病检测,2009,24(6):404-406.
[6]吴小玲,张艺,何泳滨.高州市2004-2008年狂犬病流行特征分析[J].医学动物防制,2009,25(7):494-496.
[7]宋淼,唐青,许真,等.中国2005年狂犬病流行相关因素分析[J].中华流行病学杂志,2006,27(11):956-959.
[8]Jiang Y,Yu X,Wang L,et al.An outbreak of pig rabies in Hunan province,China[J].Epidemiol Infect,2008,136(4):504-508.
[9]杜福,黄满涛,梁凤屏,等.广东省犬带狂犬病毒调查[J].中国人兽共患病杂志,1992,8(2):39-41.
[10]徐葛林,吴杰,吴泰才,等.多种方法对广西地区健康犬带狂犬病毒的调查[J].中国人兽共患病杂志,1999,15(3):108-109.
[11]Loeffelholz M J,Thompson C J,Long K S,et al.Comparison of PCR,culture,and direct fluorescent-antibody testing for detection of Bordetella pertussis[J].J Clin Microbiol,1999,37(9):2872-2876.
[12]李浩,陶晓燕,宋淼,等.狂犬病高发地区犬只感染情况调查分析[J].中华实验和临床病毒学杂志,2008,22(3):161-164.
[13]于金宁,李浩,唐青,等.中国狂犬病毒感染分布状况调查[J].中华流行病学杂志,2010,31(5):521-524.
[14]戴德芳,张红,刘运芝,等.湖南省2006年狂犬病病原学监测[J].中华流行病学杂志,2008,29(10):1009-1012.
[15]王世清,刘富强,高立冬,等.湖南省2007年狂犬病监测结果[J].实用预防医学,2008,15(6):1819-1821.
[16]江禹,王莉莉,韩小虎,等.动物狂犬病病毒巢式 RT-PCR检测方法的建立[J].中国兽医学报,2009,29(8):1003-1007.
[17]Jean S S,Lillian A O,Pamela A Y,et al.Epidemiologic and histo rical relationships among 87 rabies virus isolates as determined by limited sequence analy sis[J].J Infect Dis,1992,166:296.
[18]王树声.预防控制狂犬病的新策略和措施[J].国际流行病学传染病学杂志,2009,36(6):361-364.

