入侵种加拿大蓬对玉米的化感潜力及机制研究
杨 莉,韩 梅,肖春萍,杨利民
(吉林农业大学中药材学院,吉林省生态恢复与生态系统管理重点实验室,吉林长春 130118)
生物入侵是当前最棘手的三大环境问题之一,它严重地威胁着土著生态系统的完整性和生物多样性[1].很多入侵植物成为农林杂草,在全世界不同地区存在不同程度的爆发,如紫茎泽兰、胜红蓟等,给农林业造成了巨大的直接经济损失[2-3].根据刘绍芹等[4]的调查,当大豆田中每行每10 m有4株豚草时,可使大豆减产132 kg/hm2.玉米田中的入侵种三裂叶豚草可使玉米产量降低300~450 kg/hm2,甚至不能形成雌穗[5].除与作物争光、争水、争营养之外,目前的研究显示很多入侵种还可通过淋溶或挥发等释放化感物质抑制其周围植物的生长发育[6],其作用机制包括影响受体植物的光合作用、呼吸作用,抑制根系对K、P、Ca等离子和水分的吸收,影响受体植物细胞膜的透性等[7-11].
入侵种加拿大蓬Erigeron canadensis L.为菊科飞蓬属一年生草本植物,原产北美,现我国各地均有分布,是我国分布最广的入侵种之一.该植物适生于山坡、草地、田野、路旁和河堤等处,生活力强,适应性广,常形成单优势种群,表现出极强的竞争优势[12],目前已成为吉林省常见的田间杂草之一[13].吉林省是我国春玉米的主产区,玉米Zea mays L.是其主要栽培的农作物之一.根据目前的研究结果,玉米种子萌发及幼苗生长可受菊科多种外来入侵植物的抑制[14],但化感物质对玉米成熟植株的影响还鲜有报道.本文研究了外来入侵杂草加拿大蓬对玉米成熟植株的化感潜力及可能的作用机制,为评估加拿大蓬的生态危害、深入研究其化感作用机制以及玉米田间杂草的控制与防除提供理论依据.
1 材料与方法
1.1 试验地概况
试验地设在吉林农业大学中药材学院药植园,试验区海拔251 m,年平均降水量568.5 mm,6—8月降水占全年的70%以上.年平均气温4.8℃,极端高温39.5℃,极端低温-39.8℃。
1.2 试验材料和田间试验处理
加拿大蓬采自于吉林农业大学田间实验区外围荒地,由吉林农业大学野生植物资源教研室韩梅教授鉴定.玉米种子(特早澳粘玉米),购于吉林省长春市现代农业研究所.加拿大蓬水溶性化感物质的提取采用蒸馏水浸提法.将100 g加拿大蓬植株剪成段,20倍蒸馏水室温浸泡12 h后,更换水液,再浸泡12 h,将2次水液合并,过滤,真空减压浓缩定容,得0.05 g/mL加拿大蓬水提液.
试验采用盆栽法,泥盆深约30 cm,底部内径约20 cm,每个处理20盆,共计80盆.试验用土为园区土,每盆装土深度约28 cm.将80盆土随机分为4组,摆放在园圃内.玉米种子温汤浸种催芽,待胚根长出后播种,每盆5粒,保证土壤水分充足,苗出齐后,三叶期每盆定苗1株.在拔节期开始用加拿大蓬水提液浇灌处理,以蒸馏水为对照,设置0.010、0.025、0.050 g/mL 3个浓度梯度,根灌,每7 d浇灌1次,每次100 mL,正常田间管理.
1.3 叶片光合能力的测定
分别于吐丝期、灌浆期、成熟期选择晴天上午9:00—10:00采用LCI(USA)光合作用系统测定仪测定其光合作用参数.每个处理选择6个穗位上部叶,挂牌标记,结果取平均值.测定指标包括:叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(E)等.水分利用效率(WUE)=Pn/E.
1.4 叶面积及光合色素含量的测定
成熟期时选择生长良好、大小一致的玉米5株,每株均在穗位上、下选择没有病虫害、完全伸展的成熟叶片2片用于叶面积和光合色素的测定.采集的叶片先采用CI-203(USA)手持式激光叶面积仪测定其面积、叶长、叶宽.叶绿素含量的测定按照张治安等[15]的方法进行测定.
1.5 生物量的测定
成熟期将长有玉米的土柱从盆中取出,用手轻轻敲打土柱四周直至将土拍得松散,取出完整的植株,迅速带回实验室,按照根、茎、叶、穗分开,用报纸分别包好,105℃杀青30 min后,70℃恒温烘干后称各个部分干质量.
1.6 统计方法
数据采用SPSS 13.0统计软件进行分析.
2 结果与分析
2.1 加拿大蓬对玉米叶片结构参数的化感作用
叶片是植物主要的光合器官,其面积大小关系着植株光合能力的强弱和干物质的生产能力.由表1可见,经加拿大蓬水提液处理后,玉米的叶长、叶宽、叶面积均有不同程度的下降,多数与CK达到差异显著水平.其中,叶长、叶宽、叶面积分别下降了9.50%、10.98%、17.76%.不同质量浓度加拿大蓬水提液对玉米叶片结构的影响以0.050 g/mL处理的叶面积最小,但3个处理间叶面积没有显著差异.
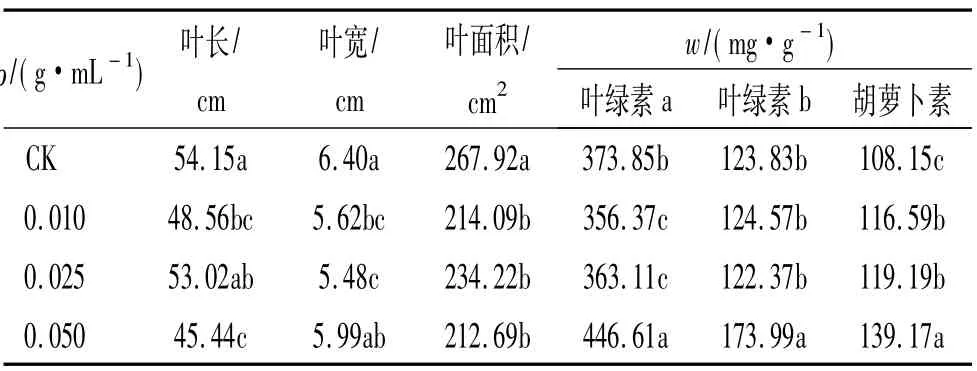
表1 叶片结构参数对不同质量浓度加拿大蓬水提液化感作用的响应1)Tab.1 Responses of the leaf traits of maize to the different concentrations of aqueous leachates of Erigeron canadensis
光合色素是绿色植物进行光合作用必需的物质,其中叶绿素是植物光合色素中最重要的一类色素,其含量可受多种逆境的胁迫而下降[16].类胡萝卜素不仅是捕光色素,还可以淬灭不稳定的三线态叶绿素和具有强氧化作用的单线态氧,从而保护受光激发的叶绿素免遭光氧化破坏,降低光合膜受损伤程度[17].类胡萝卜素含量的上升,说明它们清除活性氧的能力较强[18],也说明需要清除的活性氧的数量增加.由表1可知,经加拿大蓬水提液处理后,3种光合色素变化差异较大.在低质量浓度加拿大蓬水提液处理下(0.010、0.025 g/mL),受体叶绿素a含量下降且与CK差异显著;叶绿素b含量没有显著变化;胡萝卜素含量上升且与CK差异显著.而在高质量浓度加拿大蓬水提液处理下(0.050 g/mL)玉米叶片中3种色素的含量均表现为剧烈上升,与其他处理差异均达到显著水平.
2.2 加拿大蓬对玉米叶片光合能力的影响
由图1A可知,加拿大蓬水提液处理后,玉米净光合速率有不同程度的降低.对照与处理差异最大的时期为吐丝期,CK净光合速率分别比0.010、0.025和0.050 g/mL 3个处理高出32.12%、15.73%和22.64%,此后两者之间的差距逐渐减小.灌浆期是玉米生长的关键时期,在籽粒灌浆期维持光合产物的供给是获得高产的重要因素[19].如图1A,此时玉米的光合能力达到峰值,对照净光合速率为 40.57 μmol·m-2·s-1,分别比 0.010、0.025 和0.050 g/mL处理高出11.9%、10.2%和11.6%.气孔导度及蒸腾速率的变化趋势与净光合速率变化趋势类似,总体表现为对照高于处理,其间的差异在吐丝期最大,之后逐渐减小(图1B、1C).
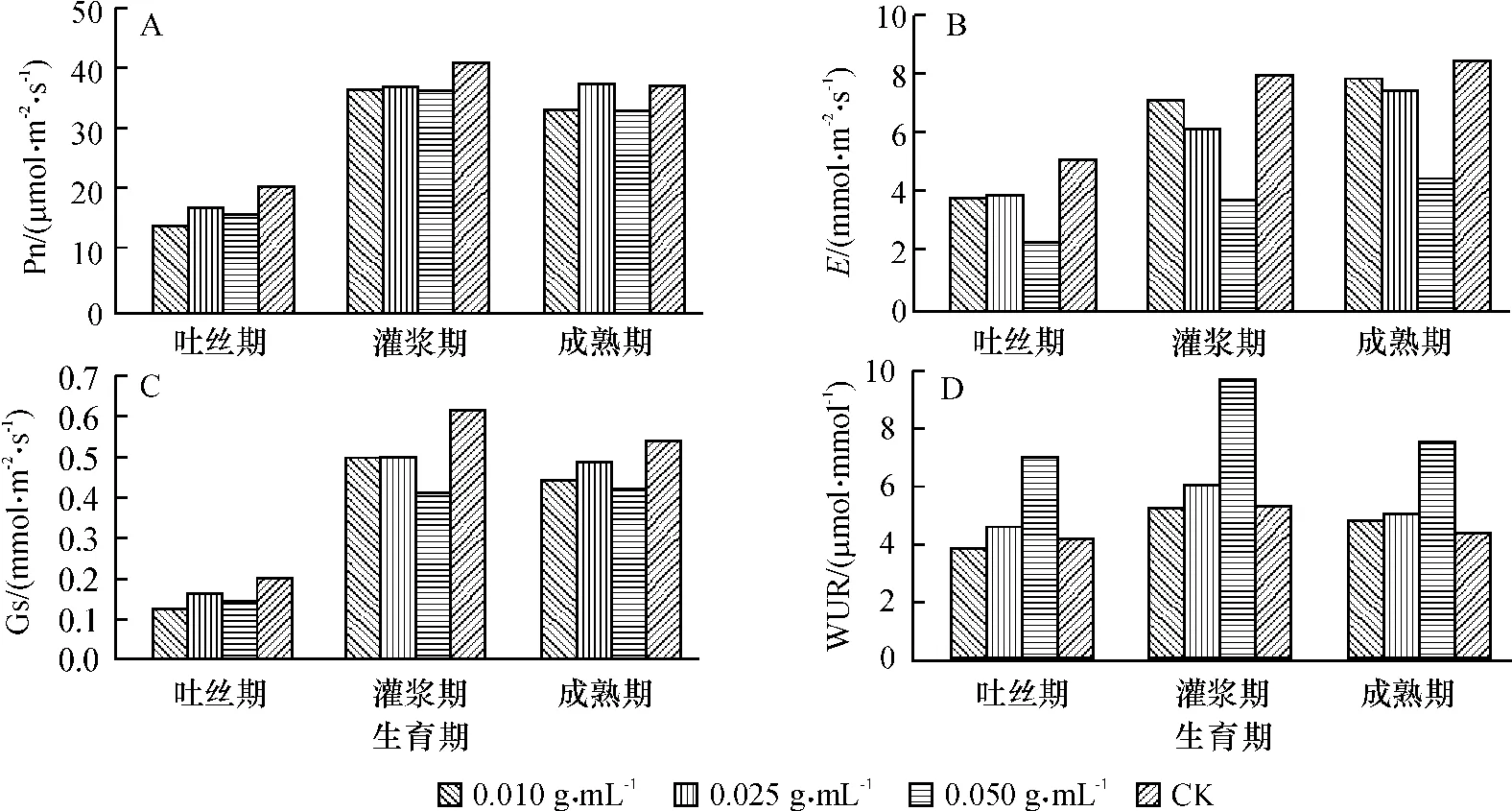
图1 质量不同浓度加拿大蓬水提液对玉米叶片气体交换参数的影响Fig.1 Effects of different concentrations of aqueous leachates of Erigeron canadensis on leaf gas exchange parameters of maize
各个时期不同质量浓度的加拿大蓬水提液对玉米净光合速率、气孔导度的影响没有明显的浓度规律,总体看来以0.025 g/mL处理数值最高;而蒸腾速率大致表现为0.010 g/mL处理>0.025 g/mL处理>0.050 g/mL处理.各个时期均以0.050 g/mL处理蒸腾速率最低,吐丝期、灌浆期、成熟期不同质量浓度处理的蒸腾速率均低于CK.蒸腾速率的降低是其水分利用效率增加的主要原因,如图1D所示,各个时期0.050 g/mL处理下水分利用效率均高于其他处理.
2.3 加拿大蓬对玉米各部位生物量积累的影响
由表2可见,经加拿大蓬水提液处理后,玉米株高、茎粗以及各部位生物量均低于对照.随着处理液浓度的升高,各项指标的数值有上升的趋势,在受试范围内,除根质量外,其余指标上升趋势差异未达到显著水平.在相同质量浓度的水提液处理下,加拿大蓬化感物质对茎粗的抑制作用强于株高;除0.050 g/mL处理根质量有所增加外,加拿大蓬水提液对4个部位生物量积累的抑制强弱顺序为:根>茎>穗>叶.
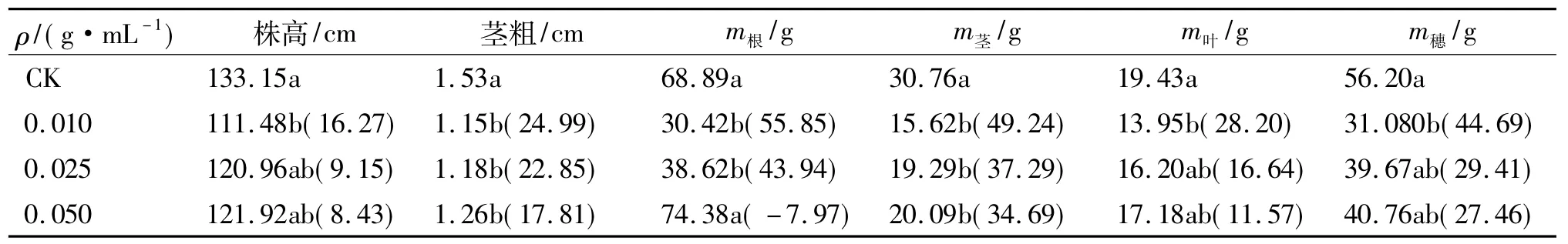
表2 不同质量浓度加拿大蓬水提液对玉米株高、茎粗和各部位生物量的影响2)Tab.2 Effects of different concentrations of aqueous leachates of Erigeron canadensis on plant height,stem diameter and biomass of maize
光合产物在各个部位的分配如表3.成熟时,对照玉米的光合产物主要分布在根和穗中.与对照相比,0.010、0.025 g/mL处理下玉米的根质量占比下降,穗质量占比有所增加;而0.050 g/mL处理玉米的根质量占比增大,接近总体生物量的50%,穗质量比下降,比对照减少了5.32%,根冠比0.95,为对照的147.20%,地下部分比例大大增加,植物的干物质倾向于向根部流动.
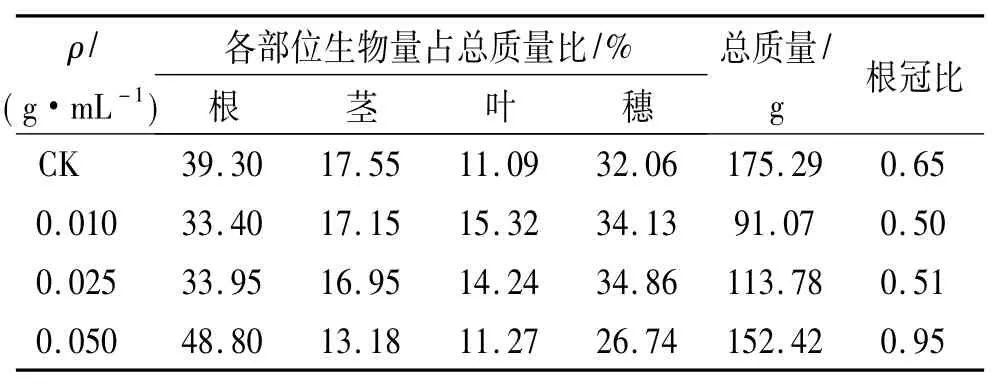
表3 不同质量浓度加拿大蓬水提液处理下玉米各部位生物量占总质量的比例Tab.3 The percentage of maize parts in their total biomass cultured with different concentrations of aqueous leachates of Erigeron canadensis
低浓度处理下,根受到的抑制作用最强;高浓度条件下,其生物量又反常增加,这可能与根系是植物吸收养分和水分的主要器官,也是最先感受土壤逆境胁迫的重要部位,植物在逆境条件下往往通过改变其根系分布及形态来适应不利的生长环境有关[20].在环境胁迫条件下,由根系吸收及冠层合成的物质一般优先供应近源处器官生长需要,即当土壤中矿质营养或水分供应受限时,大部分营养物质或水分用于根系生长[21].因此,根质量的变化可能是玉米地下部分对加拿大蓬化感物质浓度变化的响应,但是造成这种差异的影响还需要进一步的研究.
3 讨论与结论
根据本文的研究,加拿大蓬水溶性物质对受体玉米的生长发育产生了不良影响,经其处理后,玉米有矮化、弱化的趋势,生物量积累受阻,单株减产27.46%以上.综合分析受试玉米叶片的结构参数和气体交换参数后推测,上述现象与植株的光合能力下降有关.首先,叶面积及光合色素含量与叶片光合能力密切相关,本研究结果显示加拿大蓬水溶性化感物质处理后,受体玉米叶面积减小了12.58%以上,叶绿素a含量降低,且与对照差异显著.其次,吐丝期、灌浆期玉米净光合速率明显下降.气孔导度是单位时间内单位面积气孔的水汽蒸腾量,气孔导度越大,代表气孔开张程度越大,气孔的开张直接影响到 CO2和水汽进出气孔的速率[22].Einbhlling 等[23]的研究结果显示,化感物质阿魏酸、咖啡酸和香草醛等可通过降低叶片的气孔导度、叶绿素含量和光合作用来抑制大豆和高粱的生长.本试验发现经加拿大蓬水提液处理后,玉米净光合速率下降,且叶片的气孔导度、蒸腾速率变化趋势与净光合速率变化趋势一致,说明水汽、CO2进出气孔受阻是导致了净光合速率降低的主要原因.由此可见,加拿大蓬水溶性化感物质是通过影响玉米的相关光合单位,造成了一系列的生理变化,最终导致了玉米生物量的合成受阻.
进一步分析玉米光合产物在各个部位之间的分配显示,0.050 g/mL加拿大蓬水提液处理下,玉米的根质量增加,其占比接近总体生物量的50%,穗质量比下降了5.32%,其总生物量的增加主要来源于根质量的增加,根冠比达到0.95,为对照的147.20%.玉米吐丝后进行生殖生长,随着灌浆的进一步进行,体内的碳水化合物逐渐由主要的源器官运输到库器官——穗进行储藏[24].因此,在植物吐丝期至成熟期,光合产物主要供给用于后代繁殖的子实部分.但经加拿大蓬水提液处理后,玉米光合产物更多的分配到了根部,穗质量减小,籽粒灌浆不足直接导致了玉米产量的降低,如上述情况发生在制种田,则会直接导致玉米种子质量的下降,其对产量的影响将更加深远.
越来越多的研究表明,植物的化感作用与植物的养分关系密切.曾任森等[25]研究显示,当植物附近的营养增加时,日本曲霉化感作用显著增强[25].而随着营养水平的降低,胜红蓟挥发油的化感作用呈上升趋势[26].中肋骨条藻在磷限制的条件下对东海原甲藻的生长有较明显的促进作用[27].本试验中发现高浓度加拿大蓬水提液处理下玉米根质量等指标也出现了上升的现象.
目前化感作用机理及其分子基础并不是很清楚,但从现有的资料来看化感作用几乎能影响植物生理生化的每一个方面,大多数化感物质可影响植物的细胞膜、能量产生和能量使用过程,少部分化感物质只影响某一特定酶步骤,从而干扰植物的一些高级代谢过程和生长调节系统[28].本试验以盆栽法研究了加拿大蓬水溶性物质对玉米成株的化感作用,与大田试验还存在一定的差距,入侵种加拿大蓬对玉米危害程度以及其他可能的作用机制还需要进一步的试验来加以确证.
[1]SALA O E,CHAPIN F S,ARMESTO J J,et al.Biodi-versity-global biodiversity scenarios for the year 2100[J].Science,2000,287:1770-1774.
[2]CROOKS JA. Characterizingecosystem-levelconsequences of biological invasions:The role of ecosystem engineers[J].Oikos,2002,97:153-166.
[3]徐汝梅,叶万辉.生物入侵:理论与实践[M].北京:科学出版社,2004:1-84.
[4]刘绍芹,吕国忠.豚草及豚草的综合治理[J].西北农林科技大学学报:自然科学版,2005,33(增刊):237-242.
[5]张金良,杨维华,张香云,等.北京地区三裂叶豚草封锁除治技术应用[J].植物检疫,1997,11(5):265-268.
[6]王大力,祝心如.三裂叶豚草的化感作用研究[J].植物生态学报,1996,20(4):330-337.
[7]GALINDO J,HERNANDEZ A,DAYAN F E,et al.Dehydrozaluzanin C,a natural sesquiter penolide,causes rapid plasma membrane leakage[J].Phytochemistry,1999,52(5):805-813.
[8]BOOKER F L,BLUM U,FISCUS E L.Short-term effects of ferulic acid onion uptake and water relations incucumber seedlings[J].Journal of Experimental Botany,1992,43(5):649-655.
[9]LEHMAN M E,BLUM U,GERIG T M.Simultaneous effects of ferulic and p-coumaric acids on cucumber leaf expansion in split-root experiments[J].J Chem Ecol,1994,20(7):1773-1782.
[10]PENUELAS J,RIBAS-CARBO M,GILES L.Effects of allelochemicals on plant respiration and oxygen isotope fractionation by the alternative oxidase[J].J Chem Ecol,1996,22(4):801-805.
[11]BAZIRAMAKENGA R,LEROUX G D,SIMARD R R.Effects of benzoic and cinnamic acid on growth,mineral composition and chlorophyll content of soybean[J].J Chem Ecol,1994,20(11):2821-2833.
[12]高兴祥,李美,于建垒,等.小飞蓬提取物除草活性的生物测定[J].植物资源与环境学报,2006,15(1):18-21.
[13]李斌,王咏,何春光.长春地区外来植物的初步研究[J].长春师范学院学报:自然科学版,2007,26(5):85-88.
[14]BERES I,KAZINCZI G.Allelopathic effects of shoot extracts and residues of weeds on field crops[J].Allelopathy Journal,2000,7(1):93-98.
[15]张治安,张美善.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004:43.
[16]林植芳,李双顺.衰老叶片的叶绿体中H2O2的积累与膜脂过氧化的关系[J].植物生理学报,1988,14(4):16-22.
[17]SHIMAZAKI K,SAKAKI T,KONDO N.Active oxygen participationin chlorophyll destruction and lipid peroxidation in SO2fumigated leaves of spinach[J].Plant Cell Physiol,1980,21:1193-1204.
[18]胡丁猛,王太明,于金星,等.SO2胁迫下11个园林绿化树种光合色素含量的变化[J].山东林业科技,2007(1):19-22.
[19]MOLL R H,JAEKWON W A,MIKKELSEN R I.Recurrent selection for maize grain yield:Dry matter and nitrogen accumulation and partitioning changes[J].Crop Sci,1994,34:874-888.
[20]刘莹,盖钧益,吕慧能.作物根系形态与非生物胁迫耐性关系的研究进展[J].植物遗传资源学报,2003,4(3):265-269.
[21]TROUGHTON A.The rate of growth and partitioning of assimilates in young grass:a mathematical model[J].Annals of Botan,1977,41:553-565.
[22]刘长利,王文全,崔俊茹,等.干旱胁迫对甘草光合特性与生物量分配的影响[J].中国沙漠,2006,26(1):340-343.
[23]EINBHLLING F A,RASMUSSEN J A,SCHON M K.Effects of three phenolic acids on chlorophyll content and growth of soybean and grain sorghum seedlings[J].J Chem Ecol,1979,5(5):425-436.
[24]梁引库.不同源库比玉米衰老期间体内营养物质的变化及其对衰老的影响[D].陕西:西北农林科技大学图书馆,2006.
[25]曾任森,骆世明,石木标.营养和环境条件对日本曲霉化感作用的影响[J].华南农业大学学报:自然科学版,2003,24(1):42-46.
[26]徐涛,孔垂华,胡飞.胜红蓟化感作用研究:Ⅲ:挥发油对不同营养水平下植物的化感作用[J].应用生态学报,1999,10(6):748-750.
[27]赵卫红,陈玫玫.营养盐限制对中肋骨条藻产生化感作用的影响[J].海洋环境科学,2010,29(2):221-228.
[28]EINHELLING F A.Mechanism of action of allelochemicals in allelopathy[J].ACS Symp Sci,1995,582:96-116.
——以渤海S油田为例

