中链脂肪酸-维生素C冻干脂质体的制备研究
杨水兵,刘 伟,刘成梅,刘玮琳,郑会娟,周 伟,阴婷婷
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
中链脂肪酸-维生素C冻干脂质体的制备研究
杨水兵,刘 伟,刘成梅*,刘玮琳,郑会娟,周 伟,阴婷婷
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
以脂溶性药物中链脂肪酸(MCFAs)和水溶性药物维生素C(Vit.C)为模型药物,采用复乳-高压法制备中链脂肪酸-维生素C复方脂质体,并用冷冻干燥技术制备成固体脂质体。通过研究脂质体的形态、粒径分布和包封率,对预冻温度、预冻时间、干燥时间、适宜的冻干保护剂种类、冻干保护剂与卵磷脂的质量比分别进行单因素考察。优选脂质体适宜的预冻温度为-80℃,预冻时间为5h,总干燥时间48h,适宜的冻干保护剂为蔗糖,蔗糖与卵磷脂的质量比为1.5∶1。最优冻干工艺条件下制得的中链脂肪酸-维生素C复合脂质体的维生素C包封率为62.25%,MCFAs包封率为46.30%,平均粒径为115.5nm。并考察了复方脂质体冻干前后粒径、Zeta电位、颗粒形态变化,发现粒径和Zeta电位变化不大,表明复方脂质体具有较好的物理稳定性。
中链脂肪酸,维生素C,复方脂质体,复乳法,高压微射流法
1 材料与方法
1.1 材料与仪器
大豆卵磷脂 PC,北京美亚斯磷脂技术有限公司;胆固醇 分析纯,北京奥博星生物技术责任有限公司;中链脂肪酸 辛酸与癸酸总含量>96%,美国进口分装;正已烷 色谱级,纯度>97%,天津市大茂化学试剂厂;维生素C、固蓝B盐 分析纯,国药集团化学试剂有限公司;吐温-80 分析纯,上海申字医药化工有限公司;无水乙醇、蔗糖、葡萄糖、甘露醇、维生素E等 均为分析纯。
NCJJ 0.2/150纳米超高压均质机 廊坊通用机械有限公司;6890N气相色谱仪 美国Agilent公司; RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;Zeta Potential/Partical Sizer Nicomp/380 ZLS超细微粒粒度分析仪 Santa barbara,California,USA;H-600透射电镜 日本日立公司;T6紫外-可见分光光度计北京普析通用仪器有限公司;Forma-86c超低温冰箱 美国Thermo Electron公司;Labconco FreeZone真空冷冻干燥机 美国LABCONCO公司。
1.2 实验方法
1.2.1 中链脂肪酸-维生素C(MCFAs-Vit.C)复方冻干脂质体的制备工艺[14-15]分别称取一定量的大豆卵磷脂、胆固醇、维生素E(Vit.E)和MCFAs,在55℃水浴下溶解于适量的乙醇中,加入适量蒸馏水,然后旋转蒸发除去部分乙醇,形成油相。配制一定浓度的Vit.C溶液,将其加入油相,在减压的条件下旋转洗膜20min,得到复方脂质体。将粗脂质分散体加入到超高压均质机中,在一定的压力条件下超微乳化处理2次后。加入适量冷冻保护剂后,将脂质体混悬液冻结,再置于冷冻干燥机内干燥约48h,使样品中残余水分含量低于5%,冻干后的样品置干燥器中室温避光密闭保存。冻干脂质体粉末加入蒸馏水至冻干前的体积,充分溶解即得重建脂质体。复乳-高压法制备MCFAs-Vit.C复方冻干脂质体的工艺流程如图1。
1.2.2 MCFAs-Vit.C复方冻干脂质体冻干工艺优化
1.2.2.1 预冻温度的选择 选用两个预冻温度,分别为-20℃和-80℃,按相同的处方和相同的制备条件制得复方脂质体,对产品的外观、复水性、药物包封率进行检测。

图1 复乳-高压法制备复方冻干脂质体的工艺流程图
1.2.2.2 冷冻干燥预冻时间的选择 本实验中选三个预冻时间,按相同的处方和相同的制备条件制得液体脂质体分成三份,分别预冻3、6、9h,再通过冷冻干燥制得冻干脂质体,考察预冻时间的影响。
1.2.2.3 干燥时间的选择 在真空度为10Pa,预冻温度-80℃下,以冻干脂质体外观和药物包封率作为指标考察了干燥时间(24、36、48、60h)对冻干脂质体的影响。
1.2.2.4 冻干保护剂种类和用量的确定 a.冻干保护剂的筛选:本实验按大豆卵磷脂与保护剂质量比1∶2内加固定,对冻干保护剂的种类进行了筛选。同时以不加任何冻干保护剂的脂质体冻干品作为对照。以冻干制品的外观、复水性、粒径、包封率为评价指标,考察了各种保护剂(蔗糖、葡萄糖、甘露醇)对冻干制品的保护作用。b.冻干保护剂用量的确定:按蔗糖与大豆卵磷脂的质量比分别为0.5∶1、1.0∶1、1.5∶1、2.0∶1、2.5∶1,以内加的方式在脂质体悬浮液中加入蔗糖,以冻干产品的外观、药物包封率和水化后粒径为评价指标,考察了蔗糖用量对冻干制品的保护作用。
1.2.3 MCFAs-Vit.C复合脂质体的性质测定
1.2.3.1 MCFAs包封率测定 取重建后的冻干脂质体10mL置于已处理过的透析袋(cut off 8000~14000)中,封口,将其置于烧杯中,于室温下透析12h。取出1mL透析内液,采用气相色谱法[16-17]测量MCFAs含量,计算出包封的MCFAs含量,从而计算出MCFAs的包封率。包封率按下式计算:
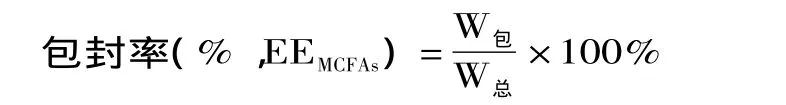
式中:W包、W总分别表示包封于脂质体的药量及投药量。
1.2.3.2 维生素C(Vit.C)包封率测定(透析-分光光度法) 取重建后的冻干脂质体10mL置于已处理过的透析袋(cut off 8000~14000)中,封口,将其置于烧杯中,于室温下透析9h。取出1mL透析内液,测定波长420nm处的吸光度,代入标准曲线计算出包封的Vit.C含量,从而计算出Vit.C的包封率[18]。包封率计算公式如下:
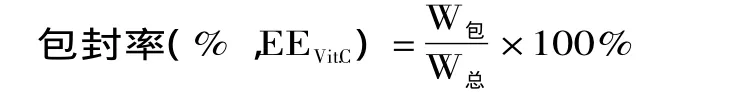
式中:W包、W总分别表示包封于脂质体的药量及投药量。
1.2.3.3 脂质体的粒径和Zeta电位测定[2]将复方脂质体以蒸馏水稀释后,用NICOMP380/ZLS激光纳米粒度分析仪测定其Zeta电位、粒径及粒径分布。测试角度90°,测试温度为(25±0.1)℃,测试光波长为632.8nm。
1.2.3.4 脂质体的显微形态观察[19-20]将复方脂质体冻干粉加水复溶,以水适当稀释后,置于铜网上,自然晾干,用透射电镜观察脂质体外观形态。

表1 预冻温度对复方冻干脂质体质量的影响

表2 预冻时间对复方冻干脂质体质量的影响

表3 干燥时间对复方冻干脂质体的影响
1.2.3.5 差示扫描量热分析[21-22]取8.0~10.0mg待测样品放入铝质样品盘中,另放一空盘为参照。在氮气环境下扫描,扫描温度范围20~200℃,升温速率10℃/min,氮气流量50mL/min。
2 结果与分析
2.1 MCFAs-Vit.C复方冻干脂质体冻干工艺优化
2.1.1 预冻温度的考察 对于易结晶的样品而言,预冻温度应低于脂质体的最低共熔点温度,否则样品冻结不实,会引起药液喷瓶。实验表明,在预冻时间(6h)及其他条件均相同的情况下,不同的预冻温度得到的冻干产品有区别,本文考察了不同预冻温度(-20℃和-80℃)对冻干产品的影响,结果如表1。
从表1中可以看出,-80℃预冻温度制得的脂质体的药物包封率大大高于-20℃预冻温度下制得的脂质体,外观和复水性也均较好。可能因为-20℃预冻温度高于一般脂质体的玻璃化转变温度,在预冻时不能形成玻璃态,致使预冻时产生较多结晶而破坏脂质膜,大大降低了包封率。所以应该选择-80℃作为预冻的温度,以保证样品冻实。
2.1.2 预冻时间的考察 适当的预冻时间能确保抽真空之前所有样品均已冻实,不致因抽真空而喷出。有研究表明,根据预冻物料的性质,一般预冻时间都需要3~4h才能冻结完全。本实验中选三个预冻时间,按相同的处方相同的制备条件制得液体脂质体分成三份,分别预冻3、5、7h,再冷冻干燥得到冻干脂质体。结果如表2所示。
由表2可知,当预冻3h时,冻干脂质体外观较差,复水性也不好,中链脂肪酸和维生素C的包封率较低,并且样品容易喷出,而预冻5h和7h的冻干脂质体外观均平整饱满,复水性良好,中链脂肪酸和维生素C的包封率较高,且无显著差异。在保证样品能冻实的前提下,从缩短实验周期和经济成本角度考虑,最终选择预冻时间为5h。
2.1.3 干燥时间的考察 为了保证冻干产品有尽量低的含水量,提高长期稳定性,必须有足够的干燥时间。在真空度为10Pa,预冻温度-80℃下,同批脂质体(加入蔗糖保护剂预冻5h),考察了不同干燥时间(24、36、48、60h)对冻干产品的影响。
如表3所示,干燥时间对冻干产品质量有较大的影响。当干燥时间为24h时,样品明显具有相对较高的水分含量,且外观较差,复水难,药物的包封率较低。随着干燥时间的增加,外观和复水性都能得到改善,维生素C和中链脂肪酸的包封率得到极大地提高。当干燥时间达到48h时,冻干脂质体具有较好的复水性和外观,此时维生素C和中链脂肪酸的包封率分别从32.86%增加到55.85%,21.52%增加到46.12%。48h以后产品外观和包封率等无显著差别。因此综合考虑,最终确定48h作为适宜的干燥时间。
2.1.4 冻干保护剂的种类和用量的确定
2.1.4.1 冻干保护剂的筛选 对于脂质体的冻干,一般用糖类物质作保护剂[23]。不同种类和不同浓度的糖类保护剂对冻结过程中脂质体的保护效果不同。冻干保护剂主要为糖类,包括乳糖、蔗糖、麦芽糖、海藻糖(均为二糖)、葡萄糖(单糖),另有醇类,包括甘露醇、山梨醇[24-25]。选择糖/醇类作为冻干保护剂,是由其结构(含羟基,易与磷脂基团间形成氢键)和物理性质(易于玻璃化)所决定的。其中公认保护效果最好的是海藻糖。但是由于海藻糖价格较高,实验中没有使用海藻糖作为冻干保护剂。本文按固定大豆卵磷脂与保护剂质量比1∶2内加冻干保护剂,对冻干保护剂的种类进行了筛选。同时以不加任何冻干保护剂的脂质体冻干品作为对照。以冻干制品的外观、复水性、粒径、以及药物包封率为评价指标,研究各种保护剂对复方冻干脂质体的保护作用。
从表4可以看出,加入冻干保护剂后,产品质量得到一定的提高。即冻干品既可以维持原体积,不塌陷,表面光洁,可整块脱落又具有较高的包封率。蔗糖是容易形成无定形的保护剂,可以使冻干制品得到很好的微观形态[26]。其次是甘露醇,葡萄糖的效果最差。原因可能与保护剂的化学结构和物理特性有关,如糖类保护剂中羟基的数量、保护剂的粘度都可能影响脂质体囊泡的粒径。其中低聚糖中的双糖保护作用最强。葡萄糖具有还原性,高温下这些糖可与蛋白质活性部位的氨基酸残基发生羰氨反应,使蛋白质变性失活,故保护作用有时较差[27]。Tanaka[28]研究了多元醇对冻干保护作用的效果,结果表明,多元醇的冻干保护作用均比二糖差。因此,本文考虑将蔗糖作为冻干保护剂以达到满意的包封率及外观效果。

表4 不同冻干保护剂对复方冻干脂质体质量的影响
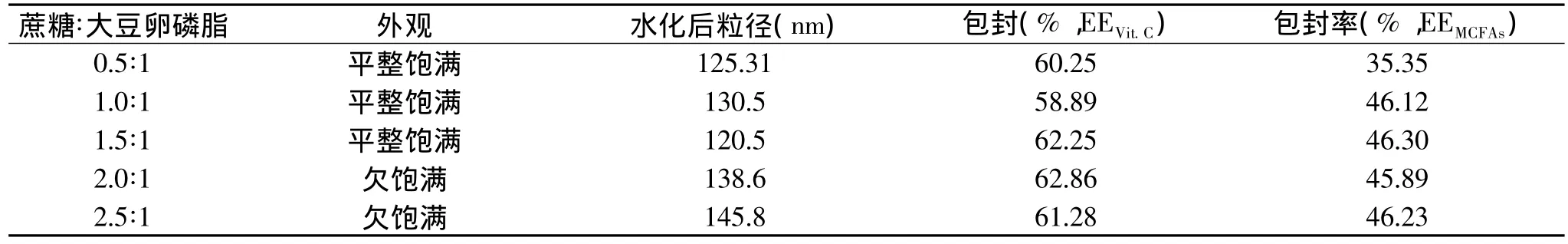
表5 蔗糖与大豆卵磷脂的比对复方脂质体冻干品质量的影响
2.1.4.2 冻干保护剂用量的确定 冻干保护剂以分子形式与卵磷脂作用,因此其保护作用决定于其与卵磷脂的比例,而不是单纯的保护剂的浓度,这是良好的冻干保护剂处方的关键。本文按卵磷脂与保护剂的质量比对保护剂的量进行了考察。对于保护脂质体微观结构来说,蔗糖的保护作用要比甘露醇更强一些。在无甘露醇的情况下,单独使用一定量的蔗糖,亦能获得粒径基本不变的脂质体冻干产品。只是不能很好地保证冻干品的外观,同时稳定性也不满足要求。实验中以内加的方式,考察蔗糖与大豆卵磷脂质量比分别为0.5∶1、1.0∶1、1.5∶1、2.0∶1、2.5∶1时对冻干品的影响。
一定量蔗糖作为冻干保护剂所得冻干品重建后脂质体粒径基本上仍然保持了冻干前的粒径和药物的包封率,其中蔗糖与磷脂比例1.5∶1时,既能保护脂质体的粒子形态无变化又能保护被包封脂肪酸不会析出,外观也很好,中链脂肪酸和维生素C包封率均较高。蔗糖比例再小则不能完全保护脂质体内包封药物,有脂肪酸的析出,蔗糖比例过大则产品外观又会变差。所以最后确定冻干保护剂与卵磷脂的比例为1.5∶1,即蔗糖∶大豆卵磷脂为1.5∶1。
2.2 MCFAs-Vit.C复方冻干脂质体性质测定
2.2.1 冻干前后粒径及粒度分布 室温条件下,取复方脂质体混悬液适量加水稀释到一定浓度,用Zeta Potential/Partical Sizer NICOMP 380/ZLS纳米粒度分析仪测得冻干前后复方脂质体平均粒径。
冻干前脂质体平均粒径为98.3nm,粒度分布如图2所示,重建后的脂质体平均粒径为115.5nm,粒度分布如图3所示,结果表明冻干后粒径稍有增大,但是复水前后脂质体的粒度分布都比较均匀,粒径较小并且分布范围窄。和我们前期关于中链脂肪酸冻干脂质体的研究[15]的结果相符,冻干过程中,冻干保护剂、冻干时间和脂质体粒径等都可能对脂质体的粒径分布有较大影响。
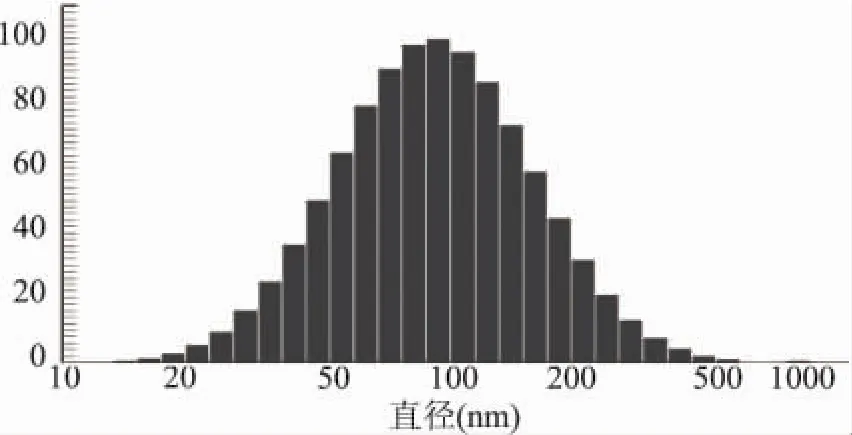
图2 复方脂质体冻干前粒度分布
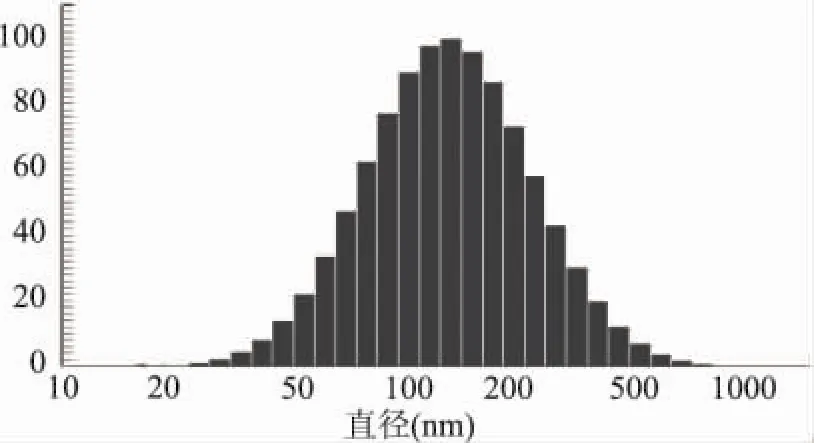
图3 复方脂质体冻干后粒度分布
2.2.2 冻干前后形态的变化 在透射电镜下观察冻干前和重建后的脂质体的外观形态。
在透射电镜下观察冻干前和重建后的脂质体的外观形态,如图4和图5所示,可见冻干前和重建后的脂质体为分散个体且呈球形或椭圆形。冻干前脂质体的粒度较小,比较圆整,分布均匀;冻干后脂质体的平均粒径略有增加。

图4 冻干前复方脂质体电镜图(×12000)
2.2.3 冻干前后复方脂质体包封率和Zeta电位的测定 脂质体冻干前后的粒径变化和对药物的包封率的变化,是衡量冻干过程优劣的两个重要指标。如果脂质体粒径经冻干后增大了,说明在冻干过程中脂质体囊泡发生融合现象,以致包封药物发生了泄漏;如果药物包封率经冻干后减少了,也说明在冻干过程中脂质体囊泡发生破裂现象。考察冻干过程对包封率的影响。最佳冻干工艺制备的复方脂质体的维生素 C和中链脂肪酸包封率分别为61.37%、44.26%,与冻干前包封率62.39%、46.28%相比稍有降低,差别不大,表明冻干后脂质体仍保留了脂质体悬液的理化性质。
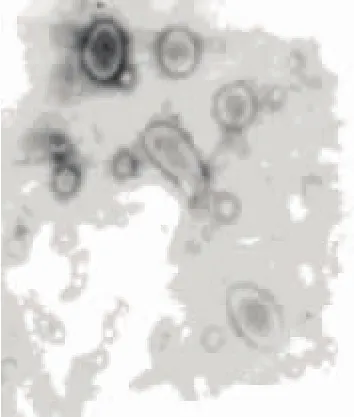
图5 冻干后复方脂质体电镜图(×25000)
室温条件下,取复方脂质体混悬液适量加水稀释到一定浓度,用纳米粒度分析仪分别测定复方脂质体混悬液和冻干品重建后的Zeta电位。结果表明,制得的复方脂质体表面荷负电,冻干复水之后其Zeta电位绝对值略有降低,冻干前与冻干复水后的脂质体的Zeta电位分别为-25.43、-25.72mV,也表明冻干脂质体具有良好的稳定性。
2.2.4 差示扫描量热分析 脂质体双层膜的物理性质和温度有较大关系。当温度升高时,脂质双分子层中酰基侧链从有序排列变为无序排列,这种变化引起脂膜的物理性质一系列变化,可由“胶晶态”变为“液晶态”,膜的横切面增加,双分子层厚度减小,膜流动性增加,这种转变时的温度称为相变温度(Tm)。因此,可用DSC分析测定脂质体膜的Tm值,当达到Tm时,膜的流动性增加,被包裹的药物具有最大释放速率,因而膜的流动性直接影响脂质体的稳定性,从而影响脂质体的药用载体性质。大豆卵磷脂和复方脂质体的相变曲线如图6和图7所示。
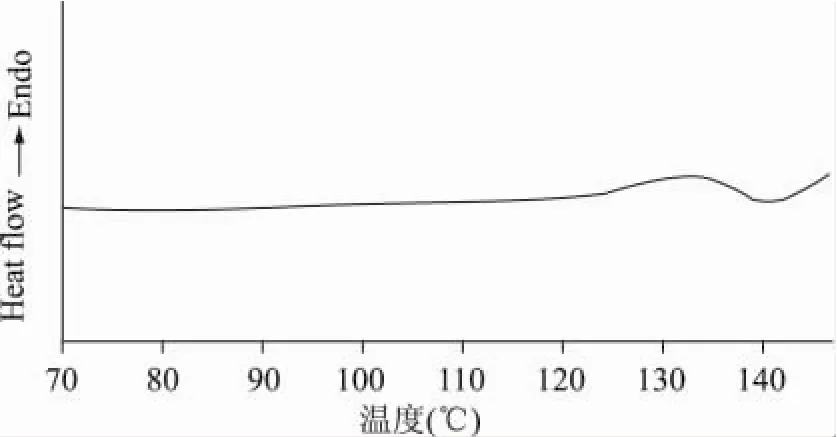
图6 大豆卵磷脂的相变图
从图6和图7可以看出,卵磷脂以及复方脂质体的Tm分别为130℃、136.08℃。由结果可知,将磷脂制备成复方脂质体后,Tm升高了,原因可能是胆固醇增加了磷脂双分子层膜的刚性,降低了膜的流动性,从而升高了Tm值,膜的稳定性增加,药物更稳定地包裹于磷脂双层膜中,与Zeta电位的结论相符合。
3 结论
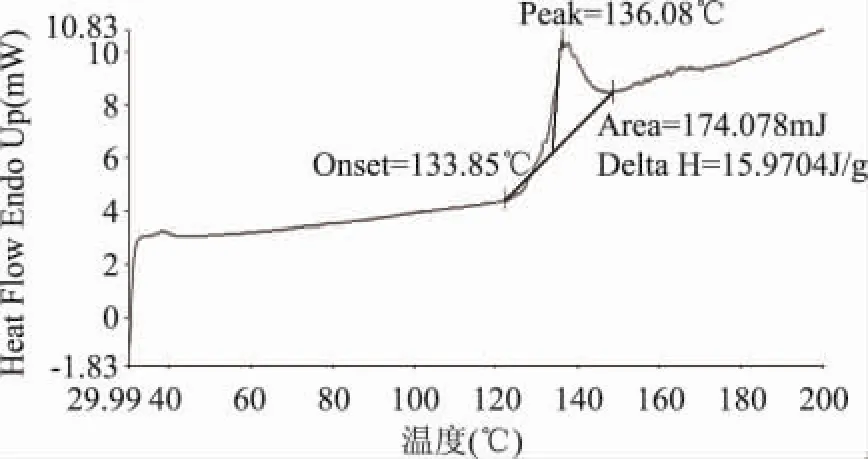
图7 复乳-高压法制备的复方脂质体相变图注:Onset=133.85℃,Peak=136.08℃,Area=174.078mJ,Delta H=15.9704J/g。
本文考察了中链脂肪酸-维生素C复方脂质体的冷冻干燥工艺,结合实验条件,对预冻温度、预冻时间、干燥时间、不同冻干保护剂种类(蔗糖,葡萄糖,甘露醇)、蔗糖的用量进行了考察,并以样品的外观、水化后粒径、包封率等为考察指标,确定了最佳冻干工艺。结果表明,预冻时间5h,预冻温度为-80℃,冷冻干燥48h,较优的冻干保护剂为蔗糖,蔗糖与大豆卵磷脂比为1.5∶1,所得冻干产品外观饱满致密、平滑、紧实,再分散性较好,粒子形态也保护的比较好,能基本保持冻干前的各项理化指标。并对复方脂质体的DSC曲线进行了分析,结果发现脂质体具有良好的稳定性。
[1]Marten B,Pfeuffer M,Schrezenmeir J.Medium-chain triglycerides[J].Int Dairy J,2006,16(11):1374-1382.
[2]Liu W,Liu W L,Liu C M,et al.Medium-chain fatty acid nanoliposomes for easy energy supply[J].Nutrition,2011,27:700 -706.
[3]刘伟,刘玮琳,刘成梅,等.高压微射流制备纳米中链脂肪酸脂质体的研究[J].高压物理学报,2010,24(4):293-299.
[4]Brouns F,Van der Vusse G J.Utilization of lipids during exercise in human subjects:Metabolic and dietary constraints[J].Brit J Nutr,1998,79:117-128.
[5]蔡呈芳.皮肤美白化妆品的进展[J].临床皮肤科杂志,2004,33(6):386-387.
[6]彭景.烹饪营养学[M].北京:中国纺织出版社,2008.
[7]张文晔,宋树豪.VC的代谢与功能及其在家禽生产上的应用[J].饲料工业,2010,31(6):4-6.
[8]Gamez-Hens A,Fernadez-Romero J M.Analytical methods for the control of liposomal delivery system[J].Trends Anal Chem,2006,25(2):167-178.
[9]Pupo E,Padron A,Santana E,et al.Preparation of plasmid DNA-containing liposomes using a high-pressure homogenization -extrusion technique[J].J Control Release,2005,104(2): 379-396.
[10]熊非,朱家璧,汪豪,等.灯盏花素前体纳米脂质体的质量评价[J].中国药科大学学报,2004,35(6):513-516.
[11]吴亚妮,徐云龙,孙文晓.木瓜蛋白酶纳米脂质体的制备及其粒度控制[J].上海交通大学学报:农业科学版,2007,25 (2):1052-1091.
[12]张小宁,张郁,姬海红,等.微射流法制备莪术油纳米脂质体的研究[J].中国药学杂志,2004,39(5):356-358.
[13]杨明华,刘建平,黄文兰.丹参酮前体脂质体的研制[J].药学进展,2004,28(6):267-271.
[14]Hombreiro-Pe'rez M,Zinutti C,Lamprecht A,et al.The preparation and evaluation of poly([epsilon]-caprolactone) microparticles containing both a lipophilic and a hydrophilic drug[J].J Control Release,2000,65:429-438.
[15]Liu C M,Yang S B,Liu W,et al.Preparation and characterization ofmedium-chain fatty acid liposomesby lyophilization[J].J Liposome Res,2010,20(3):183-190.
[16]郑会娟,刘成梅,刘伟,等.中链脂肪酸脂质体的制备及其性质测定[J].食品科学,2010,31(22):170-175.
[17]刘成梅,王瑞莲,刘伟,等.中链脂肪酸脂质体的制备及其特性评价[J].食品科学,2007,28(10):143-146.
[18]杨水兵,刘成梅,刘伟.VC脂质体的制备与稳定性测定[J].食品科学,2010,31(20):230-234.
[19]Sakai K,Tomizawa H,Tsuchiya K,et al.Characterizing the structural transition of cationic DPPC liposomes from the approach of TEM,SAXS and AFM measurements[J].Colloid Surface B,2008,67(1):73-78.
[20]MüllerM,Mackeben S,C Müller-Goymann C. Physicochemical characterisation of liposomes with encapsulated local anaesthetics[J].Int J Pharm,2004,274(1-2):139-148.
[21]Oszlánczi A,Bóta A,Gábor Czabai,et al.Structural and calorimetrical studies of the effect of different aminoglycosides on DPPC liposomes[J].Colloid Surface B,2009,69(1):116-121.
[22]Budai M,Szab Zs,Szógyi M,et al.Molecular interactions between DPPC and morphine derivatives:a DSC and EPR study[J].Int J Pharm,2003,250(1):239-250.
[23]刘占杰,华泽钊,陶乐仁,等.脂质体悬浮液结晶对其冻干品质影响的研究[J].青岛海洋大学学报:自然科学版,2001,31(4):612-618.
[24]Crowe J H,Crowe L M.Factors affecting the stability of dry liposomes[J].Biochim Biophys Acta,1988,939:327-334.
[25]Mobley W C,Schreier H.Phase transition temperature reduction and glass formation in dehydroprotected lyophilized liposomes[J].J Control Release,1994,31(1):73-87.
[26]Castile J D,Taylor K M.Factors affecting the size distribution of liposomes produced by freeze-thaw extrusion[J].Int J Pharm,1999,188(1):87-95.
[27]张玉华,凌沛学,籍保平,等.糖类在生物活性物质冷冻干燥中的保护作用及其作用机制[J].中国生化药物杂志,2006 (4):247-249.
[28]Tanaka K,Takeda T,Fujii K,et al.Cryoprotective mechanism of saccharides on freeze-drying of liposome[J].Chem Pharm Bull,1992,40(1):1-5.
Study on preparation and characteristics of medium chain fatty acids-Vitamin C freeze-dried liposomes
YANG Shui-bing,LIU Wei,LIU Cheng-mei*,LIU Wei-lin,ZHENG Hui-juan,ZHOU Wei,YIN Ting-ting
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
The medium chain fatty acids-vitamin C(MCFAs-Vit.C)complex liposomes were prepared by double emulsion-high pressure microfluidization with lipophilic drugs medium chain fatty acids(MCFAs)and hydrophilic drug vitamin C(Vit.C)as the core material,and solid liposomes were further made by lyophilization.The effects of pre-freezing temperature,pre-freezing time,total freeze-dried time,types of lyoprotectant and the mass ratio of lyoprotectant to lecithin were investigated by taking liposomes shape,size distribution and drugs entrapment efficiency as indexes.The suitable preparation conditions of liposomes were as follows:pre-freezing temperature -80℃,pre-freezing time 5h,total freeze-dried time 48h,sucrose as suitable lyoprotectant,the ratio of sucrose to lecithin(w/w)1.5∶1.Under these conditions,the MCFAs-Vit.C complex liposome had 46.30%MCFAs encapsulation efficiency and 62.25%Vit.C encapsulation efficiency with a mean particle size of 115.5nm.In addition,the changes of particle size,Zeta potential and morphology of liposomes before and after lyophilization were studied.The results showed that the complex liposome had better physical stability with little changes in particle size and Zeta potential.
medium chainfattyacids;VitaminC;complexliposomes;doubleemulsion;highpressure microfluidization
TS201.2
B
1002-0306(2011)11-0244-06
中链脂肪酸(MCFAs)是碳原子数为8~10的饱和脂肪酸。与长链脂肪酸相比,MCFAs分子小,在小肠吸收后经门静脉进入线粒体进行β氧化,代谢速度快、效率高。可减少体内脂质蓄积,有防治肥胖的作用[1-2]。但MCFAs水溶性差,性质不稳定,过多摄入MCFAs易导致恶心及胃肠道的不适、刺激胆囊收缩素的分泌等症状[3-4]。维生素C(Vit.C)可合成黏多糖和胶原蛋白,减少自由基对皮肤的损害,延缓衰老,被广泛应用在化妆品中[5]。但 Vit.C性质不稳定,在储藏和加工过程中受热、见光易分解,导致其利用率显著降低[6-7]。脂质体的结构类似生物膜,能够携带亲水性、疏水性和两亲性物质,并能有效提高药物的吸收率和渗透性[8]。将MCFAs与Vit.C复合,既能提高MCFAs和Vit.C的利用度和稳定性,同时也能提高脂质体本身的稳定性。制备脂质体的常用方法有薄膜法、逆相蒸发法、复乳法、乙醇注入法、动态高压微射流(DHPM)等[9-12],这些方法只适用于包封水溶性或脂溶性的药物,目前对于制备同时包封水溶性和脂溶性药物的复合脂质体研究较少。而普通脂质体混悬液,在储存的过程中可能发生化学和物理变化,如磷脂氧化和水解;同时由于温度、光线等影响产生凝聚、融合、粒径变大等现象。为解决脂质体在贮存过程中稳定性的问题,将其进一步制成固体脂质体[13]。本文以大豆卵磷脂和胆固醇作为膜材,采用复乳-高压法制备MCFAs-Vit.C复合脂质体,再通过冷冻干燥技术制备冻干脂质体,并对其冻干工艺、水合重建前后的粒径和Zeta电位,形貌变化等进行研究,从而得到包封率高且稳定性良好的MCFAs-Vit.C复方冻干脂质体。
2011-08-25 *通讯联系人
杨水兵(1984-),男,在读博士研究生,研究方向:食物(含生物质)资源的开发与利用。
国家重点实验室目标导向项目(SKLF-MB-201004)。

