红树莓色素的纯化及成分初步鉴定
孙希云,刘 宁,吴朝霞,张 琦,孟宪军,*
(1.沈阳农业大学食品学院,辽宁沈阳110161;2.沈阳农业大学土地与环境学院,辽宁沈阳110161)
红树莓色素的纯化及成分初步鉴定
孙希云1,刘 宁2,吴朝霞1,张 琦1,孟宪军1,*
(1.沈阳农业大学食品学院,辽宁沈阳110161;2.沈阳农业大学土地与环境学院,辽宁沈阳110161)
以红树莓果实为原料提取天然色素,采用大孔树脂法对样品进行纯化,纯化后样品采用纸层析法分离,同时运用紫外可见光谱法和纸层析法对各组分进行了初步鉴定。结果表明:HPD-700大孔吸附树脂较适宜用于纯化红树莓色素,粗提液pH为2时吸附效果较好,以60%乙醇为洗脱液、洗脱体积为4BV、流速为0.6mL/min进行洗脱时,洗脱效果较好;通过纸层析分离出四个组分,初步鉴定分别为矢车菊-3-葡萄糖苷、矢车菊-3-芸香糖苷、矢车菊-3-槐糖苷和矢车菊-3-葡萄糖-芸香糖苷。
红树莓,色素,大孔树脂,紫外光谱,纸层析
1 材料与方法
1.1 材料与仪器
红树莓 采自沈阳农业大学园艺学院树莓园,品种为美红22;大孔吸附树脂 HPD-100、HPD-300、HPD-400、HPD-450、HPD-700,沧州宝恩化工有限公司;AB-8、DA-201、DM-301、S-8、X-5 南开大学化工厂;果胶酶(≥6万U/mL) 食品级,河南雅大科技有限公司;新华3号层析纸 国药集团化学试剂有限公司;盐酸、乙醇、正丁醇等试剂 均为分析纯。
电热恒温水浴锅 国华电器有限公司;电子天平 北京赛多利斯仪器系统有限公司;pH计 上海精密科学仪器有限公司;循环水式多用真空泵 郑州长城科工贸有限公司;紫外可见分光光度计 北京普析通用仪器有限责任公司;HL-2恒流泵、BSZ-100自动部分收集器、层析柱(2cm×30cm) 上海沪西分析仪器厂。
1.2 实验方法
1.2.1 工艺流程 红树莓色素提取→纯化(大孔树脂)→分离(纸层析法)→鉴定(纸层析法,紫外可见光谱法)
1.2.2 色素提取 精确称取300g红树莓原料,将原料加水定容到1000mL,然后在50℃的水浴锅中水浴60min提取,抽滤,加入100mg果胶酶,沉淀12h,抽滤,浓缩,得到粗提液。
1.2.3 色素纯化 首先进行树脂活化,通过静态吸附解析实验确定最适宜纯化树脂。通过动态吸附解析确定纯化的最适宜参数,同时得到纯化样品。
静态吸附解析:称取10种不同型号的树脂各2g,分别置于150mL的三角瓶中,加入50mL红树莓色素提取液,置于恒温振荡器中,30℃、120r/min振荡24h,使树脂达到吸附平衡,根据吸附前后在树莓色素最大吸收波长处溶液的吸光值(A512nm),计算吸附率。在滤除溶液后的树脂中加入30mL解吸剂,振荡至解吸达到平衡,测定解吸后溶液的吸光值(A512nm)。
吸附率(%)=(初始吸光值-吸附后吸光值)/初始吸光值×100%
解吸率(%)=解吸后吸光值/(初始吸光值-吸附后吸光值)×100%
动态吸附解析:调整粗提液的pH,上树脂柱进行吸附,当吸附平衡时,测流出液的吸光值,计算吸附率。考察不同pH条件下树莓色素粗提液吸附效果。查阅文献及初步预实验,确定影响大孔吸附树脂吸附解析的主要因素——乙醇浓度、洗脱体积和洗脱速度,设置不同水平,进行三因素三水平正交实验设计,筛选出树莓色素的最佳吸附解析条件。
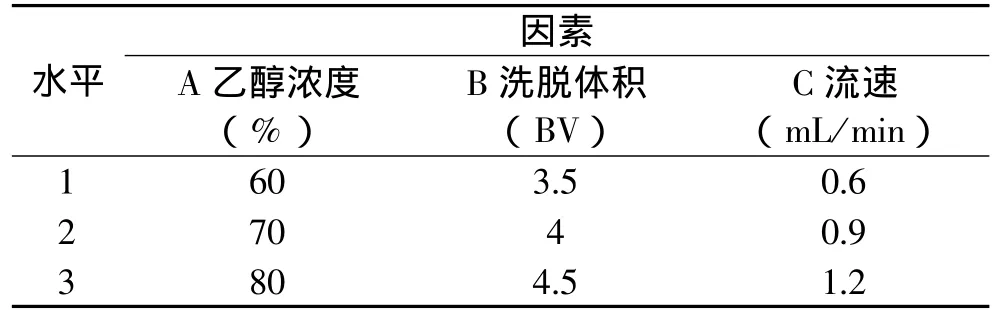
表1 L9(33)正交实验设计因素水平表
1.2.4 色素分离 在大孔树脂最佳吸附解吸条件下进行色素的纯化,纯化后提取液用纸层析法进行样品分离:在新华3号层析纸上,距长边2cm处画点样线,用毛细管点样,以BAW为展开液,用酸性甲醇液洗脱,即可分离得到样品[2]。
1.2.5 结构鉴定 主要采用紫外可见光谱法与纸层析法。
紫外可见光谱法通常用以下几种方法:a.花色苷最大吸收波长在可见光区的500~540nm附近,通过测定色素的最大吸收波长即可判断是否为花色苷类色素。b.如果向花色苷的0.01%盐酸甲醇溶液中滴加3~5滴AlCl3甲醇或乙醇溶液,出现蓝移,即最大吸收波长增加,说明B-环有邻位酚羟基,即可区分B-环无邻位酚羟基的天竺葵色素、芍药色素、锦葵色素和B-环有邻位酚羟基的矢车菊色素、牵牛花色素、飞燕草色素。c.根据花色苷最大吸收波长处的吸光度和440nm处的吸光度的比值A440/Amax,参考相关的文献,可以判断糖苷的位置。d.根据花色苷在300~330nm间有无吸收峰可判断该色素分子是否有酰基,如果有吸收峰,表明该色素有酰基存在。根据花色苷在紫外光下是否有荧光,可判断该色素是否在5号位有取代基,如果有荧光则表明该色素在5号位有取代基。
纸层析法展开剂:BAW(正丁醇-乙酸-水= 4∶1∶5)、BH(正丁醇-2mol/L盐酸=1∶1)、1%盐酸(浓盐酸-水=3∶97)、Bu-HCl(冰醋酸∶浓盐酸∶蒸馏水=15∶3∶82)[3]。
2 结果与分析
2.1 红树莓色素最大吸收波长的确定
在200~800nm下对红树莓色素提取溶液进行全波长扫描,结果如图1所示。
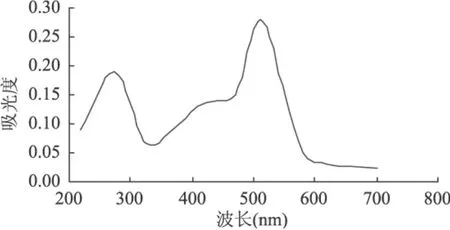
图1 红树莓色素紫外吸收光谱图
由图1可知,红树莓色素提取液在512nm下呈现明显的最大吸收峰,这与文献[4]报道较为接近,故确定红树莓色素的最大吸收波长为512nm。
2.2 大孔树脂纯化红树莓色素
2.2.1 最佳大孔吸附树脂的选择 实验所用的10种大孔吸附树脂的静态吸附率及解吸率见表2。
由表2可知,HPD-100、HPD-700、AB-8的吸附率均大于或等于89%,说明它们有很强的吸附能力;而HPD-300、S-8的吸附率分别为67%、61%,说明红树莓色素在这两种树脂上难以吸附。在解吸方面,S-8的解吸率大于70%,易于解吸;HPD-100、AB-8、DA-201、DM-301的解吸率不及35%,说明它们对于树莓色素的解吸效果不好。综合考虑,选择HPD-700进行后续实验。
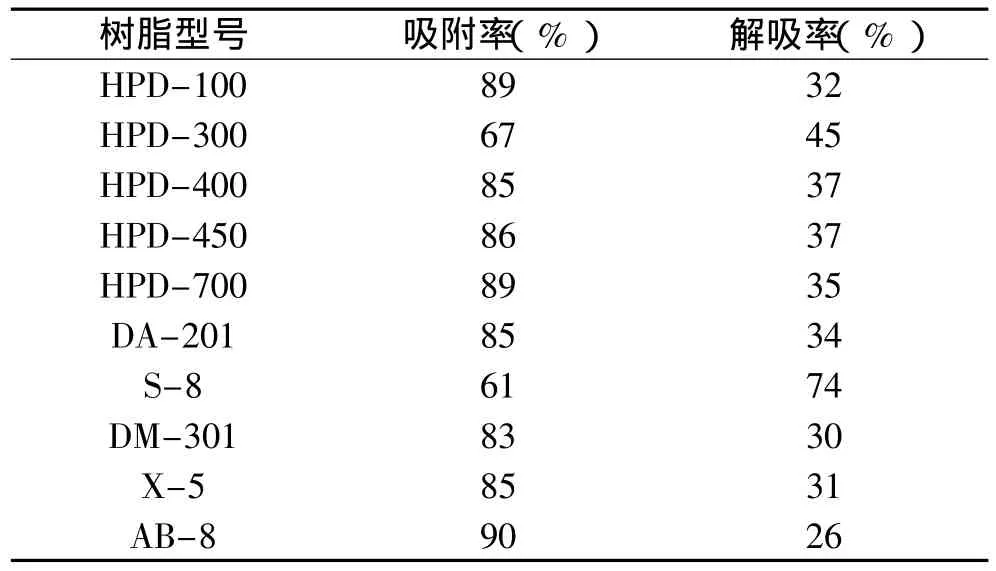
表2 10种大孔吸附树脂的静态吸附率及解吸率
2.2.2 pH对HPD-700树脂柱吸附效果的影响 在流速为1.2mL/min的条件下,用稀盐酸、氢氧化钠溶液调整红树莓色素粗提液的pH,考察pH为1、2、3、4、5、6、7时树脂对红树莓色素吸附效果,结果如图2所示。
考察不同pH条件下HPD-700树脂对红树莓色素吸附效果的影响,发现不同的pH对吸附效果的影响很大,在pH为2时,吸附率最大。这可能是由于红树莓色素分子结构中含有酚羟基,在较高的pH条件下增加了在水中的溶解度,从而降低了树脂在水溶液中对色素的吸附能力。而当pH为2时,吸附效果最好。
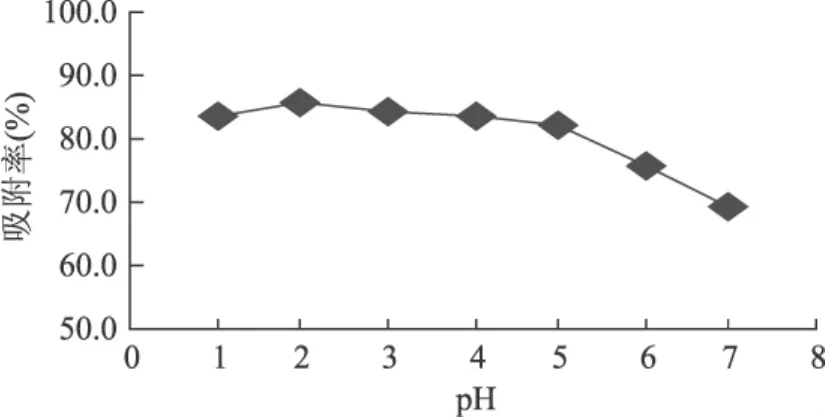
图2 pH对树脂吸附的影响
2.2.3 HPD-700大孔吸附树脂对树莓色素的解吸条件筛选 设定吸附条件为:流速为1.2mL/min、pH为2。吸附后,通过乙醇溶液的浓度、体积、流速进行三因素三水平的正交实验对解吸条件进行筛选,结果如表3所示。
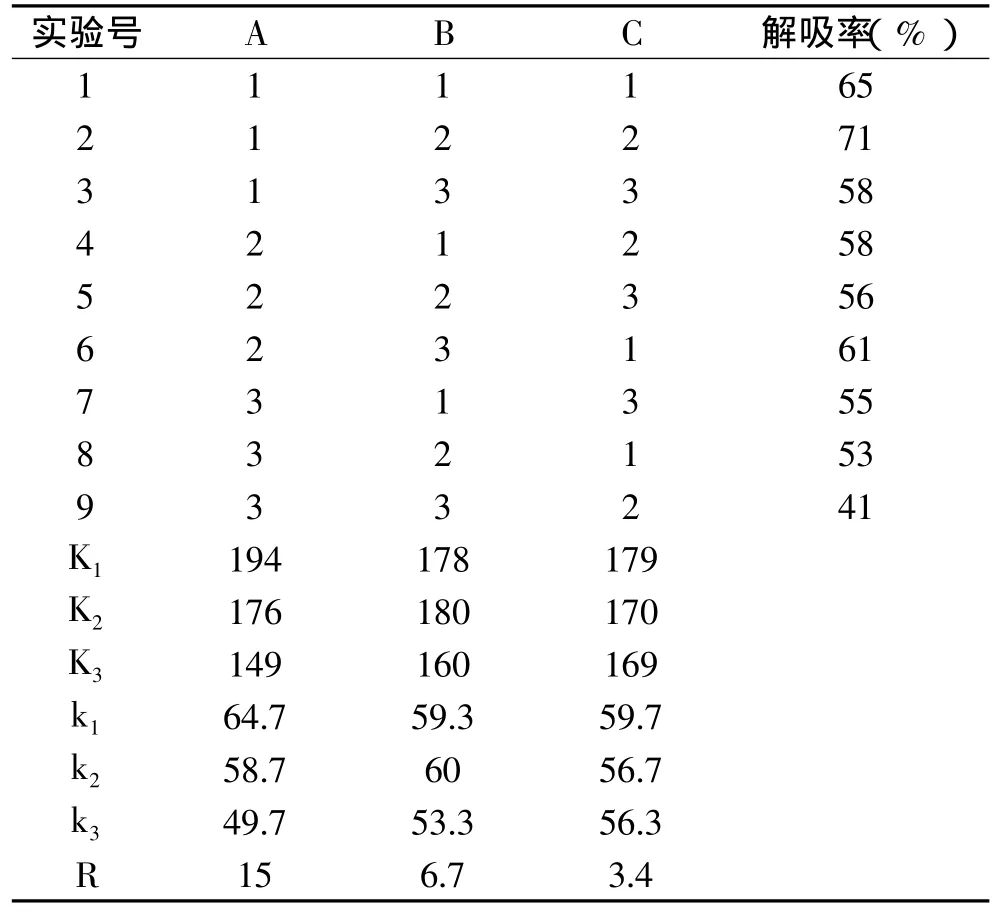
表3 正交实验结果分析
在所设计的9组实验中,第二组色素的解吸率最大,达71%。通过对正交表进行极差分析,得到各因素对HPD-700大孔吸附树脂动态解吸的影响力依次为:乙醇浓度>洗脱体积>流速;此实验条件下的最佳解吸条件:A1B2C1,即乙醇浓度60%,洗脱体积4BV,流速0.6mL/min,此组合不在上述9组实验之列。
2.2.4 最佳解吸条件验证实验结果 为进一步验证最佳解吸条件,进行最佳解吸条件即乙醇浓度60%,洗脱体积4BV,流速0.6mL/min条件下的重复实验,结果见表4。
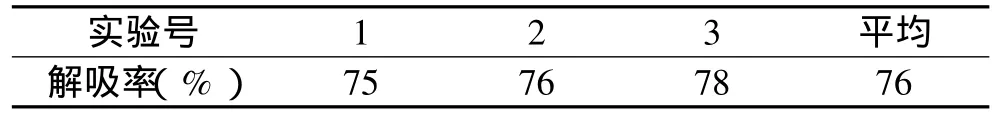
表4 最佳解吸条件验证结果
由表4可知,最佳解吸条件下,色素解吸率大于正交实验的9组数据,确为实验条件下的最佳解吸条件,故最终选择解吸条件为:A1B2C1,即以60%乙醇为洗脱液、乙醇体积为4BV、流速为0.6mL/min。
2.3 红树莓色素成分的分离
大孔树脂纯化后的红树莓色素提取液浓缩后经BAW溶液进行上行纸层析分离后,能明显分辨出4个斑点,且色斑呈桔红色,分开较清晰,由上而下编号为1号、2号、3号和4号。食品中6种主要红色素衍生物的颜色从桔红到紫红按结构顺序排列为天竺葵素、矢车菊素、芍药色素、锦葵素、牵牛花素和飞燕草素。因此,从色斑颜色看,1号到4号色素带可能是天竺葵素、矢车菊素或芍药色素的衍生物。
2.4 红树莓色素成分的初步鉴定
2.4.1 紫外-可见光光谱数据比较 向制得的4个纯样色素组的0.01%盐酸甲醇溶液中滴加3~5滴AlCl3甲醇溶液,都出现红移现象,说明B-环有邻位酚羟基,且位移波长非常接近,所以可判断四组色素均可能为矢车菊素衍生物,结果如表5所示。

表5 AlCl3作用前后!man红移情况
根据花色苷440nm处的吸光度和最大吸收波长处的吸光度的比值A440/Amax,结合参考相关的文献,可以判断糖苷的位置。根据F.J.Francis的结论,即单一花色苷(3号位置)在0.1%HCl-甲醇溶液中,其A440/Amax比值一般大于20%;而双取代的花色苷(3、5号位置)在0.1%HCl-甲醇溶液中A440/Amax比值一般小于20%。由表6可判断,红树莓果实中色素所含的花色苷种类均为矢车菊素的衍生物,且3号位置上面有取代,5号位上羟基未被苷化。
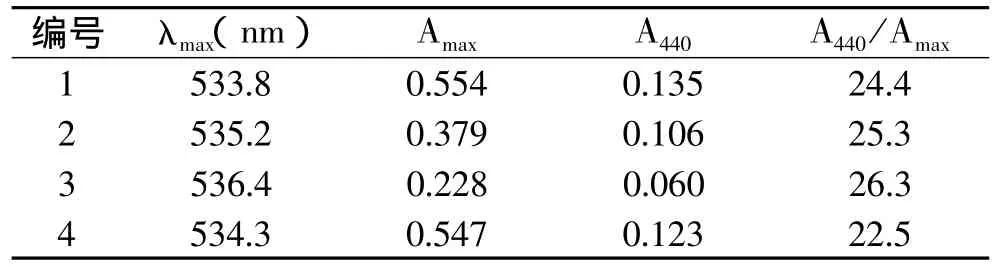
表6 四组色素组分的光谱数据
四组色素均于300~330nm处无吸收且紫外光下荧光反应呈阴性,说明四种色素组分分子内无酰基,且在5位无取代基。
2.4.2 纸层析鉴定结果 纸色谱展开后测量并计算色素斑的Rf值,参考文献[10]做对照,结果见表7。
根据以上分析可初步确定1号色素为矢车菊素-3-葡萄糖苷,2号为色素矢车菊素-3-芸香糖苷,3号色素为矢车菊素-3-槐糖苷,4号色素为矢车菊素-3-葡萄糖-芸香糖苷。
3 结论
3.1 HPD-700大孔吸附树脂较适宜用于纯化红树莓色素,纯化的适宜条件为:粗提液pH为2时吸附效果较好;以60%乙醇为洗脱液、乙醇体积为4BV、流速为0.6mL/min为解吸条件进行洗脱,洗脱效果较好。
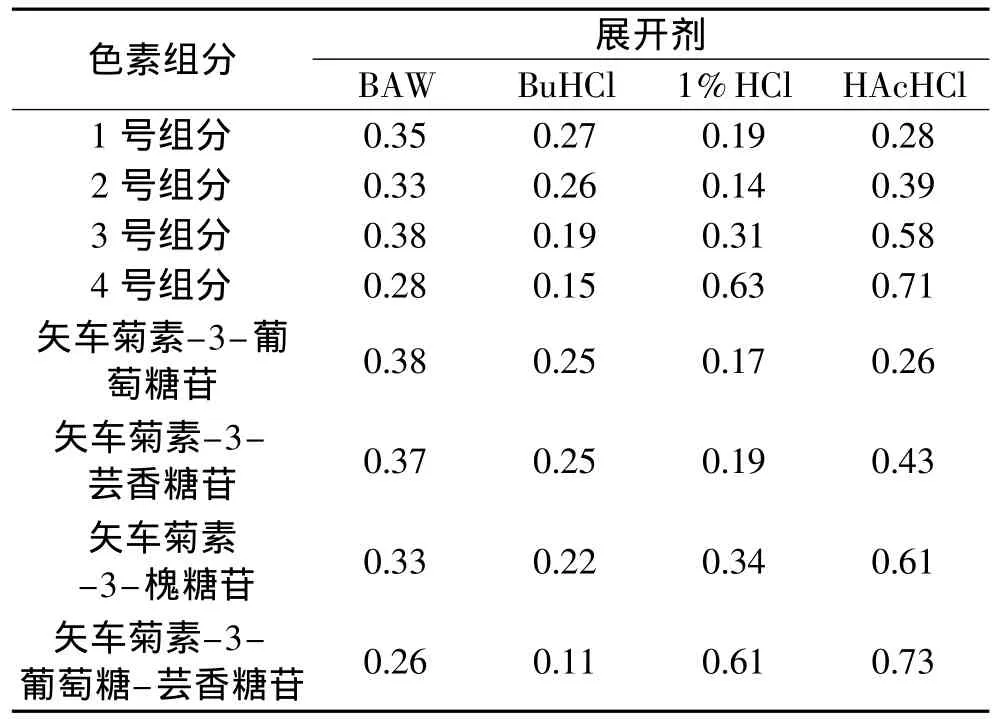
表7 四个色素组分的Rf值及文献中标准值[10]
3.2 树莓色素提取液经大孔树脂纯化后经纸层析分离出四个色素组分,通过紫外光谱、纸层析可初步确定红树莓色素中主要存在四种花色苷,分别为矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷、矢车菊素-3-槐糖苷和矢车菊素-3-葡萄糖-芸香糖苷。更准确的鉴定结果还有待于水解色素的进一步分析以及HPLC、质谱、核磁共振等手段对色素进行更加深入的研究。
[1]刘建华,张志军,李淑芳.树莓中功效成分的开发浅论[J].食品科学,2004,25(10):370-373.
[2]唐传核,彭志英.天然花色苷类色素的生理功能及应用前景[J].冷饮与速冻食品工业,2000(1):26-28.
[3]马自超,庞业珍.天然食用色素化学及生产工艺学[M].北京:中国林业出版社,1994:61-76.
[4]徐俐,金毅.树莓红色素的提取及稳定性的研究[J].食品科学,2006,27(5):191-194.
[5]陈阳,王军华,滕利荣,等.大孔树脂法纯化红花芸豆色素及初步鉴定[J].农业工程学报,2007,23(6):237-241.
[6]黄思梅,张镜.阴香果实花色苷粗提物树脂纯化研究[J].食品科学,2009,30(22):77-80.
[7]蔡凌云,黎云祥,高侠,等.白筘叶总黄酮的大孔树脂纯化工艺研究[J].食品工业科技,2009(10):213-217.
[8]冯丹丹,王立升,刘力恒,等.AB-8大孔吸附树脂分离小叶榕叶水提物中黄酮类化合物的研究[J].时珍国医国药,2009(12):3045-3048.
[9]叶春,阚建全,谭书明,等.鱼腥草叶总黄酮的提取分离[J].农业工程学报,2008,24(10):227-232.
[10]徐渊金,杜琪珍.花色苷分离鉴定方法及其生物活性[J].食品与发酵工业,2006,32(3):67-70.
[11]冯作山,杜鹃,李勇,等.玫瑰色素的纯化及成分初步鉴定[J].食品科技,2006(10):152-155.
[12]杜琪珍,姜华,徐渊金.杨梅中主要花色苷的组成与结构[J].食品与发酵工业,2008,34(8):48-55.
[13]李春美,钟朝辉,窦宏亮,等.大孔树脂分离纯化柚皮黄酮的研究[J].农业工程学报,2006,22(3):153-157.
[14]王本晓,彭向前,乔伟,等.玫瑰花中花色苷的分析方法研究[J].食品与药品,2009(11):42-44.
[15]王爱晶,刘晓东,刘香环,等.芍药花红色素的分离及初步鉴定[J].东北林业大学学报,2009,37(5):74-76.
[16]周艳华,文赤夫,马美湖.樟树果实红色素各单体的定性分析[J].食品科技,2008,33(8):161-164.
[17]樊金玲,罗磊,要萍,等.沙棘籽原花色素组成和结构的研究[J].食品科学,2008,29(1):244-249.
[18]杨晓君,吴桂荣,王岩.塔原1号红花黄色素提取及成分分离鉴定[J].时珍国医国药,2008,19(11):2778-2779.
[19]曹少谦,潘思轶,姚晓琳,等.柱层析法分离纯化血橙花色苷[J].中国农业科学,2009,42(5):1728-1736.
[20]Mullen W,Lean M EJ,Crozier A.Rapid characterization of anthocyanins in red raspberry fruit by high-performance liquid chromatography coupled to single quadrupole mass spectrometry[J].Journal of Chromatography,2002,966:1-2,63-70.
[21]Vukosavljevic P,Bukvic B,Jankovic M,et al.Change of anthocyanins content during raspberry extraction[J].Journal of Agricultural Sciences,2003,48:1,85-102.
[22]Vuorela S,Kreander K,Karonen M,et al.Preclinical evaluation of rapeseed,raspberry and pine bark phenolics for health related effects[J].Journal of Agricultural and Food Chemistry,2005,53:15,5922-5931.
Purification and identification of pigments in red raspberry
SUN Xi-yun1,LIU Ning2,WU Zhao-xia1,ZHANG Qi1,MENG Xian-jun1,*
(1.Shenyang Agriculture University,College of Food,Shenyang 110161,China;2.Shenyang Agriculture University,College of Land and Environmental Science,Shenyang 110161,China)
Natural pigment was extracted from red raspberry fruit and purified by macroporous resin.Paper chromatography was applied to separate compositions of the pigment.Various compositions were preliminary identified using UV-visible spectroscopy and paper chromatography.The results showed that HPD-700 macroporous resin was more appropriate for purification of the pigments in red raspberry,adsorption rate was better when pH value of extraction solution was 2,elution effect was higher with 60%ethanol as eluent,volume 4BV,velocity of flow 0.6mL/min.Four components were obtained through paper chromatography and initially identified as cyanidin-3-Grape glycosides,cyanidin-3-rutinoside,cyanidin-3-Sophora japonica glycosides and cyanidin-3-glucose rutinoside.
red raspberry;pigment;macroporous resin;ultraviolet spectrum;paper chromatography
TS202.3
A
1002-0306(2011)02-0285-04
树莓(Raspberry)系蔷薇科悬钩子属,又称托盘、马林、覆盆子等,分布于温带和寒带地区,欧美各国栽培已有上百年历史,在我国为近年来新兴绿色水果。树莓果实营养丰富,柔软多汁,香味独特,色泽鲜艳,适宜加工成果汁、果酱等多种产品,加工性能极佳。同时树莓还是优秀的提取天然色素的原料,作为红色果汁天然色素添色剂还有着特殊用途[1]。花色苷是存在于果蔬中的一类天然色素,许多研究表明它具有较多生理活性功能,包括抗氧化及消除自由基、降低血清及肝脏中的脂肪含量、抗变异及抗肿瘤,防止体内过氧化作用等。由于花色苷色素具有较好的着色效果及生理活性功能,故可用于一些高附加值食品的开发,具有较广阔的应用前景[2]。本文拟对红树莓中花色苷色素进行分离及初步鉴定,为进一步明确其生理作用及产品开发提供理论依据。
2010-02-22 *通讯联系人
孙希云(1978-),女,讲师,在读博士研究生,主要从事果蔬生物活性成分方面的研究。
国家科技部农业科技成果转化项目(2008GB2B000064);辽宁省科技厅项目(2008402017)。

