玉米胚芽饼中植酸钠的制取及纯化工艺研究
李 健,谷艳玲,黎晨晨
(哈尔滨商业大学食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨150076)
玉米胚芽饼中植酸钠的制取及纯化工艺研究
李 健,谷艳玲,黎晨晨
(哈尔滨商业大学食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨150076)
以脱脂玉米胚芽饼为原料,通过稀植酸浸提、离子交换树脂吸附、解吸、浓缩、精制等过程得到植酸钠。实验结果表明,植酸提取的最佳工艺参数为pH 2.2、提取温度45℃、提取时间1.5h、料液比1∶8、植酸提取得率为74.73%。离子交换树脂吸附解吸的最佳工艺参数为上样液浓度2mg/mL,上样液流速1mL/min,操作温度45℃,pH约为2,洗脱液NaOH浓度0.6mol/L。
玉米胚芽饼,植酸钠,制取,纯化
植酸的提取方法主要分为化学合成法、微生物发酵法、溶剂萃取法。化学合成法成本太高,微生物发酵法技术不成熟,目前溶剂萃取法为生产植酸的主要方法。植酸的纯化方法主要分为传统的沉淀法和新兴的离子交换法,沉淀法周期长、产率低、质量较差,离子交换法可克服传统方法的缺点。本研究为制备高纯度植酸钠,首先采用溶剂萃取法,但未采用常规酸,如盐酸、硫酸、硝酸、醋酸等,由于其不仅引入了其他杂质还带来了环境污染[1],所以转而采用稀植酸直接浸提(“自萃取”)。其次采用离子交换法纯化,据报道,D315离子交换树脂对植酸有较好的吸附效果[4],并且对色素的交换率非常低[7],有利于在实际生产中各种植物中植酸的提取纯化,因此采用D315阴离子交换树脂进行纯化实验研究。
1 材料与方法
1.1 材料与设备
玉米胚芽饼 青岗龙凤玉米淀粉厂,低温粉碎,过60目筛,水分8.09%、蛋白质15.29%、脂肪含量7.2%、灰分0.97%;盐酸、氢氧化钠、三氯化铁、磺基水杨酸、钼酸铵、偏钒酸铵、磷酸二氢钾 均为分析纯;D315阴离子交换树脂、732阳离子交换树脂(天津)、植酸钠(C6H18O24P6·xNa+· yH2O)、植酸溶液 上海阿拉丁公司。
SHZ-A水浴恒温振荡器、101-1-S型电热恒温鼓风干燥箱、PC-1000数显式电热恒温水浴锅 上海跃进医疗器械厂;DL-5-B型离心机 上海逸龙科技有限公司;721型分光光度计 上海光谱仪器有限公司;R-205型旋转蒸发仪 上海申胜生物技术有限公司。
1.2 实验方法
1.2.1 制备的工艺流程 脱脂玉米胚芽饼→稀植酸→水浴振荡→离心→上清液→D315型阴离子交换树脂吸附植酸→热水预洗→NaOH溶液洗脱→植酸钠溶液→Na+732阳离子交换树脂脱盐→浓缩→结晶→植酸钠
1.2.2 提取工艺参数的选择[4-5]精确称取1g脱脂玉米胚芽饼置于50mL具塞三角瓶中,分别按不同pH、料液比,在不同温度下振荡提取一定时间,取上清液3000r/min离心5min后定容到一定体积,测上清液中植酸的含量。在单因素实验的基础上进行正交实验,确定最佳提取工艺参数。
1.2.3 纯化参数的选择 脱脂玉米胚芽饼采用稀植酸浸提两次,合并滤液,离心得上清液。将预处理后的D315阴离子交换树脂转为Cl-型,进行静态吸附实验优化树脂吸附参数,在此基础上进行动态吸附洗脱实验。静态吸附实验用锥形瓶在恒温水浴振荡器上进行,达到平衡后测定吸附后上清液中植酸含量。动态吸附洗脱实验在离子交换柱中进行,将一定浓度的植酸粗提液以一定流速流过树脂,以45℃温水洗柱,以一定浓度的NaOH溶液进行洗脱,得到植酸钠溶液[6]。将该植酸钠溶液一定流速流经Na+732阳离子交换树脂洗脱Ca2+、Mg2+等阳离子,活性炭脱色,浓缩、结晶。
1.3 分析方法
1.3.1 植酸含量的测定 植酸钠标准品中植酸根含量的标定及原料中植酸含量的测定-磷钒钼黄比色法[2],回归方程为:y=1.0896x-0.0055,R2=0.9992,标定结果为 1.8889g植酸钠中植酸根净含量为1.0466g,植酸根净含量为55.41%。原料中植酸净含量为22.5519mg/g。
提取液中植酸含量的测定-三氯化铁比色法[3],回归方程为:y=-0.7073x+0.9072,R2=0.9998。
植酸提取得率(%)=提取液中植酸含量/原料中植酸含量×100%
1.3.2 植酸钠纯度的测定 由于植酸钠中含有不定的钠离子和包埋水合离子,因此纯度用植酸根净含量来表示,采用磷钒钼黄比色法[2]。植酸钠中植酸根净含量(%)=植酸根含量/植酸钠结晶质量×100%。
2 结果与分析
2.1 植酸提取单因素和正交实验结果分析
2.1.1 料液比对植酸得率的影响 由图1可知,料液比的改变对植酸的得率影响较小,因此在考察以下其它因素时,料液比直接采用提取效果最佳的料液比为1∶8。
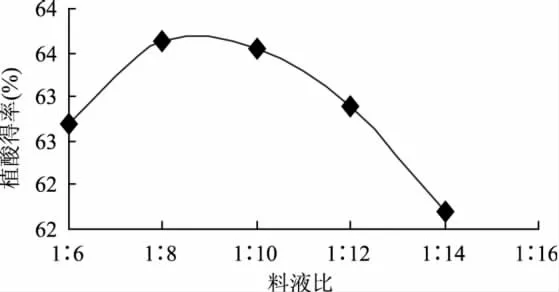
图1 料液比对植酸得率的影响
2.1.2 pH对植酸得率的影响 由图2可知,溶液pH为2.2时植酸的得率最大,溶液酸度过大,溶性的成分如酸性多糖、蛋白质等可能被溶出又重新与植酸结合成螯合态,所以酸浓度过高反而使得得率降低。而酸度过小,又不能把植酸更好地分离出来。故选择pH2.2的植酸溶液为最佳提取pH。
2.1.3 温度对植酸得率的影响 由图3可知,当温度由35℃上升到45℃时,植酸得率逐渐提高,达到45℃时提取效果最佳。温度升高,分子动能增加,使植酸得率上升;但当温度再升高时,可能因为原料中蛋白质等有机物的溶出后与植酸结合生成沉淀使提取率下降。故选择45℃为最佳提取温度。

图2 pH对植酸得率的影响
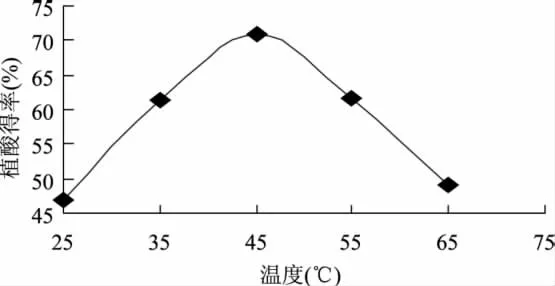
图3 温度对植酸得率的影响
2.1.4 提取时间对植酸得率的影响 由图4可知,植酸的得率随着提取时间的延长有上升的趋势,0.5~1.5h时有明显的上升趋势,提取时间为1.5h提取效果最佳,但是1.5h后随着时间的延长非但没有提高得率,反而使有机物等杂质溶出,并使过滤困难。故选择1.5h为最佳提取时间。

图4 提取时间对植酸得率的影响
2.1.5 植酸提取正交实验 正交设计结果见表1,方差分析见表2。
由表1可知,植酸自萃取的最佳工艺参数为pH2.2,提取温度45℃,提取时间1.5h,料液比1∶8。各种因素对提取效果影响的主次顺序依次为:提取温度>pH>提取时间。通过方差分析检验可知,pH和提取温度对植酸提取影响极显著,提取时间对植酸得率的影响显著。
2.1.6 验证实验 按正交实验确定的最佳提取条件进行验证实验,得率为74.73%。比正交实验中的较优组得率高。因此正交实验得出的优水平是可靠的。
2.2 吸附平衡时间、pH、温度分别对D315阴离子交换树脂静态吸附效果的影响
分别考察吸附平衡时间、温度、pH对吸附效果的影响。结果如下:如图5,当吸附时间到120min时达到吸附平衡。如图6所示,当在冰箱中4℃放置时,对植酸也有一定的吸附作用,随着温度的升高植酸的吸附量逐渐增加,45~50℃时达到最大吸附,温度过高时吸附的同时也存在着解吸。因此最终确定45℃吸附效果最好。如图7所示,当植酸提取液的pH为2时树脂对植酸的吸附量达到最大值,随着pH的增大吸附量逐渐下降,当pH大于6时明显看到有沉淀生成,溶液中发生植酸复盐沉淀。在此基础上进行动态吸附实验,上样液用植酸将pH调到2,温度为45℃。

表1 正交实验表

表2 方差分析结果

图5 吸附平衡时间
2.3 泄露点和饱和点的测定
离子交换树脂有一定的交换容量,上样液中植酸浓度太大,流速过快都会导致泄露点低;上样液浓度太小,流速过慢,在实际中不经济且周期太长。树脂使用量与浓度、流速有一定的交互作用,可通过增加树脂使用量增加上样液浓度、增加流速。本实验采用8g树脂,所以采用2mg/mL植酸提取液进行吸附实验。
由于Cl-对植酸的吸附有干扰作用[7],所以进行盐酸浸提液和植酸浸提液动态吸附测定泄露点和饱和点对比。2mg/mL的植酸提取液以1mL/min通过8g树脂柱,10mL管收集,检测各管植酸的含量。绘制实验结果如图8所示。

图6 温度对吸附的影响
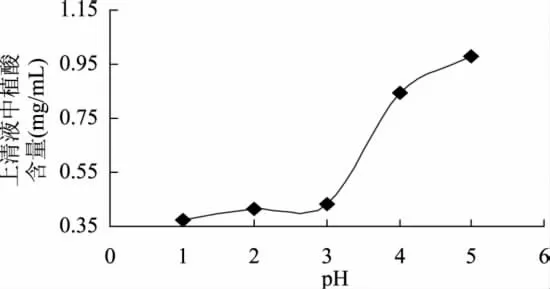
图7 pH对吸附效果的影响
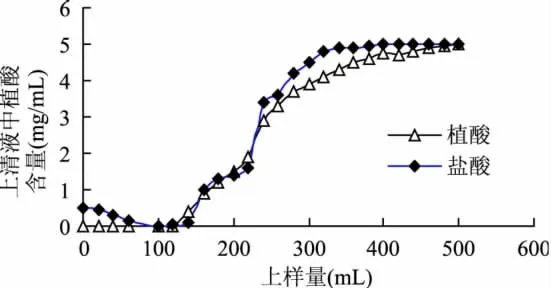
图8 动态吸附对比
由图8可知,采用植酸浸提液可避免起始的Cl-离子干扰作用,利于植酸的纯化。动态吸附结果表明,D315离子交换树脂对稀植酸浸提液吸附效果较盐酸浸提液的吸附效果好,无前期泄露,且饱和点高。
2.4 洗脱液浓度对洗脱效果的影响
选取3g饱和吸附植酸的树脂分别在0.2、0.4、0.6、0.8、1mol/L NaOH溶液中浸泡过夜,取5mL浸泡液测定植酸含量,如图9所示。结果表明,当NaOH浓度为0.6mol/L时的洗脱效果最好。
2.5 732脱阳离子、脱色、浓缩及纯度测定
植酸钠稀溶液采用1%~2%的活性炭脱色,以1.0mL/min速度通过Na+型732型阳离子交换树脂,除去Ca2+、Mg2+离子。45℃真空浓缩,结晶。
纯度测定:结晶后称量一定重量定溶,测定溶液中植酸净含量57.5%。
3 结论
采用正交实验设计法研究提取条件对植酸提取得率的影响,最佳提取工艺参数为pH2.2、提取温度45℃、提取时间1.5h、料液比1∶8,在此条件下进行提取植酸得率为74.73%。采用离子吸附洗脱法从脱脂玉米胚芽饼中提取植酸。结果表明,D315离子交换树脂对植酸有较好的吸附作用,最佳纯化工艺参数为上样液浓度2mg/mL、上样液流速1mL/min、pH约2、操作温度45℃、洗脱液浓度0.6mol/L。在最佳提取及纯化参数条件下,制取得到植酸钠中植酸净含量为57.5%,比本研究所采用的植酸钠标准品中植酸净含量55.41%高。
由此可见,采用植酸自萃取法不使用有机酸类萃取剂,避免引入大量阴离子杂质;同时缩短纯化工艺流程和生产周期。本实验结果表明,采用D315离子交换树脂对稀植酸浸提液纯化效果比对盐酸浸提液的纯化效果好,无前期泄露现象,且饱和点高。同时,提取纯化制取植酸钠的同时,可采用H+型732型阳离子交换树脂对洗脱液纯化除钠离子制备植酸溶液,之后再次投入到植酸的提取工艺中,可达到循环使用、提高纯度、节省成本的目的。所以采用自萃取法对玉米胚芽饼中植酸钠的制取及纯化效果更好,为得到高纯度的植酸钠提供理论依据。
[1]肖传豪,李清霞.离子交换法提取植酸的原理分析[J].化工时刊,2010,24(6):35-37.
[2]任传英.高纯度植酸的制备及其抗氧化活性研究[D].黑龙江八一农垦大学,2007:18-19.
[3]GB-T 5009.153-2003植物性食品中植酸的测定[S].北京:中国标准出版社,2003.
[4]陈建峰.同步提取、分离及纯化菜籽饼粕中的多酚和植酸[D].华中农业大学,2008:37-42.
[5]章炳谊.菜籽饼粕中植酸的提取及其抗氧化活性的研究[D].合肥工业大学,2007.
[6]张丙华,张晖,王立,等.利用弱碱性阴离子交换树脂从脱脂米糠中制取植酸的研究[J].食品与饲料加工,2010(4): 30-32.
[7]郭伟强,王志刚.油菜籽饼粕中植酸的提取及结构鉴定研究[D].浙江大学,2005.
Extraction and purification of phytic acid dodecasodium from defatted corn germ cake
LI Jian,GU Yan-ling,LI Chen-chen
(Key Laboratory of Food Science and Engineering,College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
The phytic acid dodecasodium was extracted with self-extraction,anion exchange adsorption,elution,refinement and concentration from defatted corn germ cake.The results indicated that the optimal process conditions of extraction:temperature 45℃,extraction time 1.5h,ratio of liquid to raw material 8∶1 and pH about 2.2,the observed value of phytic acid yield was 74.73%.The yield was the optimal process conditions of anionexchange:absorption solventconcentration2mg/mL,adsorption solventflow rate1.0mL/min,operation temperature 45℃ and pH about 2,NaOH elution solvent concentration 0.6mol/L.
defatted corn germ cake;phytic acid dodecasodium;preparation;purification
TS210.1
B
1002-0306(2011)12-0365-04
2011-06-08
李健(1956-),男,教授,学士,研究方向:食品化学。

