海水中有机锡含量测定方法研究
周长杰,刘 魁,王荣耕,李景印,王云清
(河北科技大学理学院,河北石家庄 050018)
海水中有机锡含量测定方法研究
周长杰,刘 魁,王荣耕,李景印,王云清
(河北科技大学理学院,河北石家庄 050018)
建立了氢化物发生-顶空固相微萃取-毛细管气相色谱-火焰光度检测器联用技术测定海水中有机锡化合物含量的方法。样品经NaBH4衍生化后,采用顶空固相微萃取装置萃取,再用毛细管气相色谱-火焰光度法测定。氯化三丁基锡的线性范围为40~200 ng/L,相关系数为0.986 8。在100,140,200 ng/L 3个添加水平下,回收率为81.0%~121.0%,RSD值为16.98%,检测限为15 ng/L。该方法可用于海水中有机锡化合物的测定。
氯化三丁基锡;顶空固相微萃取;气相色谱-火焰光度法;海水
海洋是人类最大的资源宝库。随着人类社会工业化的不断发展,海洋污染问题日益严重,而有机锡作为人为因素引入海洋环境的极毒化学品之一[1],已经引起各国政府和环保组织的高度重视。在海洋领域,有机锡主要用于海洋船体的防污涂料中,其中氯化三丁基锡(TBT)是对人体和生物有巨毒的物质,极低质量浓度(1 ng/L)的TBT就能引起海洋生物累积性中毒或引起可怕的生殖逆向性变化,引起生物性畸变[2]。海洋生物对TBT等有机锡化合物还具有很强的富集能力。例如:藻类对 TBT的生物富集倍数(BCF)可达4×104,一般鱼类的BCF值为102~103,贻贝及底栖生物的BCF值为103~104[3-4]。经过食物链的传递,更高生态位的海洋生物,如海洋哺乳类和鸟类等也会受到间接污染的毒害作用。总之,有机锡化合物对于海洋生态系统的不同层次、不同侧面、各个子系统都会造成严重的污染,甚至是不可逆转的破坏,最终将影响到人类的生活和生存。
国外发达国家在很早以前就非常重视对有机锡的控制和监测,并建立了明确的限制标准[5]。中国拥有宽阔的沿海海域,由于中国目前没有具体的法规限制有机锡的使用,所以造成有机锡污染问题相当严重,特别是在近海海域、港湾和内河港口。中国学者对国内一些沿海地区采样调查的结果表明,沿海水域中 TBT及其降解产物二氯化二丁基锡(DBT)和三氯化一丁基锡(MBT)的质量浓度平均值分别高达几十乃至几百ng/L[6],远远高于西方国家规定的残留标准[7]。这不仅会对中国的海洋生物造成严重危害,同时也对人体健康造成严重威胁。
由于重视不够,中国对有机锡污染的研究不多,尚缺乏有机锡污染的第一手资料。从目前已有的工作基础来看,缺乏各种化学分离和灵敏有效的分析方法是制约这项研究广泛开展的原因。由于海水中有机锡的质量浓度一般在ng/L级,甚至更低,因此研制开发具有高灵敏度的有机锡的测定方法具有重要的实际意义。
目前已报道的方法主要是采用气相色谱仪作为分离手段,与其他高灵敏的检测器联用的方法测定有机锡的含量,包括 GC-QSIL-FPD[8-9],GC-PFPD[10-11],GC-AES[12],GC-AAS[13-15],GC-M IP-AES[16],GC-MS[17],GCICP-MS[15]等。其中,QSIL-FPD检测器为作者自制,没有实现商品化;其他检测器的价格非常昂贵,都不适合船载在线分析。另外,文献中都采用四乙基硼化钠作为衍生化试剂,该试剂不仅价格昂贵,性质也非常不稳定,需要现用现配,也不适合在线分析的需要。
本研究以价廉的硼氢化钠作为衍生剂,采用自制的自动氢化物发生器进行有机锡的衍生化反应,通过优化有机锡衍生化反应条件和色谱条件,建立了氢化物发生-顶空固相微萃取-毛细管气相色谱-火焰光度检测器联用技术测定海水中有机锡化合物含量的方法。该方法具有自动化程度高、重现性好、灵敏度高、干扰小、适合船载在线测定等特点,可以实时监测海水中有机锡的含量。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
岛津GC-2014气相色谱仪,配有FPD火焰光度检测器及GC solution Ver.2.3(中文版)化学工作站;自动氢化物发生器(自制);SPM E手柄 (Supelco公司提供);萃取纤维(Supelco公司提供);PDM S:100,30,7μm;PA:85μm;PDM S/DVB:65μm。
1.1.2 试剂
氯化三丁基锡(TBT,质量分数为96%);三氯化一丁基锡(MBT,质量分数为95%,A lfa Aesar公司提供);二氯化二丁基锡(DBT,质量分数为97%,东京化成工业株式会社提供);甲醇(色谱纯);硼氢化钠(质量分数为98%,分析纯);醋酸、醋酸钠等试剂,均为分析纯以上;三重蒸馏水。
实验中避免使用塑料器皿,所有玻璃仪器使用前必须洗净,用10%(体积分数)硝酸浸泡12 h,用热水洗净,再分别用三重蒸馏水冲洗干净,烘干或自然晾干。
1.1.3 溶液的配制
TBT储备液(质量浓度为2 mg/m L):准确称取 TBT(质量分数为96%)标准品0.285 6 g于50 m L棕色容量瓶中,用甲醇溶解并稀释至刻度,即得。使用前用蒸馏水稀释至所需质量浓度,于冰箱中保存,储备液可使用1个月以上。
MBT储备液和DBT储备液:同上述方法配制。
3%(质量分数)的NaBH4溶液:称取3.0 g的NaBH4,用100 m L浓度为0.01 mol/L的NaOH溶解即得,当天使用。
醋酸-醋酸钠缓冲溶液(p H值为6.0):称取无水醋酸钠60 g,用水溶解,加入浓冰醋酸3.0 m L,用水稀释至1 000 m L,即得。
空白海水水样:取自青岛海域。
1.2 色谱条件
HP-1石英毛细管柱:30 m×0.25 mm×0.25μm;进样口:230℃;FPD检测器:250℃;载气:高纯氮气(体积分数为99.999 99%);流速:1.0 m L/min;空气流速:50 m L/min;氢气流速:110 mL/min。
程序升温:100℃开始,以10℃/min升到160℃,再以30℃/min升到250℃,保持3 min。
1.3 测定方法
向氢化物发生器中加入500 mL空白海水水样,加入p H值为6.0的醋酸-醋酸钠缓冲溶液50 m L,加入一定量有机锡标准液,加盖橡胶塞,插入萃取纤维,将纤维暴露在发生器顶空,向瓶内注入3.0 m L质量分数为3%的NaBH4溶液,用磁力搅拌器搅拌。经过10 min后取出萃取纤维,插入气相色谱仪进样口,在最佳色谱条件下进行解吸、测定。
2 结果与讨论
2.1 萃取纤维的性质和涂层厚度对萃取效率的影响
由于海水基体非常复杂,有机锡的含量甚微,采用常规的分离手段无法有效地将有机锡从海水中分离,因此,要将有机锡的形态转化为易挥发的有机锡氢化物,再采用顶空固相微萃取(SPM E)技术,萃取气态的有机锡氢化物,能有效地将有机锡和非常复杂的海水基体分离。
有机锡氢化物为挥发性的弱极性物质,根据相似相溶的原理,非极性或弱极性的物质更容易被非极性的涂层所萃取,在萃取时应选择对非极性或弱极性有效的萃取纤维。常用的萃取纤维如下:聚二甲基硅氧烷(PDM S),涂层厚度分别为100,30,7μm;聚丙烯(PA),涂层厚度为85μm;聚二甲基硅氧烷(PDM S)和二乙烯苯(DVB)交联,涂层厚度为65μm。
配制一系列相同质量浓度的 TBT标准溶液,按测定步骤测定,在相同的实验条件下分别考察这几种萃取纤维对 TBT的萃取效率。实验结果见图1。
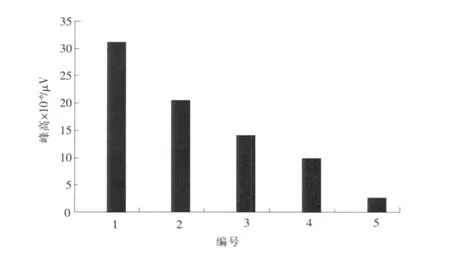
图1 萃取纤维的性质和涂层的厚度对萃取效率的影响Fig.1 Effect of fiber coated with various nature and thickness coating on extraction efficiency
由图1可见,在相同的实验条件下,不同的萃取纤维对TBT的萃取效率有很大的区别。其中,PDM S的萃取效率最高,并且涂层越厚,萃取效率越大。
实验确定采用100μm的 PDM S作为顶空固相微萃取的萃取纤维。
2.2 氢化物发生体系的参数优化
2.2.1 酸度对萃取效率的影响
配制一系列相同质量浓度的TBT标准溶液,分别调节溶液的p H值为4.0,4.5,5.0,5.5,6.0,6.5,按测定步骤测定,结果见图2,在p H值为6.0时,萃取效率最高。实验时选择p H值为6.0的醋酸-醋酸钠缓冲液来控制发生体系的酸度。
2.2.2 氢化物发生体系温度对萃取效率的影响

图2 反应体系的酸度对萃取效率的影响Fig.2 Effect of p H on extraction efficiency
配制一系列相同质量浓度的 TBT标准溶液,分别调节发生体系的温度为10,20,30,40,50℃,按测定步骤测定,结果见图3。由图3可见,发生体系的温度为20~30℃时萃取效率较高,实验时选择发生体系的温度在室温下进行即可。
2.2.3 衍生化试剂NaBH4的加入量对萃取效率的影响
配制一系列相同质量浓度的 TBT标准溶液,分别加入3%(质量分数)的NaBH4溶液0.5,1.0,1.5,2.0,3.0,4.0,5.0 m L,按测定步骤测定,结果见图4。由图4可知,NaBH4溶液的加入量为2.0~5.0 mL即能达到较大的萃取效果,实验时选择衍生化试剂NaBH4的加入量为3.0 m L,以保证衍生化反应完全进行。

2.2.4 萃取时间对萃取效率的影响
配制一系列相同质量浓度的 TBT标准溶液,按测定步骤测定,萃取时间分别为3,5,8,10,15,20 min,结果见图5。由图5可见,萃取时间为8~15 min时萃取效率较高,实验时选择萃取时间为10 min。
2.2.5 氢化物发生体系反应的最佳条件
通过实验得到的有机锡衍生化的最佳条件如下:反应在室温(20~30℃)进行,p H值为6.0的醋酸-醋酸纳缓冲液,衍生化试剂NaBH4的加入量为3.0 mL,萃取时间为10 min。
2.3 标准曲线的绘制
配制一系列不同质量浓度的 TBT标准溶液,按测定步骤测定,以相应的峰高(Y)对 TBT标准品的绝对含量(质量浓度,X)作回归曲线,见图6。由图6可见,TBT质量浓度为40~200 ng/L具有良好的线性关系,回归方程为 Y=7 976.9X-275 464,相关系数 r=0.986 8,TBT的最低检测限为15 ng/L。
2.4 方法的重现性
配制6份相同质量浓度的TBT标准溶液,分别按测定步骤测定,以色谱峰高计算方法的重现性,结果见表1。由表1可知,RSD值为7.92%,可见方法的重现性良好。
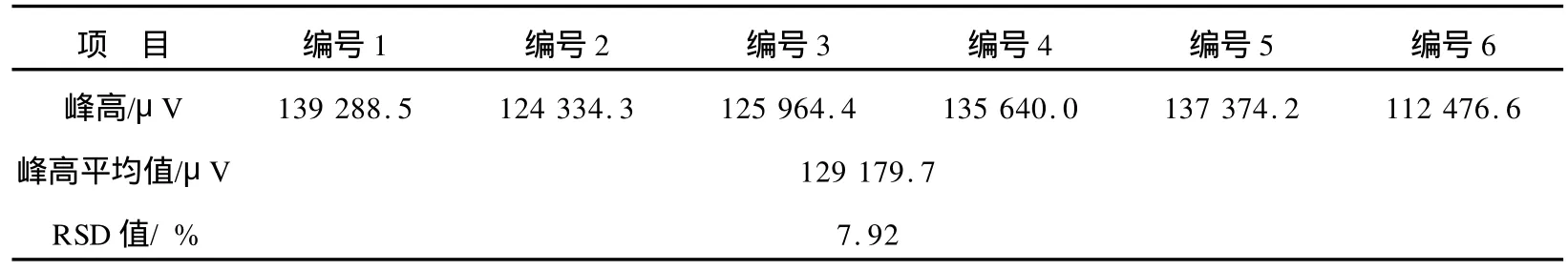
表1 TBT的重现性和相对标准偏差(n=6)Tab.1 Repeatability and relative standard deviation(n=6)of TBT
2.5 回收率实验
向空白海水中加入一定量的 TBT标准样品,按测定步骤测定,以色谱峰高外标法计算方法的回收率,结果见表2,平均回收率为90.75%,方法的准确度较高。
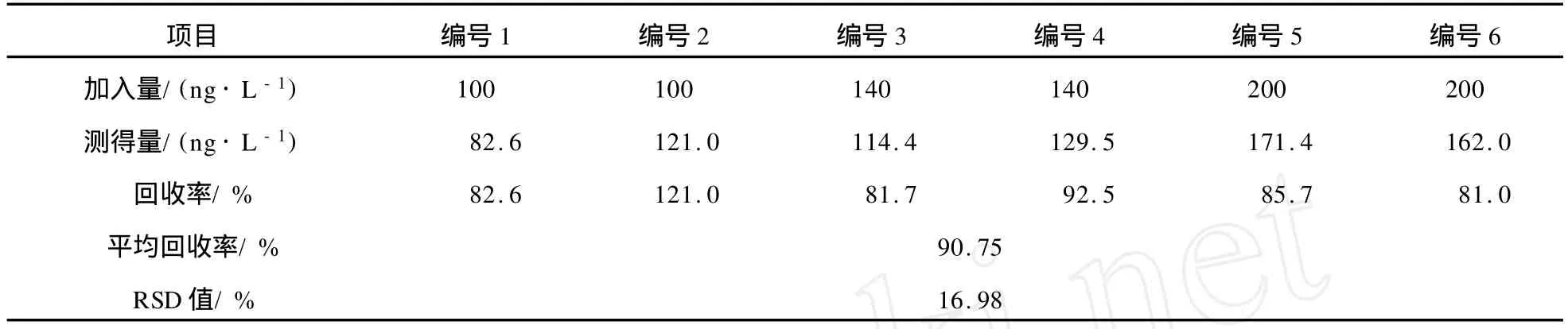
表2 TBT的平均回收率和相对标准偏差(n=6)Tab.2 Average recovery and relative standard deviation(n=6)of TBT
2.6 干扰的考察
配制含有 TBT及其降解产物DBT和MBT的溶液,按照测定步骤进行测定,结果见图7。

图7 标准有机锡的色谱图Fig.7 Gas chromatogram of butyltin standards
将空白海水水样按照测定步骤进行测定,结果见图8。
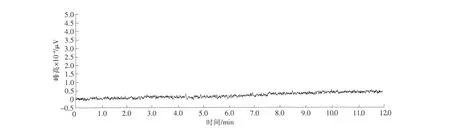
图8 空白海水的色谱图Fig.8 Gas chromatogram of blank sea water
由图7和图8可见,在本测定条件下,降解产物与TBT得到了很好分离,海水中也无任何干扰物质影响测定。
3 结 论
1)海水中有机锡的含量极微,只有ng/L级,并且由于海水的基体非常复杂,干扰因素很多,因此采用常规方法无法实现对海水中有机锡的分析。
2)本研究采用顶空固相微萃取(HS-SPM E)技术,先使海水中的有机锡通过衍生化的方法变成易挥发的氢化物,再采用顶空固相微萃取手段萃取气态的有机锡氢化物,可以有效地将有机锡和非常复杂的海水基体分离。在本实验条件下,空白海水中无任何干扰物质影响测定。固相微萃取在萃取的同时对有机锡进行了富集,可谓一举两得。
3)TBT的降解产物是DBT和MBT,降解产物不影响 TB T的测定。
4)本研究建立了氢化物发生-顶空固相微萃取-毛细管气相色谱-火焰光度检测器联用技术测定海水中有机锡含量的方法。TBT的最低检测限为15 ng/L,回收率为81.0%~121.0%,RSD值为16.98%。该方法具有自动化程度高、灵敏度高、干扰小、简便快速等特点,能较好地应用于海水样品的分析。
[1] HOCH M.O rganotin compounds in the environment:An overview[J].App lied Geochemistry,2001,16:719-743.
[2] ALZIEU C,M ICHEL P,TOLOSA I,et al.O rganotin compounds in mediterranean:A continuing cause for concern[J].M arine Environment Research,1991,32:261-270.
[3] EVANSD W,LAUGHL IN R B.Accumulation of bis(tributyltin)oxide by the mud crab,Rhithropanopeus harrisii[J].Chemosphere,1984,13:213-219.
[4] MAGU IRE R J,WONG P T S,RHAMEYJS.Accumulation andmetabolism of tri-n-butyltin cation by a green alga,Ankistrodesmus falcatus[J].Can J Fishquat Sci,1984,41:537-540.
[5] 江桂斌.国内外有机锡污染研究现状[J].卫生研究(Journal of Hygiene Research),2001,30(1):1-3.
[6] JIANG GB,ZHOU Q F,L IU J Y,et al.Occurrence of butyltin compounds in the waters of selected lakes,rivers and coastal environments from China[J].Environmental Pollution,2001,115:81-87.
[7] FEN T K.Ecotoxicology of organotin compounds[J].Crit Rev Toxicol,1996,26:11-17.
[8] JIANG G B,CEULEMANS M,ADAMS F C.Op tim ization study for the speciation analysis of o rganotin and o rganogermanium compounds by on-column capillary gas chromatography with flame photometric detection using quartz surface-induced luminescence[J].J Chromatogr,1996,727:119-129.
[9] JIANG GB,XU F Z.Speciation analysisof butyltin species in water by gas chromatography w ith flame photometric detection using quartz surface-induced tin emission[J].Appl Organomet Chem,1996,10:77-82.
[10] BANCON-MON TIGN Y C,LESPES G,POTIN-GAU TIER M.Imp roved routine speciation of o rganotin compounds in environmental samp les by pulsed flame photometric detection[J].Journal of Chromatography A,2000,896(1/2):149-158.
[11] HEROULT J,BUENO M,POTIN-GAU TIE R,et al.Organotin speciation in French brandiesand wines by solid-phasemicroextraction and gas chromatography:Pulsed flame photometric detection[J].Journal of Chromatography A,2008,1 180(1/2):122-130.
[12] CHAU Y K,YANG F,BROWN M.Supercritical fluid extraction of butyltin compounds from sediment[J].Anal China Acta,1995,304(1):85-89.
[13] DIRKX W M R,CALLEM B,CEULEMANSM,et al.Speciation of butyltin compounds in sediments using gas chromatography interfaced with quartz furnace atomic absorption spectrometry[J].Journal of Chromatography A,1994,683(1):51-58.
[14] FORSYTH D S,CLEROUX C.Determination of butyltin,methyltin and tetraalkyltin inmarine food p roductswith gas chromatographyatomic absorption spectrometry[J].Talanta,1991,38(9):951-957.
[15] RITSEMA R,de SMAELE T,MOENSL,et al.Determination of butyltins in harbour sediment and water by aqueous phase ethylation GC-ICP-MSand hydride generation GC-AAS[J].Environmental Pollution,1998,99:271-277.
[16] CHAU Y K,YANG F,BROWN M.Evaluation of derivatization techniques for the analysisof organotin compounds in biological tissue[J].Anal Chim Acta,1997,338:51-55.
[17] 袁玲玲,牛增元,叶曦雯,等.GC-MS法测定青岛海滨海水中的有机锡[J].海洋湖沼通报(Transactions of Oceanology and Limnology),2007(1):62-68.
[18] 刘红梅,周庆霞,杨文玲.毛细管气相色谱法测定银杏叶中萜内酯含量[J].河北科技大学学报(Journal of Hebei University Science and Technology),2006,27(3):209-213.
[19] 原现瑞,王玉春,田宝勇,等.毛细管气相色谱法测定无公害柿子中菊酯类农药的残留量[J].河北科技大学学报(Journal of Hebei University Science and Technology),2005,26(4):272-274.
Study on determination of tributyltin in sea water
ZHOU Chang-jie,L IU Kui,WANG Rong-geng,L IJing-yin,WANG Yun-qing
(College of Sciences,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
HS-SPM E-GC-FPD method was developed fo r the determination of tributyltin in sea water.The samp leswere derivatived by NaBH4,extracted by headspace solid phasemicro-extraction and measured by gas chromatograph w ith flame photometric detecto r.The calibration curve for tributyltin is linear in the range of 40~200 ng/L and the co rrelation coefficient is 0.986 8 fo r tributyltin.On the three spiked levels of 100 ng/L,140 ng/L and 200 ng/L,the range of recovery is 81.0%~121.0%and RSD is 16.98%.The detection limit of tributyltin is 15 ng/L.Themethod is simp le and feasible for the determination of organic compounds in sea water with satisfacto ry results.
tributyltin;HS-SPM E;GC-FPD;sea water
O657.63
A
1008-1542(2011)01-0020-06
2010-06-25;
2010-09-12;责任编辑:张士莹
周长杰(1974-),男,河北唐山人,讲师,主要从事化工产品分析及信息科学方面的研究。

