三种有机物对LY12CZ铝合金在酸性溶液中的缓蚀行为研究
刘建华,盛 华,李 明,李松梅,于 美
(北京航空航天大学材料科学与工程学院,北京100191)
三种有机物对LY12CZ铝合金在酸性溶液中的缓蚀行为研究
刘建华,盛 华,李 明,李松梅,于 美
(北京航空航天大学材料科学与工程学院,北京100191)
本工作选取了2-巯基苯并噻唑(MBIH)、苯并三氮唑(BTA)和8-羟基喹啉(8Q)等几种典型的缓蚀剂,研究了其对L Y12CZ铝合金在酸性溶液中的缓蚀效果及机理。通过腐蚀失重法研究了三种缓蚀剂对L Y12CZ铝合金在酸性溶液中腐蚀动力学的影响。利用光学显微镜(OM)、场发射扫描电子显微镜(FE-SEM)及能谱(EDS)等对合金组织和腐蚀形貌进行观察;利用动电位极化、交流阻抗谱(EIS)等研究了铝合金在含有这三种缓蚀剂溶液中的电化学特性,并对其缓蚀机理进行了探讨。结果表明:三种有机物均能在酸性溶液中对L Y12CZ铝合金起到缓蚀作用;缓蚀效果MBIH>BTA>8Q。MBIH和BTA能够选择性地吸附在L Y12CZ铝合金表面S相残留物及杂质相颗粒表面,形成难溶物,抑制腐蚀反应的阴极过程,从而为L Y12CZ铝合金在酸性溶液中的腐蚀提供良好的保护。8Q能够吸附在整个铝合金的表面,但随着阳极溶解的进行,吸附层遭到破坏,从而影响了缓蚀效果。
L Y12CZ铝合金;缓蚀剂;酸性溶液;腐蚀动力学;选择性吸附
近年来随着航空工业的蓬勃发展,对航空铝合金的耐蚀性能提出了更高的要求。L Y12CZ铝合金由于其高比强度而广泛应用于航空工业[1,2]。然而,这种铝合金由于含有大量的Cu,Mg等合金元素以及Fe,Si等杂质元素而非常容易发生点蚀、晶间腐蚀等局部腐蚀[3-5]。相关研究表明[6],L Y12CZ铝合金的点蚀一般起始于粗大的S相(Al2MgCu)颗粒。S相在腐蚀性介质中首先发生Mg和Al的优先溶解,形成奶酪状的Cu残留物;该残留物发生重构,覆盖在铝合金表面,显著扩大了阴极表面积,加速了周围Al的溶解,从而对局部腐蚀的进一步发展起到了促进作用。因此,如果能对S相的阴极作用进行抑制,就能有效抑制L Y12CZ铝合金的局部腐蚀。
稀土元素是一类对含Cu铝合金非常有效的缓蚀剂[6-11]。Ce3+和La3+在含有氯离子的中性溶液中能够与S相形成难溶的氢氧化物,不仅缓冲了局部p H值,而且阻碍了氯离子的入侵,从而发挥较好的缓蚀作用。以8Q为代表的喹啉类物质对含Cu铝合金的缓蚀作用近年来受到广泛关注,Garrigues等研究了8Q对纯铝的缓蚀作用[12],Li等研究了8Q对L Y12CZ铝合金在中性氯离子溶液中的缓蚀作用[13],研究表明8Q能够在铝合金表面的 S相上富集,与Cu形成螯合物,也可以与 Mg和Al形成螯合物。三唑及噻唑衍生物作为重要的Cu及其合金的缓蚀剂[13-17],对含Cu铝合金中的缓蚀作用也开始引起国内外的关注,它们能吸附在Cu的表面,与Cu原子形成链状聚合物,阻挡活化区域的暴露,从而发挥缓蚀的效果。
综上所述,铝合金缓蚀研究主要集中在含氯离子的中性腐蚀环境中,铝合金在酸性环境中的缓蚀研究报道较少,本工作研究了以2-巯基苯并噻唑(MBIH)、苯并三氮唑(BTA)及8-羟基喹啉(8Q)作为缓蚀剂的L Y12CZ铝合金在酸性溶液中的缓蚀行为。
1 实验
1.1 试样制备
试样制备所用的L Y12CZ铝合金的成分如表1所示。所有的试样都经过碱洗(50g/L NaOH溶液,30min,60℃),出光,去离子水冲洗,干燥箱中烘干。用于表观腐蚀程度观察、交流阻抗法和电化学极化的试样用500,800,1500#的砂纸打磨,丙酮超声清洗,擦洗;用于扫描电镜、能谱测试的试样用500,800,1500#的砂纸打磨,抛光,丙酮超声清洗,擦洗。

表1 LY12CZ铝合金成分(质量分数/%)Table 1 Composition of the L Y12CZ aluminum alloy(mass fraction/%)
1.2 实验及测试方法
用全浸腐蚀失重法研究2-巯基苯并噻唑、苯并噻唑、8-羟基喹啉三种有机物对L Y12CZ铝合金在酸性溶液中腐蚀动力学行为的影响,这三种缓蚀剂的中英文名称、结构、缩写如表2所示。将28片试样分为4组,每组7片,称重后分别浸泡在0.5mol/L H2SO4溶液(体系A)、含有2-巯基苯并噻唑(饱和,因为其在酸中的溶解度很小,体系B)、含有苯并三氮唑(2g/L,体系C)及含有8-羟基喹啉(2g/L,体系D)的0.5mol/L H2SO4溶液中,浸泡时间分别为1,2,4,10,20,30h和40h,分别编号为 A1~A7,B1~B7,C1~C7,D1~D7。浸泡温度为25℃。浸泡后用30%的硝酸溶液去除腐蚀产物,用自来水、去离子水反复冲洗,烘干,用电子天平精确称重。

?
电化学测试在电化学工作站(Parstat 2273,Princeton Application Research)上进行,采用传统三电极体系,L Y12CZ铝合金为工作电极,工作面积为7cm2,饱和甘汞电极为参比电极,铂电极为辅助电极。测试温度为25℃。采用动电位极化法测量这三种缓蚀剂溶液中的极化曲线,扫描速率为25mV/s,扫描范围为比开路电位-250mV~1V。采用振幅为5mV的正弦交流电扰动三电极体系测量交流阻抗谱(EIS),测试频率范围为105~10-2Hz。采用光学显微镜(OL YMPUS)、场发射扫描电子显微镜(Hitachi S-4800 SEM)及能谱(Hitachi S-530,Oxford Link2SISI)观察腐蚀及电化学测试前后L Y12CZ铝合金试样的表面形貌、合金相颗粒,从而探讨缓蚀机理。
2 结果与讨论
2.1 不同缓蚀剂的酸性溶液中的腐蚀行为分析
图1是浸泡在不同体系中L Y12CZ铝合金的腐蚀失重随时间的变化曲线。可以看出随浸泡时间的延长,失重不断增加。浸泡10h之后,各体系中的试样均开始发灰发暗,这主要是由于随着腐蚀的进行,试样表面堆积了杂质粒子及腐蚀产物。浸泡20h后,如图2所示,试样明显变黑,但是缓蚀剂体系中试样的发黑程度明显低于空白体系中的情况。
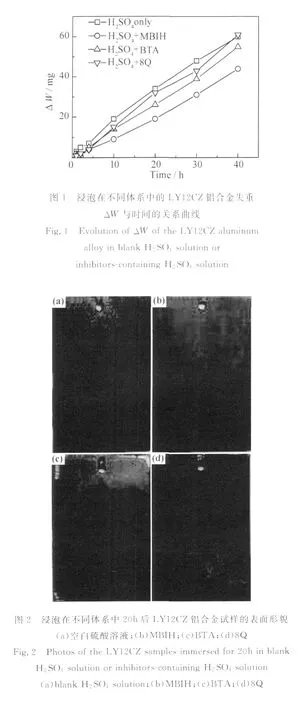
腐蚀速率ρWL(g·h-1·cm-2)可用公式(1)计算:

式中:A是表面积(cm2);t是腐蚀时间(h)。腐蚀速率ρWL随时间的变化曲线如图3所示,可见与空白体系相比,缓蚀剂体系中腐蚀速率都有所降低,尤其在浸泡初期(4h内),腐蚀速率的降低尤为明显。所有体系中的腐蚀速率都在浸泡初期迅速降低,随后趋于稳定,这是由于腐蚀产物在试样表面堆积造成的。空白体系及8Q体系中铝合金的腐蚀速率分别在10h及4h后趋于稳定,BTA体系及MBIH体系中铝合金的腐蚀速率均在2h后便能趋于稳定的较低值,这说明MBIH及BTA能在较短的时间发挥缓蚀剂的作用。
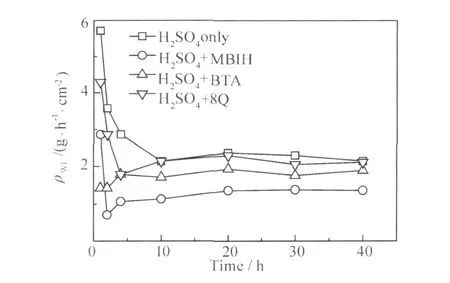
图3 浸泡在不同体系中的L Y12CZ铝合金腐蚀速率ρWL与时间的关系曲线Fig.3 Evolution ofρWLof the L Y12CZ aluminum alloy in blank H2SO4solution or inhibitors-containing H2SO4solution
结合失重、腐蚀速率及光学显微镜分析,可见与空白H2SO4溶液中相比,三种有机物的添加都使铝合金试样的失重有所减小,腐蚀速率有所降低,试样的发黑程度有所减轻,说明三种有机物都对L Y12CZ铝合金在酸性溶液中的腐蚀有一定抑制作用。其中MBIH缓蚀效果最好,其次是BTA,再次是8Q,8Q体系中在40h时失重已经与空白 H2SO4溶液中相近。
为了研究三种有机物对L Y12CZ铝合金在酸性溶液中的缓蚀行为,通过动电位极化进行了不同体系中浸泡不同时间的腐蚀电位Ecorr及腐蚀电流icorr的测量。
从图4在不同体系中浸泡10h的动电位极化曲线可以看出,阳极极化部分电流差别较小,阴极极化部分电流差别较大,由此推测缓蚀剂为阴极控制机理。
从图5中各个体系L Y12CZ铝合金试样的Ecorr值随时间的变化可以看出,各体系中的Ecorr值都在浸泡初期迅速正移,这是由于铝合金表面形成了钝化膜,抑制了阳极反应的进行;随后随着腐蚀产物的堆积,Ecorr值逐渐稳定并略有上升。缓蚀剂的加入导致试样的Ecorr值相比于空白 H2SO4溶液,明显向阴极方向移动,这是因为缓蚀剂吸附在电位较正的阴极Cu的表面,抑制了阴极反应的进行,这与极化曲线的分析结果相同。其中MBIH体系中试样Ecorr值下降最多,说明对阴极反应的抑制作用最强,其次是BTA,再次是8Q。
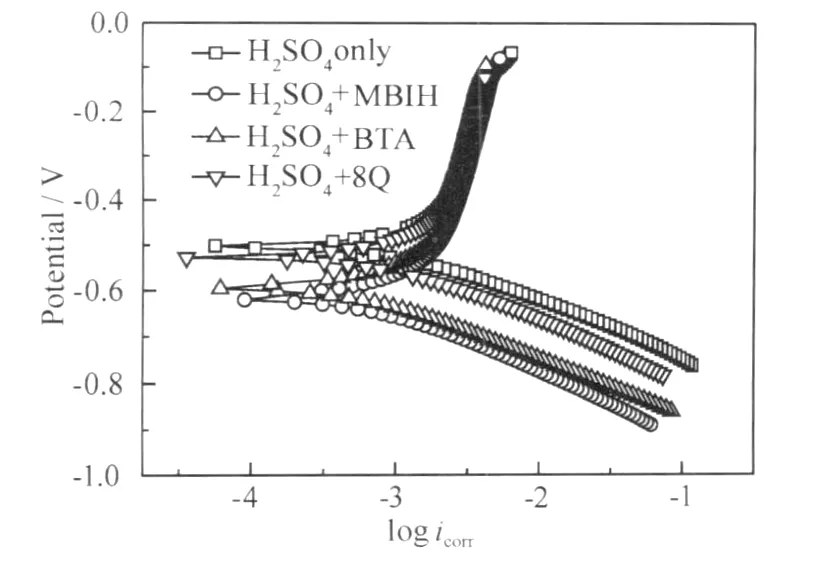
图4 L Y12CZ铝合金在不同体系中浸泡10h的极化曲线Fig.4 Potentiodynamic polarization curves for L Y12CZ aluminum alloy immersed for 10h in blank H2SO4 solution or inhibitors-containing H2SO4solution
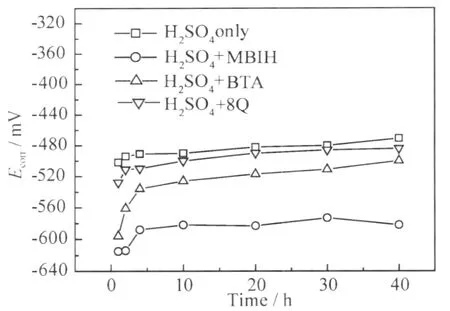
图5 浸泡在不同体系中的L Y12CZ铝合金腐蚀速率Ecorr与时间的关系曲线Fig.5 Evolution ofEcorrof the L Y12CZ aluminum alloy in blank H2SO4solution or inhibitors-containing H2SO4solution
通过极化曲线及腐蚀电位,获得腐蚀电流icorr值。缓蚀效率IEi可通过公式(2)算出:

从表3中能够看出,缓蚀剂的加入使icorr值明显降低,说明对L Y12CZ铝合金在酸性溶液中的腐蚀起到了抑制作用。其中MBIH体系中icorr值降低最为明显,在浸泡2h内腐蚀电流仅是空白 H2SO4溶液中的1/3,其次是BTA,再次是8Q。随着腐蚀产物的堆积,三种缓蚀剂的缓蚀效率都随着浸泡时间的延长呈下降趋势,相同腐蚀时间下,MBIH缓蚀效率最高,其次是BTA,再次是8Q。
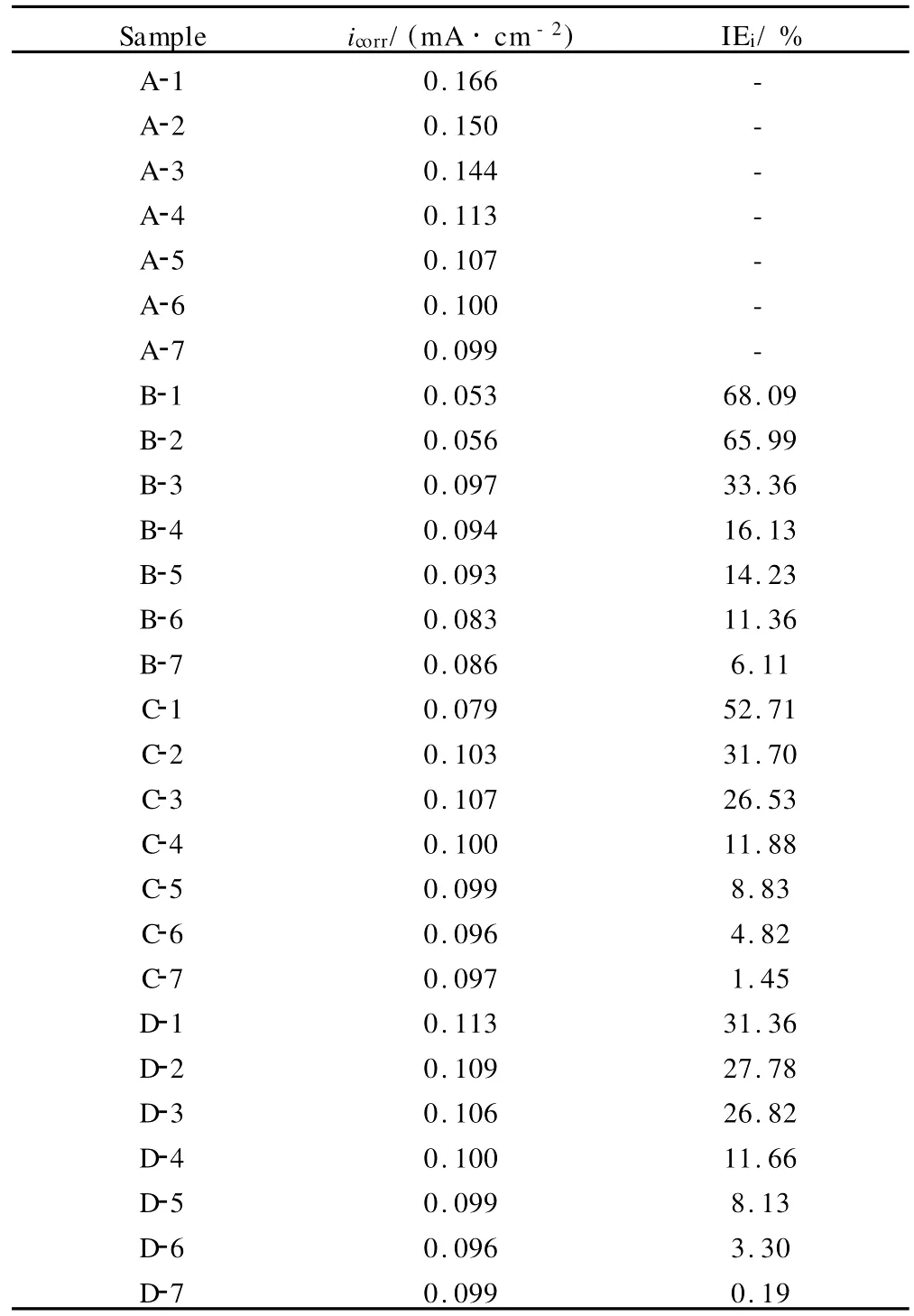
表3 不同体系中LY12CZ铝合金试样的icorr及IEiTable 3 The values oficorrand IEiof the L Y12CZ aluminum alloy in blank H2SO4solution or inhibitors-containing H2SO4solution
2.2 三种缓蚀剂在酸性溶液中的缓蚀机理
通过腐蚀失重及腐蚀电流icorr的变化,得知所选择的三种有机物都能对L Y12CZ铝合金在酸性溶液中的腐蚀起到抑制作用,并推测为阴极控制机理。为了研究L Y12CZ铝合金在不同缓蚀剂体系中的缓蚀机理,进行了交流阻抗谱(EIS)测试。图6为L Y12CZ铝合金在不同体系中浸泡10h的Nyquist图,可见在高频下出现一个较大的容抗弧,低频下出现一个较小的感抗弧,随后在低频下又出现了一个容抗弧。相同浸泡时间下,空白 H2SO4溶液中试样的高频容抗弧最小,低频感抗弧不明显,MBIH体系中的高频容抗弧及低频感抗弧的半径最大,其次是BTA体系,再次是8Q体系。图7为在MBIH体系中不同浸泡时间的Nyquist图,可见随着浸泡时间的延长,高频容抗弧逐渐缩小,低频感抗弧也逐渐缩小直至消失,逐步变为由高频及低频两个容抗弧组成图谱。
在本工作研究的测试体系中,高频容抗弧与铝合金钝化膜及缓蚀剂吸附层的性质有关[18,19],高频容抗弧的大小能够反映钝化膜及缓蚀剂吸附层的耐蚀性能。低频容抗弧反映的是铝合金基体的活化溶解或钝化膜生成反应。感抗行为与表面钝化膜的诱导溶解过程有关[20,21]。图6中缓蚀剂体系中高频容抗弧增大,说明缓蚀剂的加入导致铝合金钝化膜及缓蚀剂膜层的耐蚀性增大,并能够对钝化膜的破坏起到一定的抵制和修复作用,使铝合金基体的活化溶解降低。随着浸泡时间的延长,图7中所示的变化,说明铝合金钝化膜及缓蚀剂膜层耐蚀性变差,钝化膜诱导溶解加重,铝合金基体的活化溶解加重,这与前文所述光学照片中浸泡一段时间后试样表面发黑可以对应。

根据以上分析,采用 ZsimpWin软件对交流阻抗谱进行拟合,根据感抗弧是否存在可获得两种等效电路,分别如图8(a),(b)所示。其中,Rsol代表溶液阻抗,Rf代表钝化膜、缓蚀剂膜层及所有吸附层阻抗,Q是常相位元件,Rp代表电荷转移阻抗,Cdl代表双电层电容。L代表表面钝化膜诱导溶解等过程引起的电感,RL为此过程引起的阻抗。根据此等效电路,对图6中浸泡在不同体系10h后L Y12CZ铝合金的交流阻抗谱进行解析,获得电化学参数列于表4中。

图8 L Y12CZ铝合金在不同体系中浸泡不同时间的等效电路(a)不含感抗弧;(b)含有感抗弧Fig.8 The equivalent circuit models used for fitting experimental spectra for specimen without(a)and with(b)inductive loop
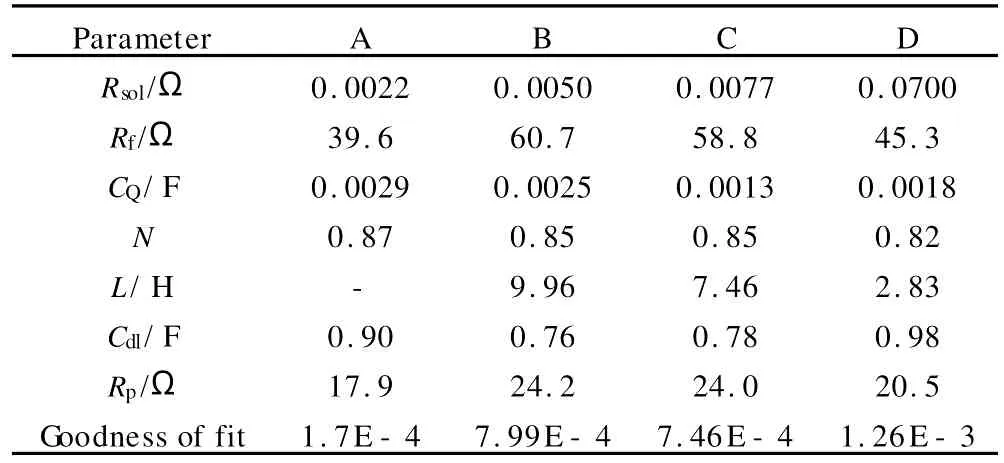
表4 由等效电路获得的浸泡在不同体系中10h后LY12CZ铝合金的电化学参数Table 4 Electrochemical parameters obtained from EIS measurements of the L Y12CZ aluminum alloy in blank H2SO4 solution or inhibitors-containing H2SO4solution
从表4可以看出,缓蚀剂体系中,铝合金表面钝化膜及吸附层的阻抗Rf明显增加,电荷转移电阻Rp也有所增加,说明铝合金耐蚀性增强;浸泡10h后,空白H2SO4溶液中几乎没有电感存在,缓蚀剂体系中均存在电感,其中MBIH体系中电感最大,BTA次之,8Q中最小,说明缓蚀剂能够对钝化膜起到保护及修复作用。
为了研究这三种有机物对L Y12CZ铝合金在酸性溶液中的缓蚀机理,进行了 SEM/EDS分析。图9显示了高倍显微镜下L Y12CZ铝合金中的主要析出相。一种是粗大且颜色较浅的相,形状为多边形(如图9中“1”所指),经成分面扫描可知其为富含 Fe,Si的杂质相,由于比铝基体电位正,一般不会氧化。另一种为尺寸较小且颜色较深的相(如图9中“2”所指),经成分面扫描及铝合金金相图谱分析,其富含Cu,为S相(CuMgAl2)或θ相(CuAl2)与α(Al)的共晶相,它们在铝合金的腐蚀过程中都起阴极作用。
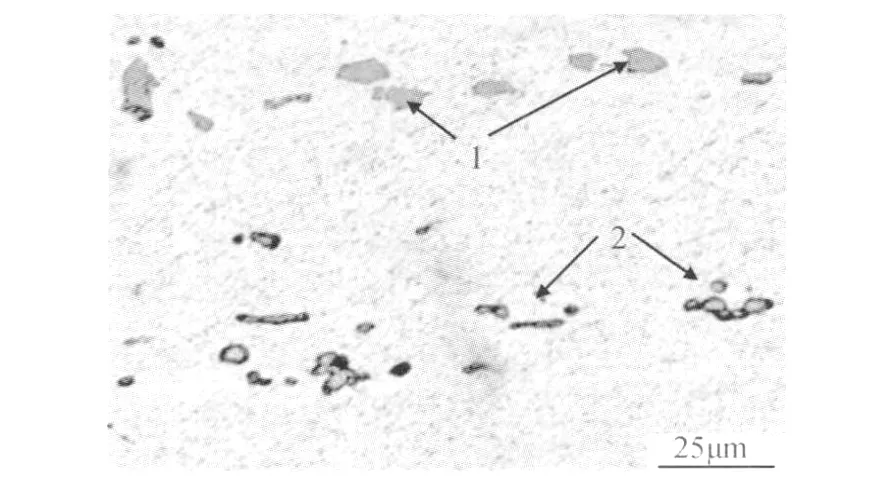
图9 LY12CZ铝合金表面的SEM照片Fig.9 SEM micrograph of the LY12CZ aluminum alloy surface
图10显示了在三种缓蚀剂体系中浸泡2h后,L Y12CZ铝合金表面上S相的微观形貌。可以看到,MBIH体系中 S相上的吸附物非常致密,像一块整体覆盖在颗粒表面,EDS分析得此物质含有N,应为MBIH,这与文献中所述MBIH能吸附在Cu表面一致[15]。苯并三氮唑体系中,S相上的吸附物也比较致密,且呈链状分布,EDS分析得此物质中含有N,应为BTA,文献中亦有描述BTA能够与Cu原子形成共价键和配位键[15],相互多替成链状聚合物,在Cu表面组成多层保护膜,起到耐蚀作用。8-羟基喹啉体系中,吸附在S相上的粒子比较分散,明显不如前两者致密;在S相附近的基体上也吸附有该粒子,EDS分析得此物质含有N,应为8Q。有文献指出[6,13]:8Q能与Cu,Mg,Al形成难溶的螯合物 Cu(C9H6ON)2,Mg(C9H6ON)2和 Al(C9H6ON)3,这也证实了8Q能同时吸附在S相及Al基体表面而起到一定缓蚀作用,但是阳极的溶液脱落可能引起8Q的脱落,使缓蚀效果受到一定的影响,图10(c)中颗粒周围出现一道明显的凹槽,说明已经发生了一定程度的腐蚀。

图10 浸泡在三种缓蚀剂体系中2h后L Y12CZ铝合金表面颗粒处SEM照片(a)MBIH;(b)BTA;(c)8QFig.10 SEM micrographs of the particles of the L Y12CZ aluminum alloy immersed for 2h in H2SO4solution(a)MBIH;(b)BTA;(c)8Q
3 结论
(1)2-巯基苯并噻唑、苯并三氮唑及8-羟基喹啉均能够抑制L Y12CZ铝合金在酸性溶液中的腐蚀,缓蚀效果为2-巯基苯并噻唑>苯并三氮唑>8-羟基喹啉。但随着浸泡时间的延长,缓蚀效率有所下降。
(2)2-巯基苯并噻唑和苯并三氮唑能够选择性吸附在L Y12CZ铝合金表面S相残留物及杂质相表面,形成难溶物,抑制腐蚀反应的阴极过程,从而为L Y12CZ铝合金在酸性溶液中的腐蚀提供良好的保护。8-羟基喹啉能够吸附在整个铝合金的表面,但随着阳极溶解的进行,吸附层遭到破坏,从而影响了其缓蚀效果。
[1] LIU Z,CHONG P H,BUTT A T,et al.Corrosion mechanism of laser-melted AA 2014 and AA 2024 alloys[J].Applied Surface Science,2005,247(1-4):294-299.
[2] BUCHHEIT R G,GRANT R P,HLAVA P F,et al.Local dissolution phenomena associated with S phase(Al2CuMg)particles in aluminum alloy 2024-T3[J].Journal of the Electrochemical Society,1997,144(8):2621-2644.
[3] SZKLARSKA-SMIALOWSKA Z.Pitting corrosion of aluminum[J].Corrosion Science,1999,41(9):1743-1767.
[4] CAMPESTRINI P,WESTING E P M VAN,ROOIJ EN H W VAN,et al.Relation between microstructural aspects of AA2024 and its corrosion behaviour investigated using AFM scanning potential technique[J].Corrosion Science,2000,42(11):1853-1861.
[5] CAMPESTRINI P,TERRYN H,HOVESTAD A.Formation of a cerium-based conversion coating on AA2024:relationship with the microstructure[J].Surface and Coatings Technology,2004,176(3):365-381.
[6] YASAKAUKIRYLA,ZHELUDKEYVICHMIKHAILL.Mechanism of corrosion inhibition of AA2024 by rare earth compounds[J].Journal of Physical Chemistry,2006,110(11):5515-5528.
[7] MISHRA AJIT KUMAR,BALASUBRAMANIAM R.Corrosion inhibition of aluminium by rare earth chlorides[J].Materials Chemistry and Physics,2007,103(2-3):385-393.
[8] ALLACHI H,CJAOIKET F,DRAOUI K.Corrosion inhibition of AA6060 aluminium alloy by lanthanide salts in chloride solution[J].Journal of Alloys and Compounds,2009,475(1-2):300-303.
[9] BETHENCOURT M,BOTANA FJ,CALVINO J J.Lanthanide compounds as environmentally-friendly corrosion inhibitors of aluminium alloys:a review[J].Corrosion Science,1998,40(11):1803-1819.
[10] BLIN F,KOUTSOU KOS P,KLEPETSIANIS P,et al.The corrosion inhibition mechanism of new rare earth cinnamate compounds-electrochemical studies[J].Electrochimica Acta,2007,52(21):6212-6220.
[11] DAVO’B,DAMBORENEA DE JJ.Use of rare earth salts as electrochemical corrosion inhibitors for an Al-Li-Cu(8090)alloy in 3.56%NaCl[J].Electrochimica Acta,2004,49(27):4957-4965.
[12] GARRIGUES L,PEBERE N,DABOSI F.An investigation of the corrosion inhibition of pure aluminum in neutral and acidic chloride solutions[J].Electrochimica Acta,1996,41(7-8):1209-1215.
[13] LI Song-mei,ZHANG Hong-rui,LIU Jian-hua.Corrosion behavior of aluminum alloy 2024-T3 by 8-hydroxy-quinoline and its derivative in 3.5%chloride solution[J].Transactions of Nonferrous Metals Society of China,2007,17:318-325.
[14] CARRON KEITH T,XUE GI,LEWIS MARYL.A surface enhanced Raman spectroscopy study of the corrosion-inhibiting properties of benzimidazole and benzotriazole on copper[J].Langmuir,1991,7(1):2-4.
[15] ZHELUDKEVICH M L,YASAKAU K A,POZNYAK SK,et al.Triazole and thiazole derivatives as corrosion inhibitors for AA2024 aluminium alloy[J].Corrosion Science,2005,47(12):3368-3383.
[16] TAVAKOLI H,SHAHRABI T.Synergistic effect on corrosion inhibition of copper by sodium dodecylbenzenesulphonate(SDBS)and 2-mercaptobenzoxazole[J].Materials Chemistry and Physics,2008,109(2-3):281-286.
[17] SAYED S,ABD EL REHIM.The corrosion inhibition of aluminum and its copper alloys in 1.0M H2SO4solution using linearsodium dodecyl benzene sulfonate as inhibitor[J].Materials Chemistry and Physics,2008,112(3):898-906.
[18] BESSONE J,MAYER C,LUTTNER K,et al.AC-impedance measurements on aluminium barrier type oxide films[J].Electrochimica Acta,1983,28(2):171-175.
[19] WIT DE H J,WIJ ENBERGE C,CREVECOEUR C.Impedance measurements during anodization of aluminum[J].Journal of the Electrochemical Society,1979,126(5):779-785.
[20] BESSONEJ B,SALINAS D R,MAYER C,et al.An EIS study of aluminium barrier-type oxide films formed in different media[J].Electrochimica Acta,1992,37(12):2283-2290.
[21] LENDERINK H J W,LINDEN M V D,WIT DE H J.Corrosion of aluminium in acidic and neutral solutions[J].Electrochimica Acta,1989,38(14):1989-1992.
Three Organic Corrosion Inhibitors on L Y12CZ Aluminum Alloy in Acid Solution
LIU Jian-hua,SHENG Hua,LI Ming,LI Song-mei,YU Mei
(School of Materials Science and Engineering,Beihang University,Beijing 100191,China)
The inhibiting effect of three organic compounds on the corrosion of L Y12CZ aluminum alloy in 0.5M H2SO4solution was investigated.The organic compounds are 2-mercaptobenzoxazole(MBIH),benzotriazole(BTA)and 8-hydroxy-quinoline(8Q).The inhibiting effect to the corrosion dynamics of L Y12CZ aluminum alloy in 0.5M H2SO4solution was evaluated by using mass loss method and the corrosion morphology was observed by using optical microscopy(OM),scanning electron microscopy coupled with energy dispersive spectroscopy(SEM/EDS).Electrochemical impedance spectroscopy(EIS)and potentiodynamic polarization were used to study the inhibiting mechanism.The results show that MBIH,BTA and 8Q all provide anti-corrosion protection for L Y12CZ aluminum alloy by forming a thin organic layer of insoluble complexes on the surface of the alloy.Their inhibitive properties are given by the following order:MBIH>BTA>8Q.MBIH and BTA provide anticorrosion protection by absorbing selectively on the corrosion active intermetallic zones and suppressing the cathode processes of corrosion reaction.The whole surface of the alloy was absorbed by 8Q to form chelate 8Q complexes,but the absorbed layer was destroyed as the anode dissolution.
L Y12CZ aluminum alloy;inhibitor;acid solution;corrosion dynamics;selective adsorption
TG174.42
A
1001-4381(2011)05-0041-07
2009-07-20;
2010-07-20
刘建华(1957—),男,教授,从事材料腐蚀与防护方面研究工作,联系地址:北京航空航天大学材料科学与工程学院103教研室(100191),E-mail:liujh@buaa.edu.cn

