人单链白细胞介素12的原核表达和生物学活性鉴定*
周鹤峰,邵 敏,姬可平,葛正龙
(1.遵义医学院珠海校区生物工程系,广东珠海519041;2.遵义医学院生物化学教研室,贵州遵义563003)
人单链白细胞介素12的原核表达和生物学活性鉴定*
周鹤峰1,邵 敏1,姬可平1,葛正龙2△
(1.遵义医学院珠海校区生物工程系,广东珠海519041;2.遵义医学院生物化学教研室,贵州遵义563003)
目的 构建含人单链白细胞介素12(hscIL-12)基因的原核表达载体,在大肠杆菌中表达具有活性的hscIL-12。方法 PCR法从质粒pCA13-hscIL-12中扩增hscIL-12基因,经酶切、连接构建原核表达载体pET28a(+)-hscIL-12,转入到大肠杆菌BL21(DE3)中,用异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达,收集菌液进行蛋白质印迹分析,经镍柱亲和层析(Ni2+-NTA)纯化,体外增殖实验检测其生物学活性。结果 PCR扩增、双酶切及DNA序列测定证实pET28a(+)载体上成功插入了hscIL-12基因片段。表达产物经SDS-PAGE电泳分析,证明其相对分子质量为70×103;蛋白质印记表明重组蛋白具有hscIL-12抗原活性;表达产物纯化、复性后进行体外生物学活性实验表明,该重组蛋白能刺激外周血单核细胞(PBMC)产生IFN-γ。结论 pET28a(+)-hscIL-12原核表达载体的构建和重组hscIL-12蛋白的制备为进一步研究hscIL-12生物学功能和临床应用奠定了基础。
人单链白细胞介素12;大肠杆菌;生物学活性;表达
白细胞介素12(interleukin 12,IL-12)又名自然杀伤细胞刺激因子(NKSF),或称为细胞毒淋巴细胞成熟因子(CLMF),它是由抗原呈递细胞,如巨噬细胞、B淋巴细胞等在免疫应答过程中产生的具有多种生物学活性细胞因子。它能促进T细胞和自然杀伤细胞的增殖,诱导干扰素(IFN)-γ等多种细胞因子的产生,调节Th0细胞向Th1细胞分化发育,具有较强的抗肿瘤、抗病毒、抗感染的作用[1]。IL-12是由P40和P35两个亚基通过二硫键构成的异二聚体细胞因子[2],只有当这两个亚基形成异源二聚体时,IL-12分子才具有生物活性[3],单个P40或P35亚基的过量表达还会产生活性抑制作用[4]。本实验使用的人单链IL-12(human single chain IL-12,hscIL-12)全长基因由编码P40和P35的2个基因经一段接头序列连接而成,用其构建原核表达载体,经大肠杆菌BL21进行诱导表达并获得了有活性的重组hscIL-12,为进一步研究hscIL-12生物学功能和临床应用奠定了基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 质粒 pCA13-hscIL-12、原核表达载体pET28a(+)、大肠杆菌DH5α、BL21(DE3)由本室保存。
1.1.2 试剂 限制性核酸内切酶、T4DNA连接酶为TaKaRa公司产品;高保真即用PCR扩增试剂盒、UNTQ-10柱式DNA胶回收试剂盒为上海生工生物工程公司产品;镍离子亲和层析柱(Ni2+-NTA)购自Qiagen公司;ECL化学发光试剂盒试剂盒购自武汉博士德公司;鼠抗人IL-12单克隆抗体购自R&D公司;羊抗鼠IgG-辣根过氧化物酶(HRP)购自武汉博士德公司;IL-12国际标准品、人IFN-γ酶联免疫吸附法(ELISA)试剂盒购自R&D公司;其余化学试剂均为国产分析纯。
1.1.3 寡核苷酸引物设计与合成 根据GenBank中hsdlL-12的cDNA序列设计引物,由上海生工生物工程公司完成。上游引物:5′-CTAGCT AGCATG GGT CAC CAG CAG T-3′(划线部分为NheⅠ酶切位点),下游引物:5′-ACCGGAG CTCTTA GGA AGC ATT CAG-3′(划线部分为SacⅠ酶切位点)。
1.2 方法
1.2.1 hscIL-12的 PCR 扩增 以质粒pCA13-hscIL-12为模板,在50μL反应体系中,加入上、下游引物各3μL,模板pCA13-hscIL-12 1μL,2×PCR Master 25μL,扩增条件为94℃预变性10min,94℃变性1min,62℃退火1min,72℃延伸2min,30个循环,72℃延伸8min。PCR产物经琼脂糖凝胶电泳观察结果。
1.2.2 重组原核表达质粒的构建和鉴定[5]PCR产物与表达载体pET28a(+)分别用限制性内切酶NheⅠ和SacⅠ双酶切后,用回收试剂盒回收,连接回收的目的基因与原核表达载体片段,并转化感受态DH5α,挑取阳性菌落进行扩增并小量提取质粒进行酶切鉴定。鉴定阳性的菌株送上海生工进行生物工程公司测序。
1.2.3 hIL-12蛋白的诱导表达及纯化 将测序正确的质粒转化BL21(DE3)感受态细胞,筛选阳性克隆。将阳性克隆接种于含卡那霉素的LB液体培养基,37℃培养至OD(600)为0.5,经异丙基-β-D-硫代半乳糖苷(IPTG),终浓度为1mmol/L,进行诱导表达4h[6],菌液离心弃上清,超声裂解菌体,收集上清及裂解物沉淀行SDS-PAGE电泳。彻底溶解裂解物沉淀,用镍柱亲和层析法Ni2+-NTA纯化目的蛋白,按照Qiagen公司Ni2+-NTA使用说明书进行,纯化蛋白经过透析复性,SDS-PAGE电泳和薄层扫描分析蛋白纯度,对蛋白进行冻干保存准备用于活性检测。
1.2.4 蛋白质印迹分析 将上述诱导后的裂解菌液进行SDS-PAGE电泳后,参考文献[7]进行,电转移至PVDF膜上,用5%脱脂奶粉封闭1h,磷酸盐缓冲液(PBS)洗涤;与一抗室温反应2h,PBS洗涤;与HRP标记的二抗室温反应2h,洗涤;用ECL试剂室温孵育1min,进行暴光、显影和定影。以未经诱导的细菌裂解液和用空载体转化的细菌诱导物作对照。
1.2.5 重组蛋白生物学活性测定 分离人外周血单个核细胞(PBMC),用含10%胎牛血清的RPMI1640培养基调整活细胞浓度为1×106个/mL,向96孔板中每孔加入细胞悬液100μL。将标准品用含10%胎牛血清的RPMI1640培养基稀释成2ng/mL,原核表达的不同浓度的重组hscIL-12蛋白,分别按每孔100μL加入含有细胞悬液的96孔板中,每组设3个复孔,置37℃、5%CO2培养箱中孵育24h后,收集上清液用ELISA试剂盒测定IFN-γ的含量,操作步骤按试剂盒说明书完成。
1.3 统计学处理 所有数据用SPSS11.5统计软件进行统计学分析,计量资料用±s表示,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 原核表达载体 pET28a(+)-hscIL-12的鉴定 以质粒pCA13-hscIL-12为模板,PCR扩增hscIL-12cDNA。将hscIL-12克隆入pET28a(+)中,构建重组原核表达载体pET28a(+)-hscIL-12,重组质粒经PCR扩增和 NheⅠ、SacⅠ双酶切鉴定,可见大小约1 600bp的条带,经测序证实结果正确,表明原核表达载体构建成功,见图1。
2.2 重组蛋白的表达与纯化 将重组基因工程菌经IPTG诱导,超声裂解后,对全菌裂解液进行SDS-PAGE分析,相对分子量为70×103的外源蛋白表达水平大大提高,该蛋白质的相对分子质量与hscIL-12融合蛋白理论相对分子质量一致,见图2,镍柱亲和层析后获得了纯度在95%以上的hscIL-12蛋白。
2.3 重组蛋白质印迹鉴定 蛋白质印迹分析表明,经IPTG诱导后的菌体裂解液能与抗体发生特异反应,经ECL显色,曝光,胶片上在相对分子质量为70×103处出现特异性反应条带,见图3,与目的蛋白带一致,而空载体未见显色反应。
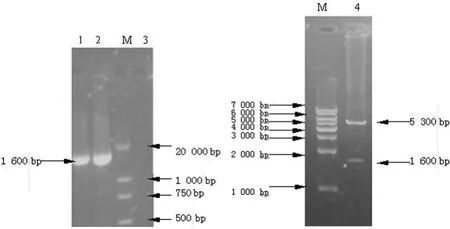
图1 pET28a(+)-hscIL-12的PCR和酶切鉴定
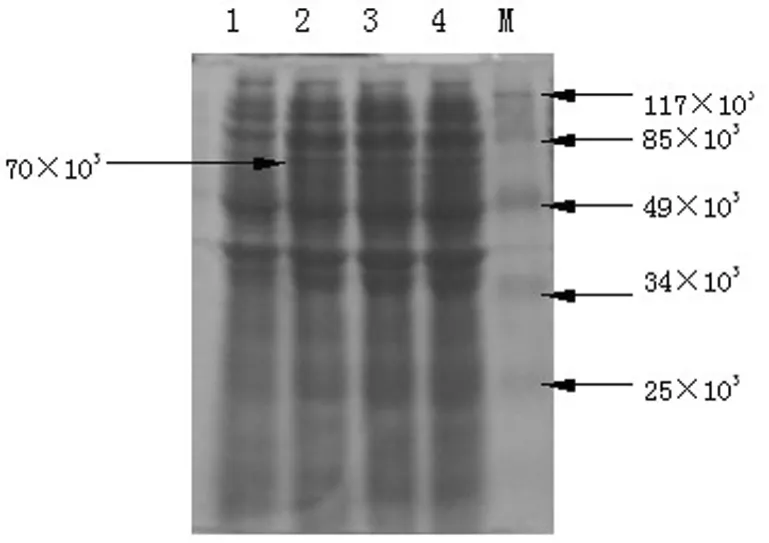
图2 pET28a(+)-hscIL-12在大肠杆菌BL21(DE3)中表达的SDS-PAGE分析
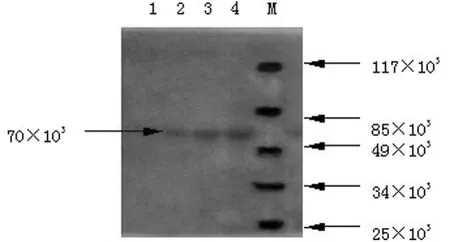
图3 诱导表达菌体的蛋白质印迹分析
2.4 hscIL-12生物活性测定 以浓度为5ng/mL的蛋白标准品和浓度分别为2、4和6ng/mL的重组hscIL-12蛋白作用于人PBMC,同时以PBS作为对照,检测IFN-γ表达量分别为(712.5±37.5)pg/mL、(243.8±11.9)pg/mL、(467.6±32.1)pg/mL、(746.2±39.5)pg/mL,PBS对照组表达量为(21.5±8.6)pg/mL。经统计学处理,标准品和不同浓度梯度原核表达的hscIL-12分别与PBS空白对照组相比,差异有统计学意义(P<0.01),表明原核表达的hscIL-12能够促进PBMC产生IFN-γ,证明重组原核表达载体能够表达有生物活性的hscIL-12。
3 讨 论
IL-12是一种重要的细胞因子,由P40和P35 2个亚基经二硫键共价结合而成的异源二聚体[8]。一级结构P40有306个氨基酸,含4个理论糖基化位点和10个半胱氨酸;P35有197个氨基酸,含3个理论糖基化位点和7个半胱氨酸[9]。hs IL-12是一个多功能的免疫调节因子,具有较强的抗肿瘤和抗转移的作用[10],而且不良反应小。
提高蛋白表达量的首要因素,是选择适合的载体与宿主菌[11]。本研究选用了T7表达系统中的pET28a表达载体。pET系列载体以T7为启动子,可使目的基因得到高效转录与翻译。由于该表达系统在目的表达产物的N端融合了一段6个组氨酸标签序列,有利于天然条件下用金属鳌合层析进行融合蛋白的纯化,本实验使用Ni2+-NTA纯化目的蛋白,Ni2+与组氨酸结合,在纯化过程中分辨率高、选择性好、操作方便,可获得的重组蛋白纯度高。而组氨酸标签相对分子质量小,无生物活性,一般对重组蛋白的功能无影响。与其他表达系统相比,大肠杆菌表达系统蛋白表达量高,容易纯化,且具有遗传背景清楚、成本低、培养周期短、抗污染能力强等特点[12]。
本实验成功将hscIL-12克隆入原核表达载体pET28a(+)中,在大肠杆菌BL21(DE3)获得高效表达。表达产物以包涵体的形式存在,包涵体的形成,可使在胞内表达的外源蛋白不易被细菌的蛋白酶所降解,同时也有利于重组蛋白的分离纯化。包涵体经过洗涤、溶解、Ni2+-NTA纯化以及蛋白质的复性等步骤后,获得了纯度约为95% 的重组hscIL-12蛋白,蛋白质印迹表明重组蛋白具有hscIL-12抗原活性。经纯化、复性后的表达产物进行体外实验表明,表达hscIL-12能刺激PBMC产生IFN-γ,提示该重组蛋白具有生物学活性。本研究成功实现hscIL-12蛋白在原核系统中的表达,为其进一步的理论研究和临床应用奠定基础。
[1] Cao XF,Leonard K,Lynne I,et al.Interleukin 12stimulates IFN-mediated inhibition of tumor-induced regulatory T-cell proliferation and enhances tumor clearance[J].Cancer Res,2009,69:8700-8709.
[2] Zhang C,Zhang J,Niu J,et al.Interleukin-12improves cytotoxicity of natural killer cells via upregulated expression of NKG2D[J].Hum Immunol,2008,69(8):490-500.
[3] Nascimento DS,do Vale A,Tomas AM,et al.Cloning,promoter analysis and expression in response to bacterial exposure of sea bass(Dicentrarchus labrax L.)interleukin-12p40and p35subunits[J].Mol Immunol,2007,44(9):2277-2291.
[4] 陈坚,薛绪潮,方国恩,等.米非司酮调控的单链鼠白介素12真核表达载体的构建及鉴定[J].生物学杂志,2008,25(6):17-21.
[5] 徐林,张风,周涯,等.小鼠CD25分子胞外段的原核表达载体的构建及表达鉴定[J].第三军医大学学报,2010,32(3):278-281.
[6] 钟俐强,杨斯皓,贾钰铭,等.pGEX-4T-2-TK原核表达质粒的构建及其表达[J].重庆医学,2010,39(9):1036-1038.
[7] 王彦,吴奎,毕玉田,等.FasL和Der p2双基因共表达真核表达载体的构建及其在树突状细胞中的表达[J].重庆医学,2010,39(20):2697-2699
[8] Lesinski GB,Badgwell B,Zimmerer J,et al.IL-12pretreatments enhance IFN-alpha-induced Janus kinase-STAT signaling and potentiate the antitumor effects of IFN-alpha in a murine model of malignant melanoma[J].J Immunol,2004,172(12):7368-7376.
[9] Sinclair G,Choy FYM.Synonymous codon usage bias and the expression of human glucocerebrosidase in the methylotrophic yeast,pichia pastoris[J].Protein Expr Purif,2002,26(1):96-105.
[10] Takeda K,Suzuki T,Shimada SI,et al.Interleukin-12is involved in the enhancement of human natural killer cell activity by Lactobacillus casei Shirota[J].Clin Exp Immunol,2006,146(1):109-115.
[11] Knutson KL,Disis ML.IL-12enhances the generation of tumour antigen-specific Th1CD4Tcells during ex vivo expansion[J].Clin Exp Immunol,2004,135(2):322-329.
[12] Nemeckova S,Sroller V,Hainz P,et al.Experimental therapy of HPV16induced tumors with IL12expressed by recombinant vaccinia virus in mice[J].Int J Mol Med,2003,12(5):789-796.
Prokaryotic expression and bioactivity identification of single chain human interleukin-12*
Zhou Hefeng1,Shao Min1,Ji Keping1,Ge Zhenglong2△
(1.Department of Bioengineering,Zhuhai Campus,Zunyi Medical College,Zhuhai,Guangdong519041,China;2.Department of Biochemistry,Zunyi Medical College,Zunyi,Guizhou563003,China)
Objective To construct the expression vector of human single chain interleukin-12(hscIL-12)gene.It can express hscIL-12with bioactivity in escherichia coli.Methods hscIL-12gene was amplified from recombinant pCA13-hscIL-12.With restricted enzyme digestion,gene of interest was cloned into the prokaryotic vector pET28a(+)to construct expressing plasmid of pET28a(+)-hscIL-12.After pET28a(+)-hscIL-12was transformed into escherichia coli BL21(DE3),the bacteria were induced by IPTG.The expression of hscIL-12was detected by Western bloting.The hscIL-12protein was purified by Ni-NTA affinity chromatography.The bioactivity of hscIL-12was detected by PHA-activated peripheral blood mononuclear cell(PBMC)proliferation assay.Results PCR and restriction enzyme digestion and DNA sequencing indicated that hIL-12gene was inserted into the procaryotic expression vector pET28a(+),SDS-PAGE analysis showed that molecular weight of the expressed protein was 70×103;Western blotting analysis showed that recombinant protein had the antigenicity of hscIL-12.The purified hscIL-12protein had the bioactivities in stimulating the IFN-γproduction of human PBMC.Conclusion The construction of the recombinant plasmid and the preparation of the active protein of hscIL-12have laid a foundation for further studying the function and clinical applications of hscIL-12.
interleukin-12;escherichia coli;bioactivity;expression
10.3969/j.issn.1671-8348.2011.31.002
A
1671-8348(2011)31-3124-03
贵州省科委重大攻关项目(2004NGZ002);贵州省教育厅重点项目(2004118)。△
,Tel:(0852)8608572;E-mail:zbngge@hotmail.com。
2011-05-09
2011-07-14)

