高效液相色谱法测定南、北五味子中4种木脂素含量
阴冠秀,杜 冰,*,鲁旺旺,华洋林,唐 建,杨公明
(1.华南农业大学食品学院,广东 广州 510642;2.无限极(中国)有限公司,广东 广州 510665)
高效液相色谱法测定南、北五味子中4种木脂素含量
阴冠秀1,杜 冰1,*,鲁旺旺1,华洋林2,唐 建2,杨公明1
(1.华南农业大学食品学院,广东 广州 510642;2.无限极(中国)有限公司,广东 广州 510665)
目的:采用高效液相色谱法同时测定17种不同产地的五味子中五味子醇甲、五味子醇乙、五味子甲素和五味子乙素含量。方法:采用Diamonsil C18(250mm×4.6mm,5μm)柱,甲醇-水(73:27,V/V)作流动相,流速1.0mL/min,检测波长254nm。结果:五味子醇甲、五味子醇乙、五味子甲素和五味子乙素含量测定方法的线性关系良好,线性范围为0.01~0.08mg/mL,相关系数R2>0.9990;RSD分别为0.86%、0.37%、0.19%和0.15%。结论:该方法精密度、重现性和分离效果好,分析快速准确,适合于该药材中五味子醇甲、五味子醇乙、五味子甲素和五味子乙素含量的测定;不同产地的4种木脂素成分均存在一定的差别,北五味子中五味子醇甲、五味子醇乙和五味子乙素的含量稍高,而五味子甲素含量却稍低,南五味子恰与之相反。
南五味子;北五味子;高效液相色谱;木脂素
五味子是著名的滋补性中药,因产地不同,有南、北五味子之分,分别为木兰科植物华中五味子(Schisandra sphenanthera Rehd.et Wils.)和五味子(Schisandra chinensis (Turcz.) Baill.)的干燥成熟果实,都具有收敛固涩、益气生津、补肾宁心的功效[1-2]。
五味子中含有的联苯环辛二烯结构的木脂素类物质是其主要的生物活性成分,主要包括五味子醇甲、五味子醇乙、五味子甲素、五味子乙素等[3],此类物质对中枢神经系统有抑制作用,还具有抗艾滋病毒、抑菌、抗肿瘤和PAF拮抗等多种活性[4-12],并且其对清除自由基也有一定的效果等[13-14]。
本实验以南、北五味子中的五味子醇甲、五味子醇乙、五味子甲素和五味子乙素作为研究对象,利用高效液相色谱法,对17个产地的南、北五味子中的4种木脂素进行色谱分离和含量测定。该方法简单、快速、准确,可为南北五味子的质量控制提供依据。
1 材料与方法
1.1 材料、试剂与仪器
8个南五味子样品来源于云南、四川、湖北Ⅰ、湖北Ⅱ(湖北神农架)、安徽、河南、陕西、广西;9种北五味子来源于吉林长白山、辽宁鞍山、辽宁本溪、辽宁抚顺、黑龙江、内蒙古、辽宁Ⅰ、辽宁Ⅱ、辽宁Ⅲ。
五味子醇甲、五味子甲素和五味子乙素对照品(批号分别为110857-200709、110764-200609、110765-200710)中国药品生物制品鉴定所;五味子醇乙 四川维克奇生物科技有限公司;甲醇(色谱纯) 美国Fisher公司;自制超纯水;其余试剂均为分析纯。
LC-10AT型高效液相色谱仪、SPD-10Avp紫外检测器 日本岛津公司;四两装高速中药粉碎机 瑞安市环球药械厂;电子精密天平、pH计 梅特勒-托利多仪器上海有限公司;SH2-88台式水浴恒温振荡器 江苏太仓市实验设备厂;超声波清洗器 昆山禾创超声仪器有限公司;SHZ-III型循环水真空泵 上海亚荣生化仪器厂。
1.2 原料预处理
将不同产地的五味子干果烘干后,除杂、粉碎成粉后备用。
1.3 色谱条件的选择
采用Diamonsil C18(250mm×4.6mm,5μm)色谱柱,检测波长为254nm,柱温为室温,进样体积20μL,流速为1.0mL/min。分别考察不同比例的甲醇-水作为流动相时对分离效果的影响[15-16]。
1.4 样品处理
精密称取不同产地五味子粉末(40目)0.5g,置于50mL锥形瓶中,加甲醇约45mL超声提取(功率280W,频率40kHz)20min,放冷,摇匀,过滤后加甲醇于50mL容量瓶定容,精密吸取供试品20μL进行液相测定。
1.5 标准溶液的配制
精密称取五味子醇甲、五味子醇乙、五味子甲素和五味子乙素对照品各10mg,分别加甲醇溶解于50mL容量瓶中定容,摇匀,使之成为质量浓度为0.20mg/mL的混合标准品溶液。分别精密吸取一定体积上述混标溶液到10mL的容量瓶中,加甲醇稀释至刻度,按照1.3节中确定的色谱条件,进行液相色谱分析,绘制标准曲线。
1.6 方法学考察
分别对所建立测定方法的稳定性、重现性、精密度、回收率进行评价。
1.7 样品测定
按1.4节样品处理方法对17个不同产地的五味子进行处理,进行液相色谱分析,进样量20μL,采用外标法定量,测定不同产地五味子中4种木脂素的含量。
2 结果与分析
2.1 色谱条件的确定
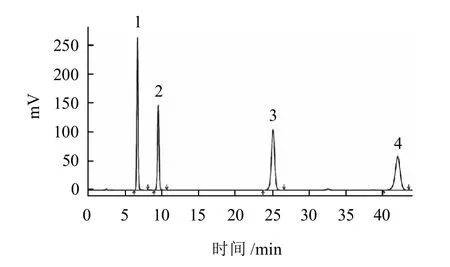
图1 4种木脂素对照品扫描图Fig.1 HPLC chromatogram of four lignin standards
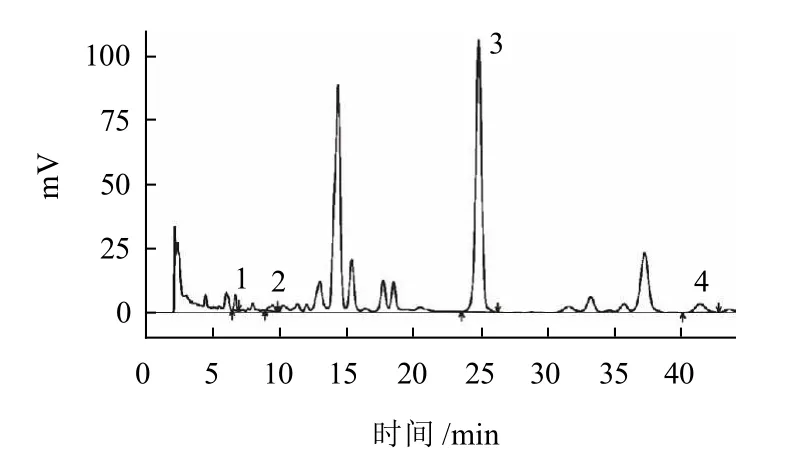
图2 南五味子(云南)色谱图Fig.2 HPLC chromatogram of Schisandra sphenanthera (Yunnan)

图3 北五味子(吉林长白山)色谱图Fig.3 HPLC chromatogram of Schisandra chinensis (Changbai Mountain, Jilin)
实验结果表明:当选用甲醇-水(73:27,V/V)作流动相时,可以使待测定的4种木脂素与其相邻的物质得到较好的分离,各木脂素的对照品色谱图如图1所示,南五味子和北五味子样品色谱图分别如图2、3所示。
由图1~3可以看出,各对照品和样品的出峰时间基本一致,而且样品中待测的四种木脂素均与其相邻物质能够较好的分离。因此确定其流动相为甲醇-水(73:27,V/V)。
2.2 线性范围的考察
分别量取上述不同浓度的混合对照品溶液各20 μ L进行液相测定,以各木脂素相应的峰面积为纵坐标,各木脂素的质量浓度为横坐标,得到各木脂素质量浓度-峰面积线性回归方程如下:
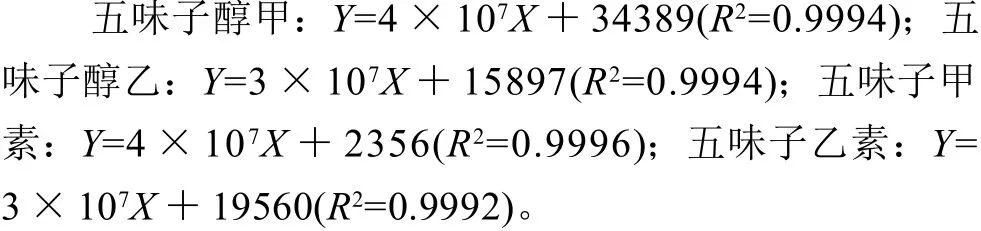
以上结果表明混合对照品溶液在0.01~0.08mg/mL内呈现良好的线性关系。
2.3 稳定性实验
取同一供试品溶液分别在0、3、6、9、12h进样20μL测定五味子醇甲、五味子醇乙、五味子甲素和五味乙素的峰面积,相对标准偏差(RSD)依次为1.42%、1.07%、1.45%和1.99%。表明供试品溶液在12h内基本稳定。
2.4 重现性实验
精密称取5份辽宁Ⅰ的五味子粉样品,样品按照1.4节方法处理,进样分析,分别测定五味子醇甲、五味子醇乙、五味子甲素和五味乙素的峰面积,相对标准偏差(RSD)依次为1.04%、1.60%、1.31%和1.53%。该结果表明方法重现性好。
2.5 精密度实验
取同一供试品溶液,按照2.1节色谱条件重复进样5次,测定五味子醇甲、五味子醇乙、五味子甲素和五味乙素的峰面积,相对标准偏差(RSD)依次为0.86%、0.37%、0.19%和0.15%。表明该方法精密度很高。
2.6 回收率实验
精密称取5份已知上述4种木脂素含量的五味子粉末约0.5g,分别精密加入混合标准品溶液5mL,按照1.4节样品处理方法制备供试品溶液,按照2.1节色谱条件进样分析,结果见表1。
由表1可知,本法测定五味子醇甲、五味子醇乙、五味子甲素和五味子乙素的平均回收率分别为97.64%、97.91%、98.50%和99.02%,RSD依次为0.7155%、1.020%、0.4678%和0.4074%。由此可知,该方法的回收率较高,偏差较小,准确度较高。
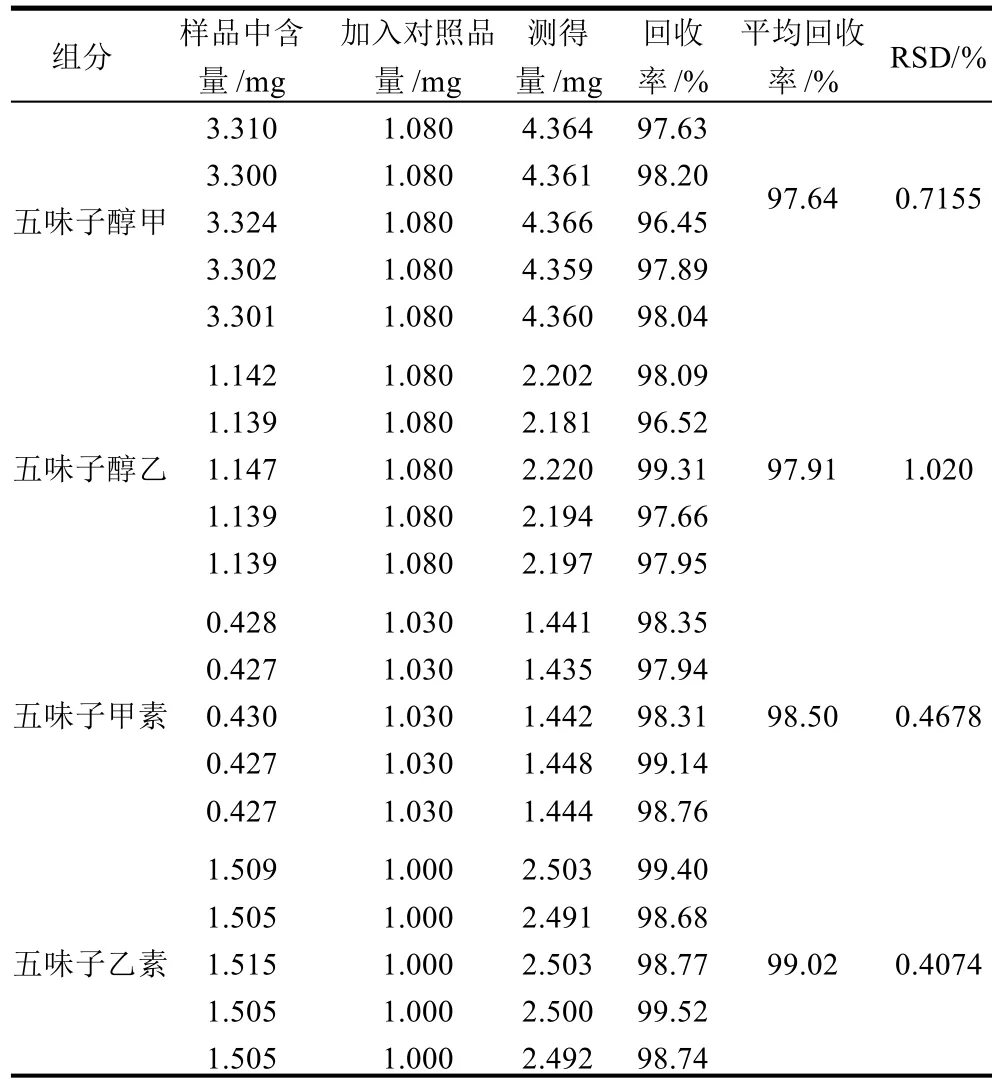
表1 回收率实验结果Table 1 Average recovery rate for four kinds of lignin in 5 samples
2.7 不同产地五味子中4种木脂素含量的测定
精密吸取五味子种子样品溶液20μL,按前述色谱条件进样分析,测定色谱峰面积,用外标法计算,测定结果见表2。
由表2可以看出,北五味子中五味子醇甲、五味子醇乙和五味子乙素的含量稍高,而五味子甲素含量却稍低,南五味子恰与之相反。同时可以看出,南五味子中这四种木脂素的总量都较低,最大的是产地四川的五味子达到1.067%;而北五味子中这四种木脂素的总量在1.274%~2.272%之间,该结果与文献[17-20]的结论较一致。
2.8 不同产地的五味子外观比较
通过对实验中的南五味子样品与北五味子样品外形进行观察可知,南五味子的果实肉薄、粒小、干燥无油性、无光泽、整体品相较差,而北五味子的果实肉厚、粒大饱满、有油性、光泽好。
3 结 论
本实验采用高效液相色谱法,建立了测定南、北五味子中4种木脂素(五味子醇甲、五味子醇乙、五味子甲素及五味子乙素)的分析方法。分别对17个不同产地的南、北五味子样本进行色谱分析。结果表明,样品中各组分的色谱峰基本达到了基线分离。该方法重复性好、灵敏度高,可用于对五味子中上述4种木脂素的定性与定量。同时本实验结果可以为各地的五味子区域化种植提供参考。
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 化学工业出版社, 2005: 44.
[2] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 化学工业出版社, 2005: 169.
[3] 陈业高, 秦国伟, 谢毓元. 五味子科植物的木脂素成分[J]. 武汉植物学研究, 2001, 19(2): 158-168.
[4] LEE I S, JUNG K Y, OH S R, et al. Platelet-activating factor antagonistic activity and 13C NMR assignment of pregomisin and chamigrenal from Schisandra chinensis[J]. Arch Pharmacal Res, 1997,20(6): 633-636.
[5] 孙成仁, 彭正松. 北五味子的抑菌作用[J]. 四川师范学院学报: 自然科学版, 1993, 14(3): 200-202.
[6] 刘华英. 北五味子木脂素提取工艺及提取物抑菌作用的研究[D]. 长春: 吉林农业大学,2006.
[7] 王蒙, 刘红耀, 闫明, 等. 五味子乙素逆转膀胱肿瘤多药耐药的实验研究[J]. 中国医疗前沿, 2010, 5(23): 28-29.
[8] 李月珍, 刘志新, 赵富生, 等. 不同浓度五味子乙素对人胃癌细胞株MGC-803增殖、凋亡的影响[J]. 牡丹江医学院学报, 2010, 31(4):1-5.
[9] NISHIDA H, TATEWAKI N, NAKAJIMA Y, et al. Inhibition of ATR protein kinase activity by schisandrin B in DNA damage response[J].Nucleic Acids Research, 2009, 37(17): 5678-5689.
[10] CHEN N, CHUN P Y, KO K M. Schisandrin B enhances cerebral mitochondrial antioxidant status and structural integrity, and protects against cerebral ischemia/reperfusion injury in rats[J]. Biol Pharm Bull,2008, 31(7): 1387-1391.
[11] 李玲, 胡汛, 潘锵荣, 等. 五味子乙素对MRP介导的肿瘤多药耐药逆转作用的研究[J]. 同济大学学报: 医学版, 2006, 27(6): 19-23.
[12] 刘力生, 王勤, 郑荣梁, 等. 五味子乙素对小鼠免疫功能、腹水型肝癌细胞DNA合成和存活率的作用[J]. 兰州大学学报: 自然科学版,1990, 26(1): 55-59.
[13] 孙友敏, 张红雨. 五味子素清除自由基构效关系的理论解释[J]. 淄博学院学报: 自然科学与工程版, 2001, 3(2): 76-80.
[14] 刘虹, 地力拜尔, 姚志道. 五味子抗氧化作用的研究与临床应用展望[J]. 新疆医学, 2005, 35(4): 137-139.
[15] 卫生部. 保健食品检验与评价技术规范[M]. 北京: 化学工业出版社,2003: 298-299.
[16] 徐良梅, 燕昌江, 李建平, 等. 高效液相色谱法测定北五味子提取物中五味子甲素和乙素含量[J]. 分析仪器, 2008(2): 15-17.
[17] 陆兔林, 毛春芹, 路长珍, 等. 不同产地五味子药材中木脂素类成分比较[J]. 医学导报, 2009, 28(5): 547-549.
[18] 徐丽华, 梁春霞, 孙萌, 等. 不同部位、不同产地南五味子中木脂素类成分的比较[J]. 中草药, 2006, 37(11): 1735-1738.
[19] 刘桂丰, 牛遇达, 杨传平, 等. 不同产地五味子果实中甲素和乙素的差异性[J]. 生态学杂志, 2006, 25(11): 1421-1424.
[20] 郭春梅. 不同产地的五味子中五味子乙素含量测定[J]. 黑龙江医药,2003, 16(1): 6-7.
Determination of Lignins in Schisandra sphenanthera and Schisandra chinensis by High Performance Liquid Chromatography
YIN Guan-xiu1,DU Bing1,*,LU Wang-wang1,HUA Yang-lin2,TANG Jian2,YANG Gong-ming1
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China;
2. Infinitus (China) Co. Ltd., Guangzhou 510665, China)
Objective: To establish a HPLC method for the determination of schisandrin, schisandrol B, deoxyschizandrin and schisandrin B in Schisandra sphenanthera Rehd.et Wils. and Schisandra chinensis (Turcz.) Baill. from 17 growth areas. Methods:The chromatographic separation was carried out on Diamonsil C18 (250 mm× 4.6 mm, 5 μm) column using methanol-water (73:27, V/V) as the mobile phase at a flow rate of 1 mL/min. The detection wavelength was 250 nm. Results: A good linear relationship was achieved with a correlation coefficient in the range of 0.01 to 0.08 mg/mL (R2= 0.9990) and a RSD of 0.86%, 0.37%,0.19% and 0.15%, respectively. Conclusion: The developed HPLC method reveals a good separation efficiency, reproducibility and accuracy. This method can be used for determining schisandrin, schisandrol B, deoxyschizandrin and schisandrin B in herbs.Higher amounts of schisandrin, schisandrol B and schisandrin B are present in Schisandra chinensis than in Schisandra sphenanthera.
Schisandra sphenanthera Rehd.et Wils.;Schisandra chinensis (Turcz.) Baill.;high performance liquid chromatography (HPLC);lignin
R284.1
A
1002-6630(2011)10-0218-04
2010-07-26
阴冠秀(1984—),女,硕士研究生,研究方向为农产品加工与贮藏。E-mail:yin.gx@163.com
*通信作者:杜冰(1973—),男,副教授,博士,研究方向为食品生物技术。E-mail:gzdubing@163.com

