氧载体在黄原胶发酵中的应用
林 琳,邓 春,龙 柯,程 蓉,张永奎
(四川大学化工学院制药与生物工程系,四川成都 610065)
氧载体在黄原胶发酵中的应用
林 琳,邓 春,龙 柯,程 蓉,张永奎*
(四川大学化工学院制药与生物工程系,四川成都 610065)
黄原胶发酵过程中因发酵液粘度逐渐增加,系统供氧不足,导致黄原胶产率受到影响。为改善发酵系统供氧情况,提高黄原胶产率,本实验研究添加氧载体(大豆油、正己烷、正十二烷)对黄原胶发酵的影响。实验结果表明:发酵初期添加6%(v/v)大豆油、发酵12h添加1%(v/v)正己烷,发酵72h,可分别显著提高黄原胶产率至2.347%和2.927%,相对于空白组分别提高18%和47%;另外,实验发现:大豆油组细胞干重有明显提高,发酵72h后,仍能观察到部分形态正常的细胞,延长发酵周期至84h,黄原胶产率显著提高至2.977%,相对于空白组提高49%;正己烷组发酵72h,多数细胞自溶,延长发酵周期不能进一步提高黄原胶产率,但加入正己烷使供氧情况得到改善,正己烷组细胞荚膜(即黄原胶)明显厚于空白组。
黄原胶,发酵,氧载体,正己烷,大豆油
黄原胶是由野油菜黄单胞菌发酵生产的酸性胞外多糖,是一种重要的工业生物高分子聚合物。黄原胶具有优越的假塑性、触变性和增粘性等,在食品、采油、化妆品等工业中得到广泛应用[1-2]。野油菜黄单胞菌是好氧菌,在发酵生产过程中,随着粘度增大,物料混合以及氧分散能力大大下降,造成供氧不足,导致黄原胶产率难以提高。因此,溶氧浓度是整个发酵过程的重要限制因素。氧载体一般指不溶于培养基但能够吸附或包裹氧的物质,通过在发酵液中引入一种新液相(与发酵液互不相溶),以减少气液传氧阻力,提高氧气传质速率,这种液相一般具有比水更高的溶氧能力[3]。发酵系统中加入氧载体,可增强系统供氧能力,提高黄原胶产率,且无需额外提供能量[4-5]。大豆油[6-7]及碳氢化合物[8-9]常用作好氧发酵系统的氧载体,国内虽有在黄原胶发酵系统中分别添加正己烷[10]和正十二烷[5]作为氧载体的报道,但未对各种氧载体进行系统比较研究,且不够深入。本实验以提高黄原胶产率为目的,考察常见的几种氧载体(大豆油、正己烷、正十二烷)对黄原胶发酵体系的影响,为工业化生产提供一定参考。
1 材料与方法
1.1 实验材料
研究所用菌种 本实验室保藏的野油菜黄单胞菌(Xanthomonas campestris);固体培养基(g/L) 蔗糖20、蛋白胨5、牛肉膏3、酵母膏1、琼脂20,pH7.0;种子培养基(g/L) 蔗糖20、蛋白胨5、牛肉膏3、酵母膏1,pH7.0;发酵培养基(g/L) 蔗糖50、蛋白胨6、K2HPO45.0、MgSO4·7H2O 0.3、CaCO33.0、柠檬酸1,pH7.0;大豆油 上海嘉里公司;正己烷、正十二烷
成都科龙公司。
1.2 实验方法
1.2.1 细胞干重测定 移取发酵液1m L,适当稀释,离心(10000 r/m in,15m in),洗涤三次,60℃烘干至恒重,称重。
1.2.2 黄原胶提取与含量测定 添加上清液质量0.2%的氯化钾,再添加3倍体积的无水乙醇,搅拌产

1.2.3 细胞形态的观察 野油菜黄单胞菌经荚膜染色法染色[11],显微镜观察。
1.2.4 发酵培养条件 接种经平板活化后的单菌落于种子培养基,装液量 50m L/250m L,摇床培养(30℃,180 r/m in)28h;再以10%接种量接种于发酵培养基,装液量20m L/100m L,在发酵的不同时期加入不同浓度的大豆油、正己烷、正十二烷,摇床发酵(30℃,180 r/m in),提取黄原胶,计算产率。生黄原胶絮状沉淀,过滤收集黄原胶沉淀。所得黄原胶60℃烘干至恒重,称重,黄原胶产率按式(1)计算:
2 结果与讨论
2.1 氧载体加入量对黄原胶发酵的影响
发酵初期分别以2%、4%、6%、8%、10%和12%(v/v)加入量,添加大豆油、正己烷、正十二烷,摇床发酵(180 r/m in,30℃)72h,结果如图1。随着大豆油加入量的增加,黄原胶产率提高,当添加6%(v/v)大豆油时,产率为2.347%,相对于空白组提高18%。然而,随着加入量进一步增大,黄原胶产率呈明显下降趋势,过量加入大豆油导致发酵液水分流失,且表观粘度增大造成氧气传质系数降低[12]。添加2%(v/v)以上的正己烷或正十二烷均使黄原胶产率下降,这可能是由于正己烷和正十二烷加入量过高,对发酵产生抑制作用。降低正己烷和正十二烷加入量,结果如图2。正己烷加入量降低后,黄原胶产率显著提高,当添加 1%(v/v)正己烷时,产率为2.413%,相对于空白组提高21%。但仅添加0.25%(v/v)正十二烷,黄原胶产率仍未提高且呈下降趋势,正十二烷可能对黄原胶生物合成相关的某些酶系有不利影响,因此正十二烷不适合作为氧载体用于本系统中。

图1 不同浓度氧载体(大豆油、正己烷、正十二烷)对黄原胶发酵的影响

图2 降低正己烷、正十二烷加入量对黄原胶发酵的影响
2.2 氧载体加入时间对黄原胶发酵的影响
分别于发酵 0、12、24、36、48、60h,向发酵系统中添加6%(v/v)大豆油或1%(v/v)正己烷,摇床发酵(180 r/m in,30℃)72h,结果如图3。随着大豆油加入时间的推后,黄原胶产率逐渐下降,而发酵12h添加正己烷,产率为2.927%,相对于空白组提高47%。一般而言,有机溶剂的Log P(在标准状态下,溶剂在辛醇和水两相系统中分配系数的对数值)大于4表明其具有良好的生物相容性,对微生物细胞没有毒害作用[13]。而正己烷Log P为3.5,故在细胞适应环境(发酵12h)后添加正己烷,能削弱其对细胞的毒害作用。

图3 氧载体加入时间对黄原胶产率的影响
发酵过程中生物量随时间的变化如图4所示。可以看出,大豆油组最高细胞浓度为10.933g/L,远高于空白组最高细胞浓度6.233g/L,说明发酵初期添加6%(v/v)大豆油有利于改善供氧,对细胞生长有明显促进作用。发酵12h添加1%(v/v)正己烷获得的细胞浓度与空白组相差不大,而发酵初期添加1%(v/v)正己烷,细胞浓度降低,这进一步验证了发酵初期加入正己烷对细胞的毒害作用。

图4 氧载体加入对黄单胞菌生长的影响
2.3 发酵过程中细胞形态的变化
在黄原胶发酵的不同时期,取空白组、大豆油组(发酵初期加入6%(v/v)大豆油)及正己烷组(发酵12h加入1%(v/v)正己烷)发酵液,进行细胞荚膜染色,用油镜观察细胞形态,结果如图5。发酵初期,细胞外层几乎没有胞外多糖,即黄原胶;发酵24h,空白组和两个实验组中均可观察到有一层较薄的荚膜,说明发酵前期主要是细胞生长,而黄原胶还未大量生成;发酵48h,三组细胞外层荚膜显著变厚,部分细胞出现自溶,细胞自溶释放的胞内酶虽对黄原胶合成有利,但细胞自溶标志着发酵即将结束,因此黄单胞菌的荚膜厚度在细胞自溶后达到最大;发酵72h,空白组和正己烷组中多数细胞自溶,因加入正己烷改善发酵供氧情况,正己烷组的细胞荚膜明显厚于空白组,大豆油组中虽有细胞自溶,但仍可观察到部分形态正常的细胞,说明发酵还可继续。为此,分别延长大豆油组和正己烷组的发酵周期,结果如图6。延长大豆油组发酵周期至84h,产胶率显著提高至2.977%,相对于空白组提高49%,说明大豆油组更高的产胶率可通过延长发酵周期获得。延长正己烷组发酵周期不能进一步提高黄原胶产率。
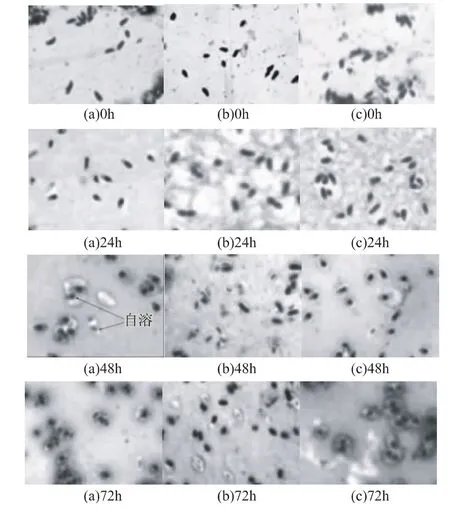
图5 发酵过程中空白组(a)、大豆油组(b)、正己烷组(c)细胞形态的变化
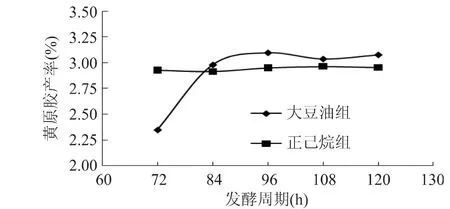
图6 延长发酵周期对黄原胶产率的影响
3 结论
3.1 大豆油、正己烷可作为黄原胶发酵系统的有效氧载体,发酵初期加入6%(v/v)大豆油、发酵12h加入1%(v/v)正己烷,产胶率分别为2.347%和2.927%,相对于空白组分别提高18%和47%。
3.2 加入量0.25%~12%(v/v)范围内的正十二烷不能提高黄原胶产率,对黄原胶发酵有抑制作用,因此正十二烷不适合作为氧载体用于本系统中。
3.3 发酵初期加入6%(v/v)大豆油,对细胞生长有明显的促进作用,最大细胞浓度为10.933g/L,并使细胞自溶滞后,因此延长发酵周期至84h,产胶率显著提高至2.977%,相对于空白组提高49%。发酵12h加入1%(v/v)正己烷对细胞生长没有促进作用,也不能使细胞自溶滞后,但加入正己烷改善发酵供氧情况,使得细胞荚膜明显厚于空白组。
[1]Rosalam S,England R.Review of xanthan gum production from unmodified starches by Xanthomonas comprestris sp.[J].Enzyme Microb Technol,2006,39:197-207.
[2]Garcia-Ochoa F,Santos V E,Casas JA,et al.Xanthan gum:production,recovery,and properties[J].Biotechnol Adv,2000,18:549-579.
[3]欧杰,李柏林,程抒劼.混合烷烃对野油菜黄单胞菌合成黄原胶的影响[J].食品科学,2007,28(8):273-276.
[4]Jia S,Wang M,Kahar P,et al.Enhancement of yeast fermentation by addition of oxygen vectors in air-lift bioreactor[J].J Ferment Bioeng,1997,84(2):176-178.
[5]欧杰,刘秀杰,阮塑瑜.携氧剂(正十二烷)对黄原胶发酵的影响[J].食品科技,2006,31(9):174-176.
[6]梁新乐,励建荣,陈敏,等.氧载体强化氧传递促进法夫酵母虾青素的合成[J].菌物系统,2003,22(3):424-429.
[7]Jia S,Chen G,Kahar P,et al.Effect of soybean oil on oxygen transfer in the production of tetracycline with an airlift bioreactor[J].J Biosci Bioeng,1999,87(6):825-827.
[8]刘元帅,石国领,吴建勇.添加液态烷烃氧载体对法夫酵母发酵生产虾青素的影响[J].食品与发酵工程,2005,31(6):43-46.
[9]Zhang J,Wang X,Zhang J,et al.Oxygen vectors used for S-adenosyl methionine production in re-combinant pichia pastoris with sorbitol as supplemental carbon source[J].JBiosci Bioeng,2008,105(4):335-340.
[10]杨秋艳,程蓉,汪智姝,等.氧载体(正己烷)对黄原胶发酵的影响[J].食品科技,2009,34(4):218-221.
[11]沈萍,范秀容,李光武.微生物学实验[M].北京:高等教育出版社,2004:34-35.
[12]梁心乐,励建荣,陈敏,等.氧载体强化氧传递促进法夫酵母虾青素的合成[J].菌物系统,2003,22(3):424-429.
[13]Colja L,Sjef B,Kees V,et al.Rulse for optimization of biocatalysis in organic solvents[J].Biotechnol Bioeng,1987,30(1):81-87.
Application of oxygen vectors in xanthan gum production
LIN Lin,DENG Chun,LONG Ke,CHENG Rong,ZHANG Yong-kui*
(School of Chemical Engineering,Sichuan University,Chengdu 610065,China)
In xanthan gum fermentation process,the level of dissolved oxygen drops with the viscosity increasing,and the synthesis of xanthan gum is inhibited.Adding oxygen vectors to the system of xanthan gum fermentation is a method to imp rove oxygen supply.The optimalsoybean oilconcentration and adding time was 6%(v/v)and 0h,and the optimal n-hexane concentration and adding time was 1%(v/v)and 12h.The addition of soybean oil and n-hexane significantly improved xanthan gum yield to 2.977%and 2.927%,respectively(increased by 49%and 47%,respectively).Although partial autolysis occurred in the soybean oil group,synthesis could still continue in most normal cells by 72h,which made it possible to extend fermentation period.Prolonging fermentation with n-hexane had little effect on the yield,however the capsule around the cell was obviously much thicker than that of control group after 72h fermentation.
xanthan gum;fermentation;oxygen vector;n-hexane;soybean oil
TS201.3
A
1002-0306(2011)08-0192-03
2010-07-16 *通讯联系人
林琳(1986-),女,硕士研究生,主要从事微生物发酵方面研究。

