超声波及热处理对柚皮苷酶稳定性及其二级结构的影响
曾霖霖,黄惠华
(华南理工大学轻工与食品学院,广东广州 510640)
超声波及热处理对柚皮苷酶稳定性及其二级结构的影响
曾霖霖,黄惠华*
(华南理工大学轻工与食品学院,广东广州 510640)
研究了超声波及热处理对柚皮苷酶的活性及热稳定性的影响,通过圆二色谱分析超声波及热处理对柚皮苷酶二级结构的影响。结果表明,随着温度的升高,酶失活速率加快,在80℃下保温150min,柚皮苷酶残留酶活仅为原酶的15.69%。超声功率为40~120W时,短时间的超声处理对柚皮苷酶活性有促进作用,而功率大于160W时超声波处理对柚皮苷酶活性有钝化作用。80W处理对柚皮苷酶的热稳定性有促进作用,处理5min后60℃保温150min,酶活性比未经处理的柚皮苷酶活性增加了64.34%;而280W处理对柚皮苷酶的热稳定有钝化作用,处理40min后60℃保温150min,酶活性比未经处理的柚皮苷酶活性降低了42.61%。圆二色谱分析结果表明,未经处理的柚皮苷酶中α-螺旋含量较少,主要结构为β-折叠和无规则卷曲;热处理及超声波处理对α-螺旋结构几乎没有影响,β-折叠、β-转角及无规则卷曲含量的变化分别在0.4%~1.1%、0.1%~0.4%及0~0.9%之间。
柚皮苷酶,超声波,热处理,圆二色谱,二级结构
柚皮苷酶首先被Hall和Thomas分别于1938年和1958年从芹菜种子和葡萄果实的叶子中分离出来。然而,只有经过微生物培养分离出的柚皮苷酶才是可以应用的,该产品可经过液体深层发酵法或固体发酵法获得[1]。柚皮苷酶主要应用于果汁的脱苦,它是由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成的混合酶系,兼具两种酶的活性。前者可将果汁中黄烷酮糖苷类化合物的柚皮苷水解成樱桃苷和鼠李糖,樱桃苷的苦味约为柚皮苷的1/3;樱桃苷接着在β-D-葡萄糖苷酶的作用下生成无苦味的柚皮素和葡萄糖[2-3],苦味消失。因此研究不同处理后柚皮苷酶稳定性及二级结构的变化,对提高果汁的脱苦率具有非常重要的意义。目前国内外关于柚皮苷酶稳定性及二级结构的研究还未见报道,本文研究了超声波及热处理对柚皮苷酶稳定性的影响,并通过圆二色谱仪分析柚皮苷酶二级结构的变化,以探讨热处理及超声波处理与柚皮苷酶二级结构变化之间的关系,为促进柚皮苷酶的工业化应用提供可靠的理论依据。
1 材料与方法
1.1 材料与设备
柚皮苷酶 来源于青霉属,活力414U/g(酶活定义:在40℃、pH为4.0的条件下每分钟从柚皮苷中分解出1.0μmol葡萄糖所需的酶量定义为一个活力单位),购于sigma公司;柚皮苷 购于sigma公司。
圆二色谱仪(MOS-450) Blo-Logic公司;JY92-IIDN超声波 宁波新芝;UV-1800紫外可见分光光度计 日本岛津;恒温水浴锅 HH-4富华仪器有限公司。
1.2 实验方法
1.2.1 柚皮苷酶溶液中蛋白含量的测定
1.2.1.1 标准曲线的制作 以牛血清白蛋白为标样,取0.5g标样溶于50m L蒸馏水,配成10mg/m L牛血清白蛋白溶液。取6支试管,分别吸取0、0.2、0.4、0.6、0.8、1.0m L标液,用蒸馏水补足至1m L,分别加入4m L碱性硫酸铜溶液(由1.5g硫酸铜、6.0g酒石酸钾钠溶于500m L蒸馏水中,搅拌下缓慢加入300m L 10%的 NaOH溶液,定容至1L),振摇10min,静置30m in后在500~600nm范围内快速扫描,得产物最大吸收波长为543nm。然后在543nm处测定反应液的吸光值,以吸光度对蛋白质的含量作图,绘制标准曲线,得到回归方程为 y=0.2373x+0.0075,R2=0.9982。
1.2.1.2 样品测定 取5支试管,分别加入1.0m L 5mg/m L的酶液,振荡10m in,静置30min后在543nm处测定吸光度,根据吸光度计算所取样液中蛋白质含量。结果表明,柚皮苷酶中蛋白质含量为32.68%。
1.2.2 柚皮苷酶活力测定方法[4]取2m L 0.1%柚皮苷标准溶液和0.2mol/L pH3.8的柠檬酸缓冲液1.9m L置于试管中,在40℃恒温水浴中预热5m in,然后加入未处理及处理过的柚皮苷酶液0.1m L,充分摇匀,准确保温30m in,用三氯乙酸灭酶后吸取0.5m L酶解液,置于10m L的小试管中,加入90%二甘醇5m L,1mol/L NaOH 溶液 0.5m L,摇匀,在 40℃ 保温10m in,倒入厚度为1cm的比色皿中,空白以蒸馏水代替NaOH,在最适波长下测定光密度。柚苷酶活力的定义为:在40℃,pH3.8条件下,每毫升柚皮苷酶每分钟催化分解1μg柚皮苷为一个单位,以 U/m L表示。
1.2.3 柚皮苷酶的热稳定性 配制0.1mg/m L的柚皮苷酶溶液,分别在30~80℃下保温,每隔30m in取0.1m L酶液测定残留酶活,总处理时间为150min,本文中残留酶活都用相对酶活表示,定义未经任何处理的柚皮苷酶活力为100%。
1.2.4 超声波对柚皮苷酶活性的影响 取25m L 0.1mg/m L的柚皮苷酶溶液于50m L烧杯中,将超声波变幅杆插入处理液下10~15cm。频率固定为20kHz,脉冲方式为 1∶1,分别在功率为 40、80、120、160、200、280W 下处理 5~40min,测定柚皮苷酶残存酶活,以相对酶活表示。
1.2.5 超声波对柚皮苷酶热稳定性的影响 将80W及280W超声波处理后的柚皮苷酶溶液置于60℃下保温不同时间(0~150m in),每隔30min取0.1m L酶液测定残留酶活。在给定条件下,保留的活性越高,酶的稳定性越强。
1.2.6 热处理及超声波处理对柚皮苷酶二级结构的影响 二级结构可以用远紫外圆二色谱测定[5-6],为适合圆二色谱分析,配制蛋白质含量为0.15mg/m L的柚皮苷酶溶液。
用Blo-Logic MOS-450圆二色谱仪测定热处理及超声波处理前后柚皮苷酶远紫外圆二色谱变化。样品池光程为0.1cm,在25℃和连续充氮的条件下,进行远紫外区域(185~250nm)扫描,速度为3.3nm/s,光谱间隔0.5nm,3次累积。克分子椭圆率[θ]=θ/(10CL),式中,θ:CD仪测出的椭圆率单位(mdeg);C:柚皮苷酶浓度(mg/m L);L:比色皿的厚度(cm)。通过仪器提供的软件 CDPro-Protein Secondary Structure Estimation Program,套用43种不同的蛋白模型,采用Continll算法估算原酶液及不同处理的柚皮苷酶溶液二级结构中α螺旋、β折叠、β转角和无规则卷曲所占的比率。
2 结果与分析
2.1 柚皮苷酶的热稳定性
图1所示为柚皮苷酶在不同温度下的失活动力学曲线,由于柚皮苷酶是一种混合酶,因此酶的热失活并不遵循一级动力学曲线[7]。从图1中可知,柚皮苷酶在30℃下保温90m in,酶活几乎没有损失,保温150min,酶活仍然高达85.3%。当温度为40℃时,柚皮苷酶开始发生变性,酶活下降比较显著。随着温度的升高,酶变性速度加快,酶活下降的速度也随之增大。当温度高于70℃时,酶失活速度显著增大,在70℃和80℃柚皮苷酶的半衰期分别在100m in和50m in左右。在80℃下保温150m in,柚皮苷酶残留酶活仅为15.69%。这是因为在任何温度下,总会有少量酶分子处于较高能量状态,这些分子会越过能障成为非活性分子,导致酶活降低。相对来说,柚皮苷酶是一种比较耐热的酶。

2.2 超声波处理对柚皮苷酶稳定性的影响
大多数研究表明,超声功率不同,对酶的处理效果也不同。较低强度的超声作用,超声强度与酶活力呈正相关,随着强度的增大,酶逐渐被激活,强度越高,酶的催化活力越高。若进一步加大强度,酶催化活力反而降低[8-9]。
图2所示为柚皮苷酶在不同超声功率下作用不同时间酶活性的变化,从图2中可知,超声波对柚皮苷酶的活性影响随着功率和处理时间均有所变化,当超声功率在40~120W时,柚皮苷酶活性随超声时间的延长先升高后降低,40W处理5min、80W处理10m in,柚皮苷酶活性分别比原酶增加 5.77%和9.54%;120W 超声 30min,相对酶活仍然高达106.65%,随后酶活急剧下降,在超声40m in时酶活降为原酶的81.26%。随着超声功率的增大,超声时间的延长,柚皮苷酶活性呈下降趋势,当柚皮苷酶在280W下处理40min,酶活损失高达37.27%。因此,超声功率为40~120W之间时,短时间的超声处理对柚皮苷酶活性有促进作用,当处理达到一定时间后,酶活性逐渐下降[8-10];当功率大于 160W 时,超声波对柚皮苷酶活性有钝化作用。这是因为酶是一种活性生物分子,其活性的高低从根本上取决于酶分子构象的合理程度。较低强度的超声处理可导致酶分子能量的增加与介质温度的增高,引起酶分子构象的微小变化,使酶分子的超微结构更具有柔性、更合理,从而表现出较高的催化活性;但在较高强度的超声作用下,酶分子的能量进一步加大,构象进一步改变,趋向于不合理的构象,导致酶分子本身的催化活力受到阻碍,表现为酶的失活[11]。

图2 超声波处理对柚皮苷酶稳定性的影响
2.3 超声波对柚皮苷酶热稳定性的影响图3为柚皮苷酶经过超声波处理后,在60℃保温不同时间活性的变化情况。从图3可知,超声波功率和超声时间对柚皮苷酶的热稳定性影响较大。
与未经超声处理的柚皮苷酶相比,80W处理对柚皮苷酶的热稳定性有促进作用,即柚皮苷酶的半衰期延长;80W处理5m in后,60℃保温150m in,酶活性比未经处理的柚皮苷酶活性增加了64.34%。当超声处理的功率为280W,超声时间超过5m in时,柚皮苷酶的热稳定受到抑制;280W处理40min后,60℃保温150m in,酶活性比未经处理的柚皮苷酶活性降低了42.61%。对比图3(a)和图3(b)可得知,80W处理的柚皮苷酶半衰期明显比280W处理的柚皮苷酶半衰期长。这与柚皮苷酶二级结构的变化密切相关,从表1中可知,80W处理后β-折叠含量下降,而无规则卷曲含量上升,表明柚皮苷酶的结构变得更具有柔性、更加合理,底物分子更容易进入酶活性中心,因此柚皮苷酶活性得到提高;280W处理后β-折叠含量上升,而β-转角和无规则卷曲含量均有所下降,表明柚皮苷酶的结构变得更具有刚性,结构更加紧密,底物分子较难进入酶活性中心,因此柚皮苷酶活性也相对降低。
2.4 不同处理对柚皮苷酶二级结构的影响

图3 超声波功率80W及280W处理对柚皮苷酶热稳定性的影响
从表1可知,柚皮苷酶中α-螺旋含量较少,主要结构为β-折叠和无规则卷曲。热处理的温度高低对柚皮苷酶的二级结构影响不同,40℃处理60m in,α-螺旋和β-折叠含量均降低,β-转角含量上升;60℃处理60m in,无规则卷曲含量降低1.5%,β-折叠含量增加1.1%。说明柚皮苷酶分子在低温处理时柔性增大,结构变得更加松散,同时β-转角增多,酶活性中心或者键合位点被覆盖的几率增大,导致底物和酶结合失败的概率增大,从而使酶失去活性;而在较高温度处理时刚性增大,同时β-折叠非自然的错误增多,最终导致酶天然构象改变,活性中心或键合位点就越少,酶活性越差[12-13]。超声波功率高低对柚皮苷酶的二级结构也有类似影响,较低功率时β-折叠和β-转角含量均降低,无规则卷曲含量上升0.9%,而在较大功率时,二级结构的变化主要为β-折叠和无规则卷曲含量的变化。

表1 热处理及超声波处理对柚皮苷酶二级结构的影响
图4所示为柚皮苷酶在热处理及超声波处理前后圆二色谱的变化。从图4中可知,未经处理的柚皮苷酶在208nm及222nm有两个负峰,[θ]208=-539deg·cm2·dmol-1,这是 α-螺旋的典型结构,但是双负峰并不十分明显,可以判断柚皮苷酶中螺旋结构比例很少,热处理和超声处理后,负峰位置并没有发生明显变化,可知α-螺旋结构并没有受到影响,这与表1中数据相吻合。图4中显示在200nm及215nm附近均有明显的负峰,这是β-折叠的典型结构,相比于未处理的柚皮苷酶,图4(a)中200nm附近的负峰在40℃处理后往下移,说明β-折叠结构含量降低,而60℃处理后的柚皮苷酶在215nm处的负峰往上移,说明β-折叠结构含量增加。图4(b)中超声波处理的柚皮苷酶相应位置的负峰也有类似变化。图中205nm及218nm处均有一个明显正峰,这分别是β-转角和无规则卷曲的典型结构,与未经处理的柚皮苷酶相比,热处理和80W及160W超声波处理后205nm处的正峰均明显下移,而280W超声处理正峰位置几乎没有变化,说明热处理及低功率的超声处理对柚皮苷酶的β-转角结构有显著影响。40℃处理60m in后柚皮苷酶218nm处的正峰发生蓝移,而60℃处理正峰峰形及位置都没明显变化,不同功率超声处理后218nm处的正峰位置均有所下降,80W时变化最为明显,说明较低温度及较小超声功率对柚皮苷酶的无规则卷曲结构影响较大。因此,温度及超声波均能导致柚皮苷酶的构象变化。
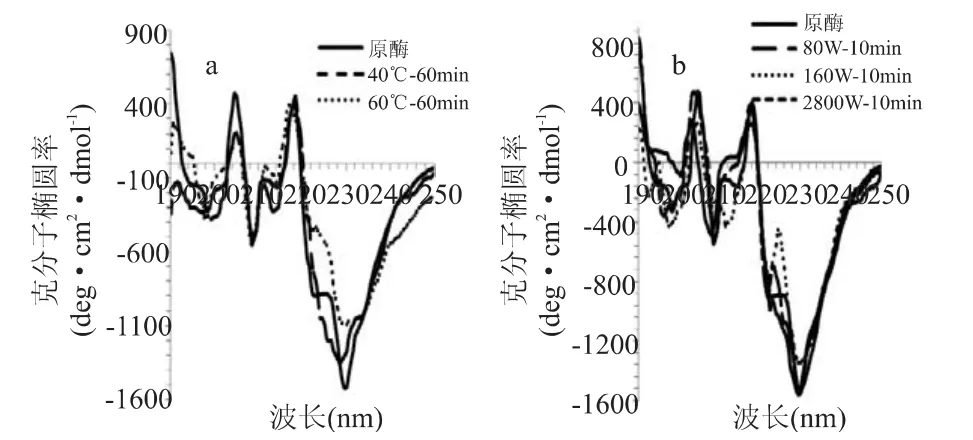
图4 热处理及超声波处理对柚皮苷酶圆二色谱的影响
图4中所示的圆二色谱图与典型的α-螺旋双负峰图谱有所差异,可能原因有:柚皮苷酶纯度可能不高或者在使用过程中混入了其它干扰杂质;柚皮苷酶是由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成的混合酶系,并不是单一酶种,因此两种酶在远紫外区的吸收可能会相互干扰;柚皮苷酶在储藏过程中,构象可能发生了不可逆的变化。因此,如何从柚皮苷酶中分离纯化α-L-鼠李糖苷酶和β-D-葡萄糖苷酶,以及这两种酶的二级结构在超声波及热处理后的变化将是后续研究的重点。
3 结论
柚皮苷酶随着温度的升高,酶失活速率加快,在80℃下保温150m in,柚皮苷酶残留酶活仅为原酶的15.69%;超声功率为40~120W时,短时间的超声处理对柚皮苷酶活性有促进作用,功率大于160W时超声波处理对柚皮苷酶活性有钝化作用。80W处理对柚皮苷酶的热稳定性有促进作用,处理5m in后60℃保温150m in,酶活性比未经处理的柚皮苷酶活性增加了64.34%;而280W处理对柚皮苷酶的热稳定有钝化作用,处理40m in后60℃保温150m in,酶活性比未经处理的柚皮苷酶活性降低了42.61%。圆二色谱结果显示,未经处理的柚皮苷酶中α-螺旋结构含量较少,主要结构为β-折叠和无规则卷曲,热处理及超声波处理对柚皮苷酶β-螺旋几乎没有影响,β-折叠、β-转角及无规则卷曲含量的变化分别在0.4%~1.1%、0.1%~0.4%及0~0.9%之间。
[1]郭倩.产柚苷酶高产菌株的筛选、鉴定及产酶特性研究[D].四川农业大学,2008.
[2]王鸿飞,李和生,董明敏,等.柚皮苷酶对柑橘类果汁脱苦效果的研究[J].农业工程学报,2004,20(6):174-177.
[3]雷生姣,潘思轶.柚(皮)苷酶的研究进展[J].食品科学,2009(19):314-318.
[4]汪钊,毛富根.柚苷酶产生菌的选育及发酵条件研究[J].微生物学通报,1995(1):18-22.
[5]Yang L,Gao Z.Effect of Pb2+on the Secondary Structure and Biological Activity of Trypsin[J].Chen Bio Chem,2005(6):1191-1195.
[6]Huang H,Zhao M.Changes of trypsin in activity and secondary structure induced by complex with trypsin inhibitors and tea polyphenol[J].Eur Food Res Technol,2007:46.
[7]王璋.食品酶学[M].中国轻工业出版社,1991.
[8]黄卓烈.超声波对酵母过氧化氢酶及多酚氧化酶活性的影响[J].中国生物工程杂志,2003,23(4):89-93.
[9]朱少娟.超声波加速胰蛋白酶反应及其机理的探讨[J].江南大学学报,2004(1):14-15.
[10]马海乐,杨巧绒.超声波对螺旋藻蛋白质酶解促进作用的实验研究[J].食品科学,2003,24(10):35-37.
[11]郭海学.有机溶剂对脂肪酶活性影响的研究[J].扬州教育学院学报,2000(3):4-6.
[12]Chen Y H,Yang J T,Martinez H M.Determination of the secondary structures of proteins by circular dichroism and optical rotatory dispersion[J].Biochemistry,1972,11(22):4120-4131.
[13]Adler A J,Greenf Ieldn,Fasmang D.Complexes of deoxyribonucleic acid with lysine-rich histone phosphorylated at two separate sites:circular dichroism studies[J].Arch Biochem Biophys,1972,153(2):769-777.
Effect of ultrasonic and heat treatment on the activity and secondary structure of naringinase
ZENG Lin-lin,HUANG Hui-hua*
(College of Light Industry and Food Technology,South China University of Technology,Guangzhou 510640,China)
The effects of ultrasonic and heat treatment on the activity and secondary structure of naringinase were studied.The results showed that the activity of naringinase was found decreased to 15.69%with heat treatment for 150m in at80℃.Naringinase activity was found enhanced with ultrasonic treatment for a short time from 40W to 120W,but inhibited once the ultrasonic power higher than 160W.The thermostability of naringinase was promoted under 80W ultrasonic treatment,but passivated under 280W.Naringinase activity was increased by 64.34%under 80W,5m in ultrasonic treatment,while decreased by 42.61%under 280W,40m in ultrasonic treatment.CD detection showed that the content ofα-helix remained steady under heat and ultrasonic treatment,while the content changes ofβ-sheet,β-turn and random were found from 0.4%~1.1%,0.1%~0.4%and 0~0.9%,respectively.
naringinase;ultrasonic;heat treatment;circular dichroism;secondary structure
TS255.1
A
1002-0306(2011)08-0101-04
2010-06-28 *通讯联系人
曾霖霖(1987-),男,在读硕士,研究方向:食品科学。
国家星火计划项目(2007EA780005);广东省关键领域重点突破项目(2008A024200003)。

