Fe(0)/H2O2协同降解亚甲基蓝的研究
廖琳,黄宏星,叶俊炜,唐小燕,尹光彩,侯梅芳*
1. 广东工业大学环境科学与工程学院,广东 广州 510006;2. 海南出入境检验检疫局 检验检疫技术中心,海南 海口 570311;3. 广东省生态环境与土壤研究所,广东 广州 510650
近年来,高级氧化技术(Advanced Oxidation Technologies,AOTs)以其强的氧化能力,无二次污染等因素受到越来越多的关注[1-3]。作为AOTs的一种,Fenton试剂利用酸性条件下 Fe2+催化 H2O2分解生成·OH,其氧化还原电位为2.80 V,在常见氧化剂中仅次于氟(2.87 V)[1-2],能直接将大多数难以生化处理的有机污染物降解成小分子,甚至完全矿化。表1为Fenton反应的一般过程[2-5],传统的 Fenton试剂处理污染物时条件非常苛刻,要求pH在3.5以下,使得它的应用受到了一定的限制[2]。为改善Fenton试剂的性能,类Fenton试剂大量出现,其中一类是以Fe(0)代替Fe2+。

表1 Fenton反应的一般过程Table 1 The general processes of Fenton reaction
过去Fe(0)用于重金属[6]、非金属及含氧酸盐[7]、卤代有机污染物[8-9]、含硝基有机污染物[10]和染料[11]等的环境净化和治理而备受关注。近年来,人们发现Fe(0)在有双氧水[12]存在条件下也可产生·OH。不同于其他 AOTs,Fe(0)价廉易得,因此其可能是获取高氧化活性·OH的重要途径之一。
亚甲基蓝(MB)常用作棉、丝及木材等的着色,它会导致灼伤眼睛甚至失明,吸入MB会迅速导致暂时的呼吸困难等症状[13]。本课题组从经济、环境友好的角度入手,选择Fe(0)粉与低浓度H2O2处理MB,研究了pH、H2O2浓度与Fe(0)投加量对降解过程的影响,利用紫外可见吸收光谱等手段分析MB降解情况,其研究结果有望对废旧铁屑、铁板等零价铁材料处理染料废水提供重要的参考。
1 实验部分
1.1 实验材料
30%质量浓度的 H2O2(广州化学试剂厂),还原铁粉(天津科密欧化学试剂开发中心),MB溶液(由分析纯MB配制,所用溶剂为去离子水),所有试剂均为分析纯及以上。
1.2 实验方法
于反应仪器中加入一定体积的MB染料溶液,用 0.1 mol·L-1HCl或 0.1 mol·L-1NaOH调节溶液的pH,然后加入一定量的 Fe(0)和 H2O2,每间隔一定时间取出样品,在 4000 r·min-1条件下离心 10 min,取上清液进行紫外可见分光光度计(TU-1800PC,北京普析通用仪器有限责任公司)扫描,扫描波长范围为200~800 nm。保持其它因素不变,每次改变一个因素,研究溶液 pH值、Fe(0)投加量、H2O2投加量和染料初始浓度对Fe(0)/H2O2体系降解 MB染料废水的影响。所有实验均在无光照条件下进行。
2 结果与讨论
2.1 不同条件下降解MB
据报道,Fe(0)可以去除MB,但反应速率相对较慢[14]。本研究发现,单独用 H2O2处理 MB 60 min,MB的去除率很低,但Fe(0)/H2O2体系可以很快地降解去除MB。表2为不同条件下的准一级反应速率常数(k1),其中异丙醇(IPO)被用作·OH俘获剂[15]。从表2可知,在反应前30 min,单独使用Fe(0)、使用Fe(0)/H2O2和Fe(0)/H2O2-异丙醇的 k1基本一致;而在后 30 min,加入异丙醇的Fe(0)/H2O2体系与单独 Fe(0)体系基本一致,而与Fe(0)/H2O2体系相比,降低了约5倍。由此可看出,Fe(0)/H2O2体系能高效降解去除MB,·OH在其中起到了重要的作用。Fe(0)/H2O2体系降解罗丹明B[12,16]、氯酚[17]等有机污染物的过程中的优越性与本研究结果相类似。
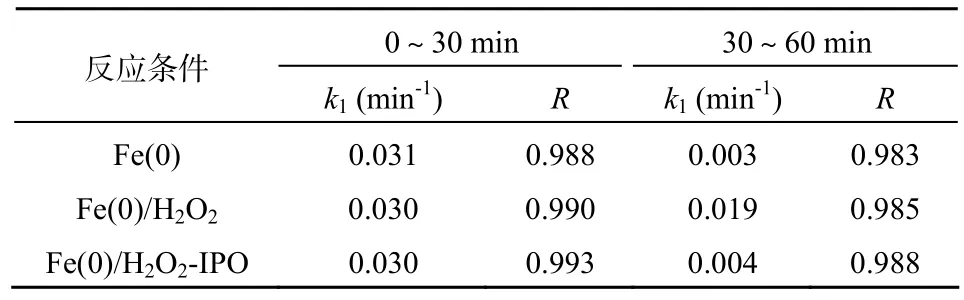
表2 不同反应条件下的准一级反应速率常数Table 2 The pseudo-first-order constants (k1) for the degradation of MB under different conditions
2.2 Fe(0)投加量的影响
Fe(0)可为芬顿反应提供 Fe2+[16-17],促进活性氧物种的生成[18]。从图1可知,当Fe(0)用量从1.0 g·L-1增加到 3.0 g·L-1时,在相同时间段内去除率是先增加,到Fe(0)为2.5 g·L-1时达到最大,然后去除率又开始下降。可看出:Fe(0)用量并非越多越好,一方面使产生的·OH可能被H2O2自身消耗(见反应(5))[3-4],总体上降低了H2O2的利用效率。另一方面,过多的 Fe(0)会腐蚀产生过量的 Fe2+和Fe3+的氢氧化物,降低反应效率[19]。尽管铁氧化物及其水合氧化物可能在双氧水作用条件下同样可降解有机污染物,但其反应速率明显低于Fe(0)/H2O2体系。
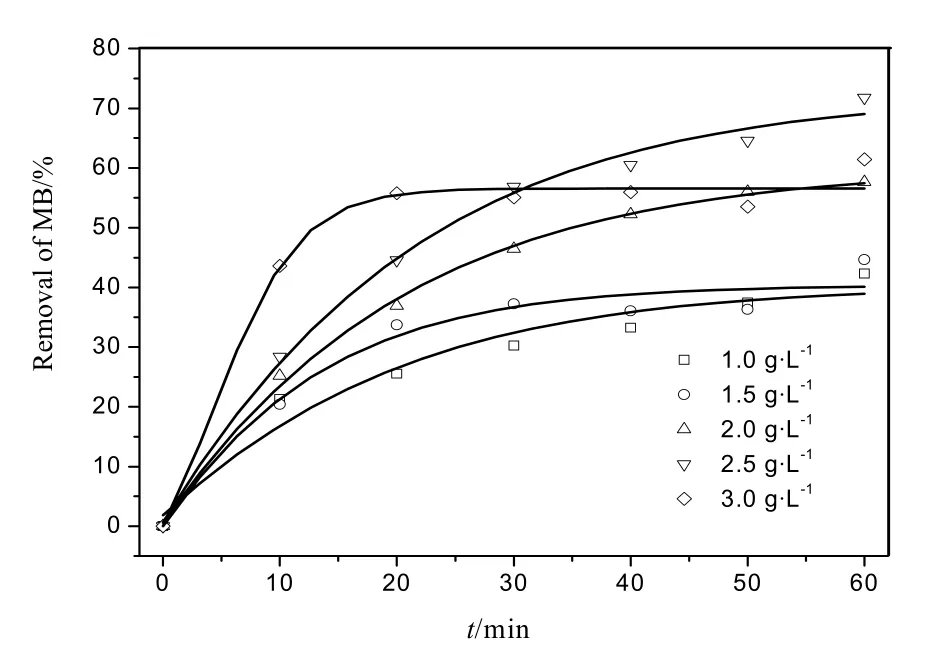
图1 零价铁剂量对MB降解的影响Fig. 1 Effects of Fe(0) dosage on degradation of MB
2.3 H2O2与染料初始质量浓度的影响
H2O2是 Fenton反应或类 Fenton反应中的关键因素,零价铁或铁氧化物类Fenton反应相对传统Fenton反应来说,H2O2用量少是其中的一个优点[10]。当 H2O2的用量从 1.0 mmol·L-1增加至 5.0 mmol·L-1时,反应速率随用量增加而增大,达到最大值,继续增大H2O2浓度至6.0 mmol·L-1,脱色率并没有大幅增加,反而降低。H2O2在类 Fenton反应过程中的双面作用在于:一方面当 H2O2浓度较低时,随着 H2O2浓度增加,催化效率大大提高,另一方面因为 H2O2本身是一种中等强度氧化剂,H2O2过多时将成为·OH 的清除剂[3-4],另外·OH 之间、·O2H之间及·OH与·O2H之间会发生偶合反应[4](见表 1反应(5)~(9)),这些都会减少有效的活性氧物种的数量,进而降低反应效率。表3所示为不同 H2O2浓度的 k1,可看出 H2O2浓度为 6.0 mmol·L-1比 5.0 mmol·L-1时的 k1低;同时还可看出,MB质量浓度为10、20、30和40 mg·L-1时,相应的准一级反应速率常数从0.044 min-1降至0.026、0.014和0.012 min-1。
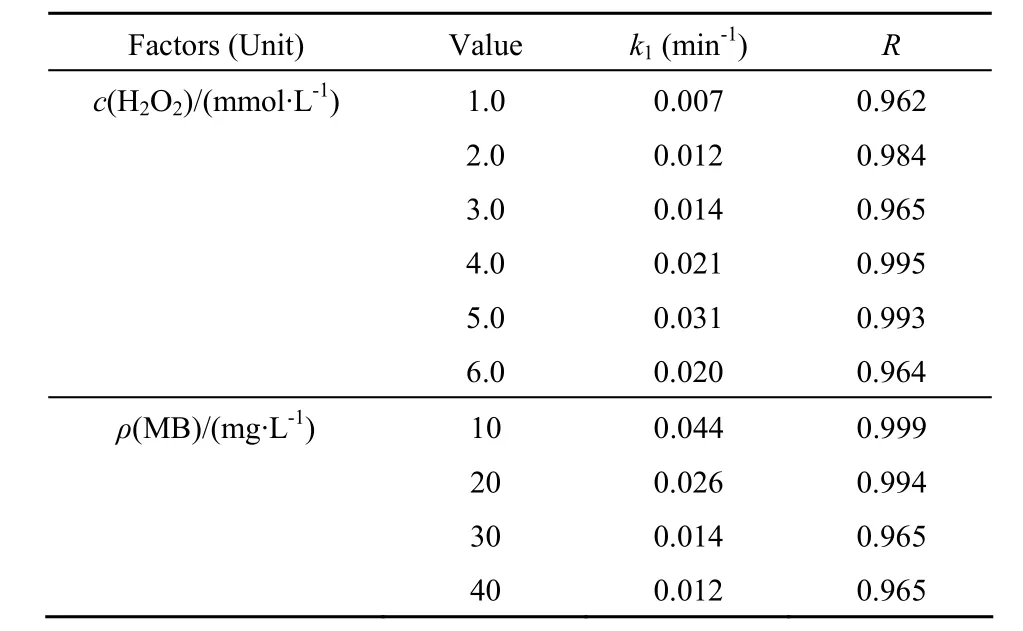
表3 不同H2O2和MB浓度的准一级反应速率常数Table 3 The pseudo-first-order kinetic constants (k1) for the degradation of MB with different concentrations of H2O2 and MB
2.4 初始pH的影响
如图2所示,随着pH值的升高,去除率逐渐增加,pH为7.5时达到最大,在60 min内去除率为 80%左右。pH较低时铁腐蚀较快,产生大量的铁离子可能自身消耗羟基自由基,造成染料降解率的下降;较高pH可有效减缓铁腐蚀,又能提供芬顿反应足够的铁离子,使其充分发挥优势产生羟基自由基矿化染料污染物。据报道,采用 Fe(0)为核Fe2O3为壳的纳米线与H2O2的体系降解有机染料污染物的 pH范围较宽[16],Fe(0)/H2O2体系降解氯酚的pH范围更宽[17],有的可达到2~10;这主要源于Fe(0)可在较高pH条件下持续提供芬顿体系所需的Fe2+,满足产生·OH 进而降解有机污染物的需要,近年来在这方面的研究逐渐成为热点[20-21]。总体而言,相比较于传统芬顿反应的低 pH条件,Fe(0)/H2O2体系可以在较高 pH条件下高效去除MB,这有利于其在环境水污染治理中的应用。
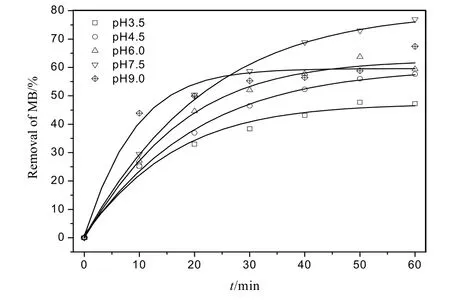
图2 初始pH对MB降解的影响Fig. 2 Effects of initial pH on degradation of MB
2.5 紫外-可见光谱分析
图3为亚甲基蓝溶液在降解0~60 min时的紫外-可见光谱图。665 nm处的峰源于MB分子上杂环芳烃的>N(CH3)2发色取代基团,292 nm处的峰源于MB芳香杂环系统的共轭结构。随着反应的进行,MB在292 nm和665 nm两个主要的吸收峰逐渐降低,意味着MB的发色基团和芳香杂环结构逐渐被氧化降解,MB去除率达到100%。由图3还可看出,在Fe(0)/H2O2体系中,反应10 min时MB在665 nm处的吸收峰蓝移至651 nm,随着反应的进行逐渐蓝移至630 nm附近,可能源于MB的脱甲基过程[22-23];同时300 nm以下的峰急剧下降可能是MB芳香杂环系统被降解破坏,并在降解过程中产生了某些小分子化合物。Fe(0)/H2O2体系降解MB的机理将在今后进一步研究。
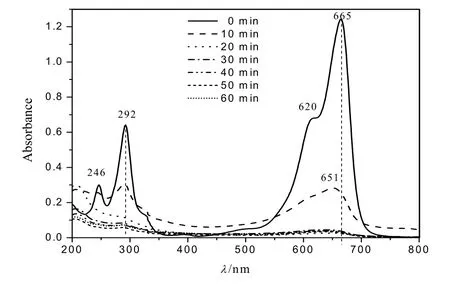
图3 不同反应时刻MB的紫外-可见光吸收光谱Fig. 3 The UV-Vis spectra of MB during reaction
3 结论
类Fenton反应Fe(0)/H2O2体系可以有效地对噻嗪类染料 MB进行降解脱色。MB去除率随 Fe(0)投加量、H2O2用量及溶液pH值的增大而增加;随MB浓度的增加而减少。MB的UV-Vis光谱变化表明其发生了的降解且生成了小分子物质。总体而言,相比较于传统芬顿反应的低 pH条件,Fe(0)/H2O2体系可以在较高 pH条件下高效去除MB,这有利于其在环境水污染治理中的应用。
[1] ALHAMEDI F H, RAUF M A, ASHRAF S S. Degradation studies of rhodamine B in the presence of UV/H2O2[J]. Desalination, 2009, 239:159-166.
[2] 张德莉, 黄应平, 罗光富, 等. Fenton及Photo-Fenton反应研究进展[J]. 环境化学, 2006, 25(2): 121-127.ZHANG Deli, HUANG Yingping, LUO Guangfu, et al. Research progress of fenton and photo-fenton reaction [J]. Environmental Chemistry, 2006, 25(2): 121-127.
[3] BERGENDAHL J A, THIES T P. Fenton's oxidation of MTBE with zero-valent iron[J]. Water Research, 2004, 38: 327-334.
[4] MINERO C, LUCCHIARI M, VIONE D, et al. Fe(III)-enhanced sonochemical degradation of methylene blue in aqueous solution[J].Environmental Science Technology, 2005, 39: 8936-8942.
[5] TITUS M P, MOLINA V G, BANOS M A, et al. Degradation of chlorophenols by means of advanced oxidation processes: a general review[J]. Applied Catalysis B: Environmental, 2004, 47: 219-256.
[6] KRISHNA M V B, CHANDRASEKARAN K, KARUNASAGAR D,et al. A combined treatment approach using Fenton’s reagent and zero valent iron for the removal of arsenic from drinking water[J]. Journal of Hazardous Materials, 2001, B84: 229-240.
[7] HOU M F, WAN H F, LIU T L, et al. The effect of different divalent cations on the reduction of hexavalent chromium by zerovalent iron[J].Applied Catalysis B: Environmental, 2008, 84(1/2): 170-175.
[8] KIM Y H, CARRAWAY E R. Dechlorination of pentachlorophenol by zero valent iron and modified zero valent irons. Environmental Science & Technology, 2000, 34: 2014-2017.
[9] HOU M F, WAN H F, ZHOU Q X, et al. The dechlorination of pentachlorophenol by zerovalent iron in presence of carboxylic acids[J],Bulletin of Environmental Contamination and Toxicology, 2009, 82:137-144.
[10] OH S Y, CHIU P C, KIM B J, et al. Enhancing fenton oxidation of TNT and RDX through pretreatment with zero-valent iron[J]. Water Research, 2003, 37: 4275-4283.
[11] HOU M F, LI F B, LIU X M, et al. The effect of substituent groups on the reductive degradation of azo dyes by zerovalent iron[J]. Journal of Hazardous Materials, 2007, 145: 305-314.
[12] HOU M F, LIAO L, ZHANG W D, et al. Degradation of rhodamine B by Fe(0)-based fenton process with H2O2[J]. Chemosphere, 2011, 83:1279-1283.
[13] RAFATULLAH M, SULAIMAN O, HASHIM R, et al. Adsorption of methylene blue on low-cost adsorbents: A review[J]. Journal of Hazardous Materials, 2010, 177: 70-80.
[14] NOUBACTEP C. Characterizing the discoloration of methylene blue in Fe0/H2O systems[J]. Journal of Hazardous Materials, 2009, 166:79-87.
[15] LI G T, WONG K H, ZHANG X W, et al. Degradation of acid orange 7 using magnetic AgBr under visible light: The roles of oxidizing species[J]. Chemosphere, 2009, 76: 1185-1191.
[16] AI Z H, LU L R, LI J P, et al. Fe@Fe2O3core-shell nanowires as iron reagent. 1. Efficient degradation of rhodamine B by a novel sono-fenton process[J]. The Journal of Physical Chemistry C, 2007,111: 4087-4093.
[17] ZHOU T, LI Y Z, JI J, et al. Oxidation of 4-chlorophenol in a heterogeneous zero valent iron/H2O2, fenton-like system: Kinetic, pathway and effect factors[J]. Separation and Purification Technology, 2008, 62:551–558
[18] CHANG M C, SHU H Y, YU H H. An integrated technique using zero-valent iron and UV/H2O2sequential process for complete decolorization and mineralization of C.I. Acid Black 24 wastewater[J].Journal of Hazardous Materials, 2006, B138: 574-581.
[19] 邓南圣, 吴峰. 环境光化学[M]. 北京: 化学工业出版社, 2003: 277.DENG Nansheng, WU Feng. Environmental Photochemistry[M]. Beijing: Chemical Industry Press, 2003: 277.
[20] LEE J, KIM J, CHOI W. Oxidation on zerovalent iron promoted by polyoxometalate as an electron shuttle[J]. Environmental Science &Technology, 2007, 41: 3335-3340.
[21] JOO S H, FEITZ A J, WAITE T D. Oxidative degradation of the carbothioate herbicide, molinate, using nanoscale zero-valent iron[J]. Environmental Science & Technology, 2004, 38: 2242-2247.
[22] ZHANG T Y, OYAMA T, AOSHIMA A, et al. Photooxidative N-demethylation of methylene blue in aqueous TiO2dispersions under UV irradiation[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2001, 140: 163-172.
[23] TAKIRAWA T, WATANABE T, HONDA K. Photocatalysis through excitation of adsorbates. 2. A comparative study of rhodamine B and methylene blue on cadmium sulfide[J]. The Journal of Physical Chemistry, 1978, 82(12): 1391-1396.

