聚羟基烷酸酯的生物合成研究进展
黄锦标,尚龙安
(1浙江大学化学工程与生物工程学系,浙江 杭州 310027;2浙江大学宁波理工学院,浙江 宁波 315100)
进展与述评
聚羟基烷酸酯的生物合成研究进展
黄锦标1,尚龙安2
(1浙江大学化学工程与生物工程学系,浙江 杭州 310027;2浙江大学宁波理工学院,浙江 宁波 315100)
聚羟基烷酸酯(PHA)是一类在众多微生物细胞内可合成的聚酯,由于其可完全生物降解,是一类可替代传统塑料的新型生物材料。该类聚酯在不同的微生物细胞内的生物合成途径已经被广泛和深入地研究。为降低其生产成本,实现工业化生产,筛选更高产的菌株和利用廉价碳源来合成PHA成为近年来的研究重点。本文介绍了PHA的在微生物细胞内的合成途径以及最近几年来生物合成PHA的研究进展。
聚羟基烷酸酯;生物合成;生物可降解塑料;廉价碳源
聚羟基烷酸酯(PHA)是可由众多微生物在碳源充足而其它营养元素(如硫、磷、氮等)缺乏条件下作为碳源和能源的储藏物质在细胞质内合成的一类聚酯[1]。PHA结构通式如图1所示。

图1 PHA的结构通式
图1中,m=1、2、3,m为1最为常见,n可以为数百到数千不等。R为可变基团。当m=1,R为 CH3时即为常见的均聚物聚羟基丁酸酯(PHB)。
由于PHA是由微生物胞内合成的聚合物,PHA在自然条件下可完全生物降解。有氧条件下,PHA能完全降解成水和CO2。在厌氧条件下,能被微生物降解生成甲烷。PHA也具有传统塑料的性质,如均聚物PHB同样可以挤压成型,制造胶片和与其它聚合物交联生成共聚物。另外,PHA具有良好的生物相容性,在医学领域也具有广泛的应用,其水解得到的手性聚羟基烷酸广泛应用于医药工业中手性药物合成的起始原料[2]。
该类聚酯作为一种可替代传统塑料的新型材料已被国内外学者广泛研究,国内的研究主要集中在利用基因修饰合成 PHA[3-5]以及利用活性污泥合成PHA[6-7],对PHA在微生物细胞内的生物合成途径和合成PHA的酶的研究没有相关报道。本文介绍了PHA生物合成过程中的相关酶、在微生物细胞内的合成途径以及近年来 PHA的合成研究进展。
1 PHA合成酶
大多数 PHA合成途径相关酶的基因都集中在一个操纵子结构中(图2)。其中PhaC为编码聚合酶,PhaA为编码硫解酶,PhaB为编码还原酶。此外在操纵子附近还有编码凝聚蛋白的PhaP[8]、解聚酶PhaZ[9]、调节酶PhaR的基因[10-11]。在聚合物聚羟基丁酸酯PHB合成过程中,硫解酶和还原酶合成起始羟基丁酰辅酶A(HBCoA)单体,聚合酶催化HBCoA单体聚合生成PHB。
目前,已发现四类PHA合成酶。从R.eutropha和A.vinosum分离纯化得到的分别为Ⅰ型和Ⅲ型合成酶,该两类酶以HBCoA为底物合成短链PHASCL且具有相似的生物催化过程(图3)。第三种纯化得到的PHA合成酶为Ⅱ型,该类酶以中长链3-羟基脂肪酸为底物(R=C3H7~C13H27,图 1)合成中长链的PHAMCL[12-13]。研究发现,Ⅱ型合成酶相对于Ⅰ型和Ⅲ型合成酶转换数非常低。在B. megaterium和Bacillus sp.INT005中分离得到的PHA合成酶为Ⅳ型合成酶,该类酶催化合成短链PHASCL[14-15]。不同类型的合成酶催化不同的底物且具有不同的次级单位(表1)。
Ⅰ型和Ⅲ型合成酶催化机制和脂肪酶的催化机制很相似,脂肪酶结合在胶束状三酰甘油表面上,通过表面和共价催化三酰甘油来水解脂肪酸(图4),脂肪酶的水解催化反应(图5)需要有丝氨酸、组氨酸和天冬氨酸的参与[16]。三酰甘油胶束和PHB在细胞内的储存形式非常相似,都是表面覆盖有一层蛋白的颗粒状物质,目前人们认为PHB合成酶与脂肪酶具有相似的催化动力学模型。Ⅱ型合成酶的研究尚处在起始阶段,对其催化机制和蛋白结构的了解有待进一步研究。

图2 R.eutropha Ⅰ型合成酶和A.vinosumⅢ型合成酶操纵子结构
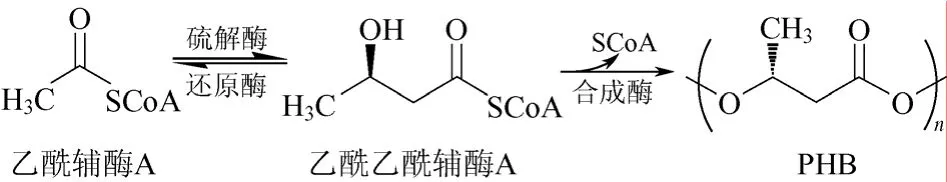
图3 Ⅰ型和Ⅲ型合成酶催化乙酰辅酶A合成PHB

表1 合成酶类型与其对应合成聚合物种类

图4 脂肪酶与三酰甘油束表面作用示意图

图5 脂肪酶催化三酰甘油的表面催化机理图
为更深入的了解PHA合成机理,对PHA合成酶的蛋白质组学,合成酶的三级、四级结构和PHA合成反应动力学的研究成为未来主题。Nikodinovic-Runic等[17]初步探索研究了Pseudomonas putidaCA-3在氮元素限制条件下利用苯乙烯作为唯一碳源合成中长链 PHA的蛋白质组学,对比研究了在氮元素限制和氮元素充足的条件下 PHA生物合成相关的蛋白酶合成情况。Jia等[18-19]也对PHB在细胞内的催化合成机制进行了比较深入的研究。可以预知,随着对 PHA合成酶的深入研究,操纵PHA合成相关酶以便更有效的合成含有特定单体或者具有理想物化性能的PHA将成为可能。
2 PHA生物合成途径
培养基碳源的种类可影响微生物细胞内合成的 PHA链单体组成,因此可把培养基中的碳源分为相关碳源和非相关碳源。微生物在相关碳源培养基中培养时,细胞合成的PHA中的单体结构和培养基中碳源分子结构相同,在非相关碳源培养基中合成 PHA链的单体与培养基中的碳源分子结构不同。
2.1 从非相关碳源合成短链PHASCL途径
葡萄糖在细胞中一般是通过糖酵解途径产生丙酮酸。在有氧条件下,丙酮酸转化成乙酰辅酶A继而进入三羧酸循环。Taguchi等[20]发现了从非相关碳源合成特殊 PHA,即聚乳酸-3羟基丁酸酯(poly[lactide-co-3-hydroxybutyrate])的合成途径(图6 A)。丙酮酸由丙酮酸脱氢酶(LDH)催化生成乳酸,随后丙酰辅酶A转移酶催化乳酸转化成乳酰辅酶A。Taguchi等用特殊改良过的PHA合成酶以乳酰辅酶A和从PhaA B途径(图6 B)得到的PHB为底物合成该共聚物。根据以前的研究,乳酰辅酶 A在细胞内的合成量非常有限,很难整合到PHA聚合物中[21]。因此 Taguchi等的发现在 PHA的合成领域具有重要意义。
图6路线B为人们熟知的合成PHB的途径。酮硫解酶(PhaA)催化两分子的乙酰辅酶A合成乙酰乙酰辅酶 A,随后被还原酶(PhaB)催化合成R-3-羟基丁酰辅酶A,最后PHA合成酶催化R-3-羟基丁酰辅酶A合成PHB。
图6路线C为通过脂肪酸合成途径合成PHB。乙酰辅酶A脱羧酶(AccA)催化乙酰辅酶A生成丙二酰辅酶A,经由丙二酰辅酶A:ACP酰基转移酶(FabD)催化,丙二酰辅酶A生成丙二酰-ACP复合物,再由3-酮酯酰-ACP合成酶Ⅲ(FabH)催化合成乙酰乙酰辅酶A,最后由3-酮酰-ACP还原酶(FabG)和PHA合成酶合成PHB。原生型的FabH蛋白的转酰基活性比较低,通过转基因手段,提高其在细胞内的表达可提高其转酰基能力进而提高PHA的合成能力[22]。
3-羟基丁酸与 3-羟基戊酸共聚物 P(3HB-co-3HV)在海洋作业环境和生物医药方面具有广泛用途,通常情况下可由微生物在含有葡萄糖和丙酸混合碳源条件下合成[23]。图 6路线 D为苏氨酸合成P(3HB-co-3HV) 的途径。首先由苏氨酸脱氨酶催化(IlvA)苏氨酸生成2-酮丁酸,随后由丙酮酸脱氢酶还原 2-酮丁酸生成丙酰辅酶 A,接着酮硫酯酶(BktB)催化生成R-3羟基戊酰辅酶A,PHA合成酶催化R-3羟基戊酸整合到P(3HB-co-3HV)聚合物中。该途径已证实存在于植物细胞中,但是否存在于细菌中还未证实。
图6路线E为从三羧酸循环合成3-羟基戊酸酯的途径。由甲基丙二酸单酰辅酶A变位酶催化琥珀酰辅酶A转变为R-2-甲基丙二酰辅酶A,再由甲基丙二酰辅酶A脱羧酶(YgfgG)催化成丙酰辅酶A,酮硫解酶把丙酰辅酶A转化为3-酮戊酰辅酶A,酮还原酶PhaB催化3-酮戊酰辅酶A转变为R-3-羟基戊酰辅酶A。最后,PHA合成酶(PhaC)以R-3-羟基戊酰辅酶 A为底物合成 3-羟基戊酸聚酯 P(3HV)。
图6路线F为4-羟基丁酸聚酯P(4HB)的合成途径。琥珀酸脱氢酶(SucD)催化琥珀酰辅酶A转变为琥珀酸半醛,再由4-羟基丁酸脱氢酶(4HbD)催化琥珀酸半醛转变为4-羟基丁酸(4HB),接着由4-羟基丁酸辅酶A转移酶(Cat1或者Cat2)把4-羟基丁酸生成4-羟基丁酰辅酶A,最后由PhaC合成4-羟基丁酸聚酯。
2.2 从非相关碳源合成中长链PHAMCL途径
图7为从非相关碳源合成中长链单体的4种途径,这些途径都来源于脂肪酸的生物合成途径。脂肪酸合成途径广泛存在于各类微生物细胞中,为降低 PHA的生产成本,可通过基因重组技术把下述PHA合成系统转移到光合微生物细胞内,因光合微生物可以利用二氧化碳替代传统的糖或者脂肪酸作为碳源来合成 PHA,这样将有效降低 PHA的生产成本。
图7路线A为乙酰辅酶A合成聚3-羟基烷酸酯P(3HA) 途径[24]。乙酰辅酶A经由乙酰辅酶A脱羧酶(AccA)催化生成丙二酰辅酶A,丙二酰辅酶A:ACP酰基转移酶(FabD)催化丙二酰辅酶A生成丙二酰-ACP,再由 3-羟基乙酰-ACP硫酯酶(FabG)合成3-羟基乙酰ACP,3-羟基乙酰ACP经过β氧化途径和PHA合成酶(PhaC)的作用下合成聚3-羟基烷酸酯P(3HA)。Klinke等[25]研究表明,该途径需要去除宿主菌株内β氧化途径中的相关酶的基因才可达到更好的合成效果。

图6 短链PHA的合成途径
图 7路线 B为通过3-羟基乙酰-ACP硫酯酶(FabG)合成 PHA途径。3-羟基乙酰-ACP经由FabG合成3-羟基烷酸,乙酰辅酶A合成酶(AlkK)催化3-羟基烷酸合成3-羟基乙酰辅酶A,再由PHA合成酶催化合成PHA[26-27]。图7路线C、D为重组大肠杆菌在过量葡萄糖的存在下合成PHA的途径。重组菌株带有特异位点的3-酮酰乙酰载体蛋白合成酶Ⅲ的基因的表达,可改变 PHA合成酶对其底物的特异性基因从而可使中长链 PHA共聚物在细胞内得以合成[28-29]。
3 近年来PHA的生物合成
3.1 新发现的合成PHA菌种
到目前为止,发现有过300多种菌种能够合成PHA。尽管如此,人们仍然在寻找理想的合成PHA的菌种。表2为近年来筛选或基因重组得到的具有合成 PHA能力的菌种。从表中可以看出,大部分菌种合成 PHA的能力并不是很高,最高也只能合成占细胞干重的87%。有研究表明,藻类细菌也可以用来合成PHA[37],但是和那些异养细菌相比较,PHA在细胞中的合成量非常低。从表2可以看出,Spirulina subsalsa只能合成占细胞干重的7.45%。虽然藻类细菌合成 PHA的能力非常有限,但是利用该类菌种来合成 PHA同样具有优势。该类微生物能在含有极少营养的条件下生长,可利用太阳能进行光合作用和二氧化碳作为碳源合成PHA,可大大减少PHA的生产成本。
通过基因重组能快速提高微生物合成 PHA能力且可改变微生物胞内合成的 PHA单体组分。近年来,越来越多的基因工程菌被构建用来合成PHA,表3为合成PHA的重组大肠杆菌。Ma等[43]对Pseudomonas putidakt2442进行基因重组,敲除了编码3-羟酰-辅酶A脱氢酶的基因,得到的突变菌株能合成只具有两种单体的中长链PHA。通过敲除该菌株的β-氧化途径的基因fadBA时,以葡萄糖或其它奇数碳原子脂肪酸为碳源,重组菌只合成具有一种单体组分的 PHA,即 3-羟基庚酸酯的均聚物。Jun等[44]通过重新构建重组菌Cupriavidus necatorH16CAc,使得该突变菌合成的中长链PHA中3-羟基戊酸单体组分含量提高。

图7 中长链PHA合成途径
3.2 利用廉价碳源合成PHA
虽然 PHA聚合物具有在自然条件下能被完全降解的优点,可作为传统塑料的替代物。但时至今日,PHA并没有得到大规模的应用。其中最主要的原因是生产 PHA的成本太高,由细菌发酵生产的PHA的成本为传统塑料的5~10倍。所以,只有降低PHA的生产成本,才能使得PHA得到广泛的应用。

表2 近年来发现的合成PHA菌株

表3合成PHA的重组大肠杆菌
在 PHA发酵过程中,培养基碳源占据生产成本的比重很大,有时可达生产成本的50%[50]。为降低成本,可利用相对较廉价的碳源来发酵合成PHA。有学者利用植物油、糖浆、乳清等廉价碳源来合成生产 PHA[51-53]。Haas等[54]利用土豆淀粉作为碳源,用R.eutrophaNCIMB 11559合成PHB,得到了179 g/L的细胞浓度,其中PHA占细胞干重的55%。Sheu等[55]研究了用淀粉和戊酸为混合碳源,Caldimonas taiwanensis在氮限制的条件下(C/N比为30)来合成杂聚物P(3HB-co-3HV)。在50 ℃、32 h的培养条件下,该菌种利用戊酸作为3-羟基戊酸的前体,通过控制戊酸的浓度,可以控制PHA中的3-羟基戊酸(3HV)组分的摩尔分数从10%到95%。
利用工业废弃物作为廉价碳源来合成生产PHA不仅能降低其生产成本,更具有环保意义。Mohd等[30]利用棕油厂排出物作为Comamonassp. EB172的碳源来合成P(HB-co-HV)杂聚物,通过调节培养基起始pH值可以控制杂聚物中的3-羟基戊酸成分为45%~86%(摩尔分数),得到的杂聚物数均分子量为153~412 kD。Bengtsson等[56]用活性污泥处理造纸厂废水可得到聚羟基丁酸戊酸酯(PHBV),通过 3个阶段的处理过程,其 PHBV杂聚物含量占污泥干重的48.2%。 Herrema等[57]发明一种方法:利用挥发性有机化合物(VOC)作为廉价碳源来合成PHA,VOC先经过甲烷-氧化微生物处理,该类微生物中含有一种为甲烷单氧酶(MMO)的催化剂,该催化剂能把VOC氧化成具有PHA合成能力的微生物可利用的碳源。利用此方法,细胞中合成的 PHA含量最高可达细胞干重的75%,1 kg的VOC可合成得到0.25 kg的PHA。
最近,有人研究利用食品加工废弃物作为生物质精炼的原料来生产更具有附加的值产品[58]。乳清是常见的食品工业废弃物,是奶酪生产过程中的主要副产品。因乳清废水具有很高的需氧量,直接排放容易引起周围环境水体恶化。Koller等[53]发现水解后的乳清可被Pseudomonas hydrogenovora利用来合成PHB,最终可得到5 g/L的生物量,其中PHB占细胞干重的12%。在以脱蛋白乳清和乳酸为混合碳源时,具有Azotobactersp.FA8 PHA合成酶的重组大肠杆菌E. coliK24K最终的生物量可达 58.2 g/L,合成的 PHB的占细胞干重的46.9%。
4 展 望
目前虽然发现了很多种由不同单体组成的PHA,但商业化规模生产的只有PHB和P(3HB-3HV)两种聚合物。原因之一是和已有的石化塑料相比,PHA的热机械性质和加工特性相对较差,应用范围比较窄,只能作为一般的食品包装塑料等较低级的功能来使用;另一个重要的原因就是生产 PHA的成本太高(4~6 USD/kg),远远高于传统的石化塑料的价格。
随着对 PHA生物合成途径的深入理解和对合成过程中的相关酶进行操纵,辅以基因重组技术可筛选高产量PHA的细菌,将显著地降低PHA的生产成本。一方面,筛选能利用廉价碳源来合成PHA的菌种可进一步降低 PHA的成本,如上所述的Spirulina subsalsa,虽然其细胞内的PHB的含量比较低,但该菌种能利用光合作用以CO2为碳源,在开放的环境中培养合成PHB,不需要灭菌的相关操作,因而可大幅度地降低PHA的生产成本;另一方面,通过对细菌合成PHA过程中的相关酶基因进行修饰,结合不同的发酵策略可以改变PHA中的单体组成,使得PHA具有不同的力学和加工性能,拓宽PHA的应用范围。随着PHA的生产成本降低和加工性能的改善,PHA必将得到广泛的应用。
[1] Lenz R W,Marchessault R H. Bacterial polyesters:Biosynthesis,biodegradable plastics and biotechnology[J].Biomacromolecules, 2005,6:1-8.
[2] Steinbuchel A,Non-biodegradable biopolymers from renewable resources:Perspectives and impacts[J].Current Opinion in Biotechnology,2005,16:607-613.
[3] 甘智雄,莫晓燕,陈国强,等. 嗜水气单胞菌WQ中PHBHHx 的合成及其分子基础研究[J]. 微生物学报,2003,43(6):809-812.
[4] 卢晓云,吴琼,张万皎,等. 嗜水气单胞菌合成含32羟基戊酸单体的聚羟基脂肪酸共聚酯的研究[J]. 生物工程学报,2004,20(5):779-782.
[5] 胡风庆,游松,陈国强. 中长链聚羟基脂肪酸酯(m cl PHA)在嗜水气单胞菌 I 型 PHA 合酶缺失突变株中的合成[J]. 生物工程学报,2005,21(4):524-529.
[6] 谢光健,李家洲.利用有机废水生产聚羟基烷酸(PHAs)的进展[J].广东化工,2005(7):34-36.
[7] 杨幼慧,伍朝晖,钟士清,等.食品工厂活性污泥积累生物降解塑料PHA的研究[J].食品与发酵工业,2002,28(8):5-8.
[8] Wieczorek R,Pries A,Steinbüchel A,et al. Analysis of a 24-kilodalton protein associated w ith the polyhydroxyalkanoic acid granules inAlcaligenes eutrophus[J].Journal of Bacteriology,1995,177:2425-2435.
[9] Saegusa H,Shiraki M,Kanai C,et al. Cloning of an intracellular poly [d({-})-3-hydroxybutyrate] depolymerase gene from ralstonia eutropha h16 and characterization of the gene product[J].Journal of Bacteriology,2001,183:94-100.
[10] Maehara A,Doi Y,Nishiyama T,et al. PhaR,a protein of unknown function conserved among short-chain-length polyhydroxyalkanoic acids producing bacteria,is a DNA-binding protein and represses Paracoccus denitrificans phaP expression in vitro[J].FEMS Microbiology,Letters,2001,200:9-15.
[11] Potter M,Madkour M H,Mayer F,et al. Regulation of phasin expression and polyhydroxyalkanoate(PHA)granule formation inRalstonia eutrophaH16[J].Microbiology(Reading,UK),2002,148:2413-2426.
[12] Qi Q,Steinbüchel A,Rehm B H. In vitro synthesis of poly(3-hydroxydecanoate):Purification and enzymatic characterization of type Ⅱpolyhydroxyalkanoate synthases PhaC1 and PhaC2 fromPseudomonas aeruginosa[J].Applied Microbiology and Biotechnology,2000,54:37-43.
[13] Rehm B H,Qi Q,Beermann B B,et al,Matrix-assisted in vitro refolding of Pseudomonas aeruginosa class Ⅱpolyhydroxyalkanoate synthase from inclusion bodies produced in recombinantEscherichia coli[J].Biochemical Journal,2001,358:263-268.
[14] McCool G J,Cannon M C. PhaC and PhaR are required for polyhydroxyalkanoic acid synthase activity in Bacillus megaterium[J].Journal of Bacteriology,2001,183:4235-4243.
[15] Satoh Y,M inamoto N,Tajima K,et al. Polyhydroxyalkanoate synthase fromBacillus sp. INT005 is composed of PhaC and PhaR[J]Journal of Bioscience and Bioengineering,2002,94:343-350.
[16] Karlsson M,Contreras J A,Hellman U,et al,cDNA cloning,tissue distribution,and identification of the catalytic triad of monoglyceride lipase[J].The Journal of Biology Chemistry,1997,272:27218-27223.
[17] Nikodinovic-Runic J ,Flanagan M,Hume A R. Analysis of thePseudomonas putidaCA-3 proteome during grow th on styrene under nitrogen-limiting and non-limiting conditions[J].Microbiology, 2009,155:3348-3361.
[18] Jia Y,Yuan W,Wodzinska J,et al. Mechanistic studies on classⅠpolyhydroxybutyrate(PHB)synthase fromRalstonia eutropha:ClassⅠand Ⅲ synthases share a sim ilar catalytic mechanism[J].Biochemistry,2001,40:1011-1019.
[19] Jia Y,Kappock T J,Frick T,et al. Lipases provide a new mechanistic model for polyhydroxybutyrate(PHB)synthases:Characterization of the functional residues in chromatium vinosum PHB synthase[J].Biochemistry,2000,39:3927-3936.
[20] Taguchi S,Yamada M, Matsumoto K,et al. A m icrobial factory for lactate-based polyesters using a lactate-based polyesters using a lactate-polymerizing enzyme[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105:17323-17327.
[21] Valentin H E,Steinbüchel A. Application of enzymatically synthesized short-chain-length hydroxy fatty acid coenzyme A thioesters for assay of polyhydroxyalkanoic acid synthases[J].Applied Microbiology and Biotechnology,1993,40:699-709.
[22] Nomura C T,Taguchi K,Gan Z,et al. Expression of 3-ketoacyl-ACP reductase(fabG)enhances polyhydroxyalkanoate copolymer production from glucose in recombinantEscherichia coliJM 109[J].Applied and Environmental Microbiology,2005,71:4297-4306.
[23] Slater S,Houm iel K L,Tran M,et al .Multiple beta-ketothiolases mediate poly(beta-hydroxyalkanoate)copolymer synthesis inRalstonia eutropha[J].Journal of Bacteriology,1998,180:1979-1987.
[24] Rehm B H,Steinbüchel A. Heterologous expression of the acyl-acyl carrier protein thioesterase gene from the plant Umbellularia californica mediates polyhydroxyalkanoate biosynthesis in recombinantEscherichia coli[J].Applied Microbiology and Biotechnology,2001,55:205-209.
[25] Klinke S,Ren Q,Witholt B,et al. Production of mediumchain-length poly(3-hydroxyalkanoates)from gluconate by recombinantEscherichia coli[J].Appl. Environ. Microbiol.,1999,65:540-548.
[26] Aquin S,Peoples O,Snell K. Production of medium chain length polyhydroxyalkanoates from fatty acid biosynthetic pathways: US,20030017576 A1[P]. 2003-01-23.
[27] Satoh Y,Murakam i F,Tajima K,et al. Enzymatic synthesis of poly(3-hydroxybutyrate-co-4-hydroxybutyrate)w ith CoA recycling using polyhydroxyalkanoate synthaseand acyl-CoA synthetase[J].Journal of Bioscience and Bioengineering,2005,99:508-511.
[28] Nomura C T,Taguchi K,Taguchi S,et al. Coexpression of genetically engineered 3-ketoacyl-ACP synthase Ⅲ(fabH)and polyhydroxyalkanoate synthase( phaC ) genes leads to short-chain-length-medium-chain-length polyhydroxyalkanoate copolymer production from glucose inEscherichia coliJM 109[J].Applied and Environmental Microbiology,2004,70:999-1007.
[29] Nomura C T,Tanaka T,Gan Z,Kuwabara K,et al. Effective enhancement of short-chain-length(SCL)-medium-chain-length( MCL) polyhydroxyalkanoate copolymer production byco-expression of genetically engineered 3-ketoacylacyl- carrier protein synthase Ⅲ(fabH)and polyhydroxyalkanoate synthesis genes[J].Biomacromolecules,2004,5:1457-1464.
[30] Mohd Rafein Zakaria,Hidayah Ariffin,Noor Azman Mohd Johar,et al. Biosynthesis and characterization of poly(3-hydroxybutyrate-co-3-hydroxyvalerate)copolymer from w ild-typeComamonassp. EB172[J].Polymer Degradation andStability,2010,95:1382-1386.
[31] Anupama Shrivastav,Sanjiv K M ishra,Bhum i Shethia,et al. Isolation of prom ising bacterial strains from soil and marine environment for polyhydroxyalkanoates(PHAs)production utilizing Jatropha biodiesel byproduct[J].International Journal of Biological Macromolecules,2010,47:283-287.
[32] Kouhei M izuno,Aya Ohta,Manam i Hyakutake,et al. Isolation of polyhydroxyalkanoate-producing bacteria from a polluted soil and characterization of the isolated strainBacillus cereusYB-4[J].Polymer Degradation and Stability,2010,95:1335-1339.
[33] Kesaven Bhubalan,Devi-Nair Rathi,Hideki Abe,et al. Improved synthesis of P(3HB-co-3HV-co-3HHx)terpolymers by mutantCupriavidus necatorusing the PHA synthase gene ofChromobacteriumsp. USM 2 w ith high affinity towards 3HV[J].Polymer Degradation and Stability,2010,95:1436-1442.
[34] Ng Ko Sin,Ooi Wei Yang,Goh Lay Koon,et al. Evaluation of jatropha oil to produce poly(3-hydroxybutyrate) byCupriavidus necatorH16[J].Polymer Degradation and Stability,2010,95:1365-1369.
[35] Jian Jia,Li Zheng Jun,Ye Hai Mu,et al. Metabolic engineering for m icrobial production of polyhydroxyalkanoates consisting of high 3-hydroxyhexanoate content by recombinantAeromonas hydrophila[J].Bioresource Technology,2010,101:6096-6102.
[36] Jun M ifune,Satoshi Nakamura,Toshiaki Fukui. Engineering of pha operon onCupriavidus necatorchromosome for efficient biosynthesis of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate)from vegetable oil[J].Polymer Degradation and Stability,2010,95:1305-1312.
[37] Anupama Shrivastav,Sanjiv K M ishra ,Sandhya M ishra. Polyhydroxyalkanoate(PHA)synthesis bySpirulina subsalsafrom Gujarat coast of India[J].International Journal of Biological Macromolecules,2010,46:255-260.
[38] Wang Honghui,Li Xiaotao ,Chen Guoqiang. Production and characterization of homopolymer polyhydroxyheptanoate(P3HHp)by a fadBA knockout mutantPseudomonas putidaKTOY06 derived from P. putida KT2442[J].Process Biochemistry,2009,44:106-111.
[39] Kalacheva Boyandin G,Volova T. Production of polyhydroxyalkanoates byluminous bacteria[J].New Biotechnology,2009,25(S):59-60.
[40] Anastasia A Pantazaki,Christos P Papaneophytou,Agathi G Pritsa,et al. Production of polyhydroxyalkanoates from whey byThermus thermophilusHB8[J].Process Biochemistry,2009,44:847-853.
[41] Katsutoshi Hori,Atsushi Kobayashi,Hiroshi Ikeda,et al. Rhodococcus aetherivorans IAR1,a new bacterial strain synthesizing poly(3-hydroxybutyrate-co-3-hydroxyvalerate)from toluene[J].Journal of Bioscience and Bioengineering,2009,107:145-150.
[42] Sureshbabu Ram Kumar Pandian,Venkatraman Deepak,Kalimuthu Kalishwaralal,et al. Synthesis of PHB nanoparticles from optim ized medium utilizing dairy industrial waste usingBrevibacterium caseiSRKP2:A green chem istry approach[J].Colloids and Surfaces B:Biointerfaces,2009,74:266-273.
[43] Ma L,Zhang Haifeng,Liu Qian,et al. Production of two monomer structures containing medium-chain-length polyhydroxyalkanoates byβ-oxidation-impaired mutant ofPseudomonas putidaKT2442[J].Bioresource Technology,2009,100:4891-4894.
[44] Jun M ifune,Satoshi Nakamura,Toshiaki Fukui,et al. Engineering of pha operon onCupriavidus necatorchromosome for efficient biosynthesis of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate)from vegetable oil[J].Polymer Degradation and Stability,2010,95:1305-1312.
[45] de Groot J H,Zijlstra F M,Kuipers H W,et al,Meniscal tissue regeneration in porous 50/50 copoly(l- lactide/e-caprolactone)implants[J].Biomaterials,1997,18:613–622.
[46] Fine E G,Magari S R,Rousseau S,et al. Proceedings of the 20th Annual Meeting of the Society for Biomaterials[C]//Boston,USA. 1994:279.
[47] Futui T,Kichise T,et al. Biosynthesis of poly(3- hydroxybutyrateco-3-hydroxyvalerate-co-3-hydroxyheptanoate) terpolymers by recombinantAlcaligenes eutrophus[J].Biotechnology Letters,1997,19:1093-1097.
[48] Chu C R,Dounchis J S,Yashiola M,et al. Osteochondral repair using perichondrial cells. A 1-year study in rabbits[J].Clinical Orthopaedics & Related Research,1997,340:220-229.
[49] Ramadas N V,Singh S K,Soccol C R,et al. Polyhydroxybutyrate production using agro-industrial residue as substrate byBacillus sphaericusNCIM 5149[J].Brazilian Archives of Biology and Technology,2009,52:17-23.
[50] Kim B S. Production of PHB from inexpensive substrates[J].Enzyme and Microbial Technology,2000,27:774-777.
[51] Shang L,Jiang M,Yun Z,et al. Mass production of medium-chain-length poly(3-hydroxyalkanoates)from hydrolyzed corn oil by fed-batch culture ofPseudomonas putida[J].World Journal of Microbiology and Biotechnology,2008,24:2783-2787.
[52] Albuquerque M G E,Eiroa M,Torres C,et al. Strategies for the development of a side steam process for polyhydroxyalkanoate(PHA)production from sugar cane molasses[J].Journal of Biotechnology,2007,130(4):411-421.
[53] Koller M,Bona R,Chiellini E,et al. Polyhydroxyalkanoate production from whey byPseudomonas hydrogenovora[J].Bioresource Technology,2008,99(11):4854-4863.
[54] Haas R,Jin B ,Zepf F T. Production of poly(3-hydroxybutyrate)from waste potato starch[J].Bioscience,Biotechnology,and Biochemistry,2008,72:253-256.
[55] Sheu Der Shyan,Chen Wen M ing,Yang Jr Yung,et al. Thermophilic bacteriumCaldimonas taiwanensisproduces poly ( 3-hydroxybutyrate-co-3-hydroxyvalerate)from starch and valerate as carbon sources[J].Enzyme and M icrobial Technology,2009,44:289-294.
[56] Bengtsson Simon,Werker A lan,Christensson Magnus,et al. Production of polyhydroxyalkanoates by activated sludge treating a paper mill wastewater[J].Bioresource Technology,2008,99:509-516.
[57] Herrema,et al. Method for the production of polyhydroxyalkanoic acid:US,20070202581[P]. 2009-08-25.
[58] Di Donato P,Anzelmo G,et al. Vegetable wastes as suitable biomass feedstock for biorefineries[J].New Biotechnology,2009,25:S257.
Advance in biosynthesis of polyhydroxyalkanoate
HUANG Jinbiao1,SHANG Long’an2
(1Department of Chemical and Biochemical Engineering,Zhejiang University,Hangzhou 310027,Zhejiang,China;2Ningbo Institute of Technology,Zhejiang University,Ningbo 315100,Zhejiang,China)
Polyhydroxyalkanoate(PHA)is a type of polymer which can be synthesized by a variety of microbes. This new kind of material can be used as a substitute for the traditional petrochemical plastics because of its complete bio-degradability. PHA biosynthesis paths in different microbes have been studied w idely and extensively to these days. In order to reduce PHA price and realize industrialisation,many researches have been focused on screening high-productivity strain and using cheap carbon source to synthesis PHA. This review introduces the PHA biosynthesis pathways and advance in biosynthesis of PHA.
polyhydroxyalkanoates;biosynthesis;bio-degradable plastics;cheap carbon resource
TQ 321
A
1000–6613(2011)09–2041–08
2011-03-24;修改稿日期:2011-04-11。
黄锦标(1982—),硕士。联系人:尚龙安,教授。E-mail lashang@nit.net.cn。

