壳聚糖衍生物的表面活性及其药物增溶性研究进展
胡印滔,辛梅华,李明春
(华侨大学材料科学与工程学院,环境友好功能材料教育部工程中心,福建 厦门 361021)
进展与述评
壳聚糖衍生物的表面活性及其药物增溶性研究进展
胡印滔,辛梅华,李明春
(华侨大学材料科学与工程学院,环境友好功能材料教育部工程中心,福建 厦门 361021)
壳聚糖基表面活性剂具有安全无毒和可生物降解等特点,在生物医药和日用化工等行业的应用日益增多。通过双亲性改性获得具有表面活性的壳聚糖所形成的胶束,可以增加难溶药物的溶解度,延长释药时间,提高药物利用率,降低细胞毒性,在药物载体方面具有广阔的应用前景。本文综述了近年来偶联、烷基化、酰基化、羧甲化、季铵化等改性壳聚糖衍生物的表面活性研究以及对紫杉醇、喜树碱、阿霉素和甲氨基叶酸等药物的增溶应用进展。在壳聚糖的改性新方法中有两点值得注意:一是利用疏水相互作用构成自组装体;二是引入具有特殊功能的基团制备智能载药胶束。
改性壳聚糖;表面活性;自组装;药物增溶
表面活性剂是两亲性物质,已广泛用于洗涤、纺织、医药、农药和药剂制备等领域。壳聚糖是一种安全无毒、可生物降解并具有良好生物相容性的天然高分子材料,壳聚糖的表面活性早已引起人们关注。但由于壳聚糖中缺乏有效的疏水结构,不能稳定地吸附在界面上,使得单纯的壳聚糖表面活性很小;并且壳聚糖只溶于稀酸,限制了其应用范围。因此,近几年通过化学改性将疏水性和亲水性的功能基团接枝到壳聚糖上,制备具有较高表面活性壳聚糖衍生物的研究非常活跃。本文综述了近年来改性壳聚糖衍生物的表面活性以及在药物增溶方面的应用研究。
1 壳聚糖及其衍生物的表面活性
1.1 壳聚糖的表面活性
壳聚糖分子本身没有足够大的疏水基团,但在较高的pH值下,氨基的质子化程度较低,壳聚糖分子链表现出一定的疏水性,依靠分子内部疏水基团的相互作用而聚集。Amiji等[1]采用稳态荧光法研究了壳聚糖在水中的聚集情况,结果表明壳聚糖有一定的表面活性。陈天等[2]研究发现壳聚糖可以将水的表面张力降低几个 mN/m,在水中的临界聚集浓度(CAC)约为0,即单个分子就可以发生聚集。Payet等[3]用液体石蜡和壳聚糖水溶液制备了 O/W乳液,通过检测石蜡与水的界面张力发现,壳聚糖虽然只有很小的表面活性,但对油/水的乳化具有很好的稳定作用。
1.2 壳聚糖及其衍生物的表面活性
1.2.1 偶联改性壳聚糖衍生物的表面活性
偶联改性是用 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N,N-二环己基碳二亚胺(DCC)等偶联剂将含有羧基的功能性基团接枝到壳聚糖游离氨基上的改性方法。借助偶联改性将一些疏水的天然小分子接枝于壳聚糖上,可以提高壳聚糖的表面活性。
脱氧胆酸是胆酸失去一个氧原子的衍生物,微溶于水,本身具有表面活性,脱氧胆酸改性可以提高壳聚糖的表面活性。Kim等[4]制备了脱氧胆酸改性羟乙基壳聚糖,随着脱氧胆酸取代度的增大,产物的CAC从0.26 mg/mL降低到0.038 mg/mL,可自组装形成粒径在245~450 nm的胶束,并且脱氧胆酸的取代度越高,胶束直径越小,稳定性也越高。Li等[5]制备了N-脱氧胆酸-N,O-羟乙基壳聚糖,稳态荧光法测得,随着脱氧胆酸取代度的增大,CMC从0.26 mg/mL降低到0.16 mg/mL。Zhou等[6]制备了N-脱氧胆酸-N-丙二醇壳聚糖,随着脱氧胆酸取代度的增大,其产物的自聚能力增强,可形成直径为160~210 nm的胶束。
5β-胆甾烷酸与脱氧胆酸类似,因具有表面活性而产生乳化、增溶、吸附脂溶性物质等作用。Kwon等[7]用EDC和NHS将5β-胆甾烷酸接枝到羟乙基壳聚糖分子链上(图1),提高了衍生物的疏水性,测得CAC为0.047~0.219 mg/mL,并且随着5β-胆甾烷酸取代度的增大而降低。该课题组的 Kim等[8-9]同样制备了 5β-胆甾烷酸改性的羟乙基壳聚糖,制备产物的CAC为0.03 mg/mL,可形成粒径为200 nm的自组装纳米粒。
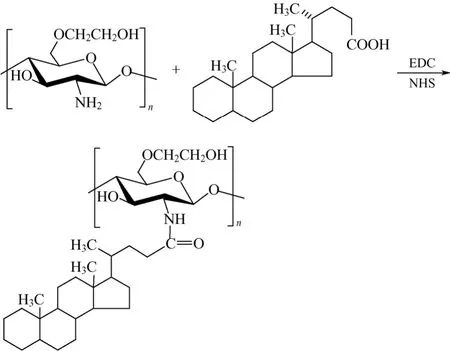
图1 5β-胆甾烷酸羟乙基壳聚糖的合成路线
胆固醇溶解性与脂肪类似,不溶于水。Wang等[10]以琥珀酸酐为桥键将胆固醇接枝于O-羧甲基壳聚糖主链上,提高了产物的疏水性,制备了胆固醇-O-羧甲基壳聚糖,测得其 CAC为 0.65~3 mg/mL,可形成粒径为100.1~234.9 nm的球状自组装纳米粒。由于羧甲基带有负电荷,纳米粒子的形态和稳定性都比没有羧甲基改性的胆固醇壳聚糖好。
亚麻酸是一种天然产物,通过亚麻酸改性可赋予壳聚糖优良的表面活性和生物相容性。Liu等[11]用 EDC作为偶联剂制备了亚麻酸改性壳聚糖,测得CAC为 0.05mg/mL,在PBS中可形成平均粒径为210.8 nm 的球状自组装纳米粒。
1.2.2 烷基化改性壳聚糖衍生物的表面活性
烷基化是壳聚糖重要的疏水化改性方法,将水溶性壳聚糖进行烷基化改性是制备具有表面活性壳聚糖衍生物的常用方法。Ortona等[12]用脂肪醛制备了高取代的烷基化壳聚糖,研究表明烷基链较短的戊基和己基壳聚糖的表面活性不明显,而烷基链较长的辛基、癸基和十二烷基壳聚糖有较明显的表面活性。但烷基化壳聚糖的水溶性较差,往往需要制备水溶性的烷基化壳聚糖。Zhang等[13-16]制备了系列N-烷基-O-硫酸酯壳聚糖,其 CMC为 0.45 mg/mL[14]。Huo 等[17]制备了N-辛基-O-羟丙基壳聚糖,随着辛基取代度的增大,其CMC从32.5 mg/L降低到5.3 mg/L。本课题组[18]制备了系列N-辛基-N,O-羧甲基壳聚糖,产物具有表面活性,能显著降低水的表面张力,测得CMC为0.059 mg/mL。
含有相邻羧基的酰胺基的水解具有 pH响应性[19],因此将具有相邻羧基的酰胺结构引入到壳聚糖中,产物的水溶性对pH值具有响应性。Li等[20]制备了N-辛基-N-(2-羧基苯甲酰基)壳聚糖,测得其CMC为0.07~0.32 mg/mL,并且辛基取代度越高,临界胶束浓度越低。该课题组的Liu等[19]制备了N-辛基-N-(2-羧基环己甲酰基)壳聚糖,随着辛基取代度的增大,溶液的CMC从50 μg/mL降低到11 μg/mL。由于产物中含有对pH值敏感的酰胺基团,随着pH值的下降,酰胺基团水解程度增大,产物的水溶性下降。所形成的胶束对酸敏感,在生理酸碱条件下比较稳定。
3-O-十二烷基-D-葡萄糖结构中存在半缩醛结构,易与壳聚糖氨基发生席夫碱反应。Ngimhuang等[21]制备了 3-O-十二烷基-D-葡萄糖改性的壳聚糖,在壳聚糖分子中引入了亲水的羟基和疏水的十二烷氧基,测得其CAC低于同样含有十二烷基链的 SDS,并且随着疏水基取代度的增大而减小。
壳聚糖的游离氨基和羟基可与含有环氧基团的分子发生反应,生成壳聚糖醚化或N-烷基化衍生物。范金石等[22-23]制备了(2-羟基-3-十二烷氧基)丙基-羟丙基壳聚糖高分子表面活性剂,产物具有良好的水溶性和表面活性,并且分子量越低降低表面张力的能力越强;其CMC呈现先随分子量的降低而增大后又减小的变化趋势。Sui等[24-25]制备了系列(2-羟基-3-十二烷氧基)丙基-羧甲基壳聚糖和(2-羟基-3-丁烷氧基)丙基-琥珀酰壳聚糖(图 2),研究了产物的表面活性和聚集行为,发现疏水烷基链的引入可以减小体系的表面张力,较高的疏水烷基链取代度和电解质 NaCl的加入有利于表面张力的减小和分子聚集。
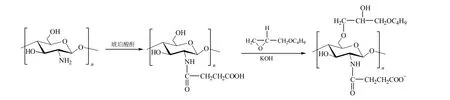
图2 (2-羟基-3-丁烷氧基)丙基-琥珀酰壳聚糖的合成路线
壳聚糖在水溶液中形成的胶束很不稳定,经烷基化改性的壳聚糖其疏水性烷基链在界面上聚集,使壳聚糖骨架能在界面上停留而显著降低表面张力,并且取代度越高降低表面张力的效率越高。长链烷基疏水作用增强,在水中胶束更加紧密,稳定性大大提高。所以烷基化改性是提高壳聚糖表面活性和胶束稳定性的有效方法。
1.2.3 酰基化改性壳聚糖衍生物的表面活性
壳聚糖可以与酸酐或酰氯发生酰化反应,酰化壳聚糖衍生物在有机相或水相的溶解性大大增加。Jiang等[26-27]制备了系列N-酰化壳聚糖,CAC达1.99×10-3mg/mL,可形成粒径为140~278 nm的球状胶束。其中N-十六酰化壳聚糖随着酰基取代度的增加,胶束的疏水性内核更加紧密,直径从608 nm降低到140 nm。Zhu等[28]制备了N-琥珀酰壳聚糖,无细胞毒性、细胞亲和力好,测得其没有明显的CAC,但由于氢键作用和疏水基的相互作用,可以形成粒径为50~100 nm的纳米粒。Xu等[29]制备了N-丁二酰化-N'-辛基壳聚糖,测得CMC为(0.59~3.1)×10-5g/mL,并呈现随辛基取代度的增大而降低的规律。
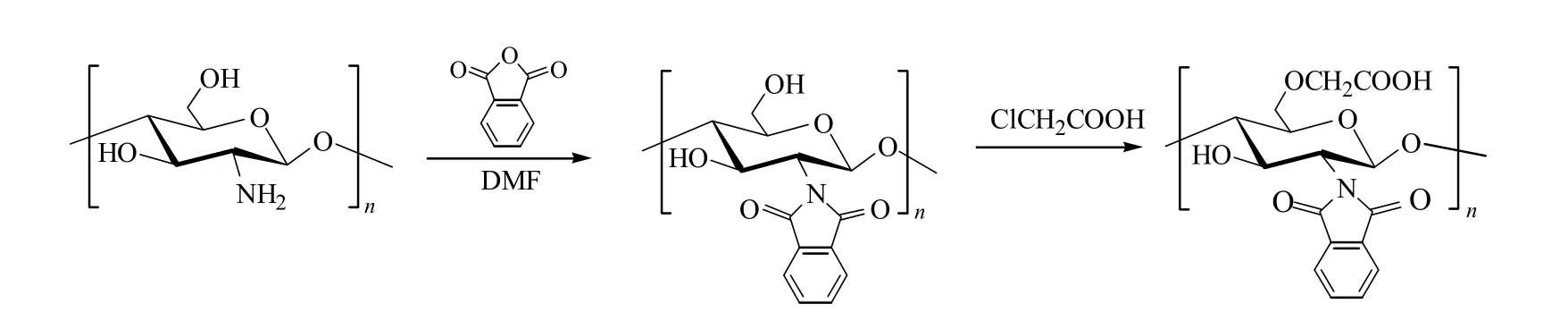
图3 N-邻苯二甲酰-O-羧甲基壳聚糖的合成路线
用酰化的方法提高水溶性壳聚糖的疏水性,可以改善产物的表面活性。Peng等[30-31]制备了N-邻苯二甲酰-O-羧甲基壳聚糖(图3),测得CMC为0.20 mg/mL。Liu等[32]制备了系列N-烷酰化-O-羧甲基壳聚糖,随着酰化烷基侧链长度和取代度的增加,产物形成胶束的浓度降低,其 CAC低于羧甲基壳聚糖。Li等[33]制备了油酰化羧甲基壳聚糖,测得其CAC为45.6 mg/L。由于疏水的油酰基发生相互作用,有利于分子的聚集和疏水内核的形成,胶束的平均粒径为161.8 nm,比之前制备的羧甲基壳聚糖胶束(275.3 nm)要小。
1.2.4 羧甲基化改性壳聚糖衍生物的表面活性
羧甲基化改性壳聚糖水溶性好,具有优良的保湿性和成膜性,单纯的羧甲基壳聚糖即具有表面活性。Zhu等[34]制备了O-羧甲基壳聚糖,其CAC为0.050 mg/mL。但O-羧甲基壳聚糖缺乏高效的疏水基团,经疏水化改性的羧甲基壳聚糖的表面活性更加明显。隋卫平等[35-36]制备了系列(2-羟基-3-烷氧基)丙基-羧甲基壳聚糖,发现疏水烷基链的链长越长、取代度越高,降低表面张力的能力及效率越高。Zhang等[37]制备了系列N-辛基-N,O-羧甲基壳聚糖,测得CMC为8.7~27.7 mg/L。
1.2.5 季铵化改性壳聚糖衍生物的表面活性
季铵化是制备水溶性壳聚糖衍生物的重要方法。Uchegbu等[38]制备了N,N,N-三甲基-N-十六酰化-O-羟乙基壳聚糖,产物具有表面活性,对油溶性物质有明显的增溶作用。作者课题组[39]制备了系列N-甲基-N,N-双长链烷基化壳聚糖季铵盐,产物能显著降低乙醇溶液的表面张力,并且烷基链的长度越长、季铵化取代度越高,降低溶液表面张力的能力越强。Zhang等[40]制备了N-辛基-N-三甲基壳聚糖,产物可自组装形成胶束。
将长链烷基和季铵盐基团接枝于壳聚糖主链上是提高其表面活性的有效方法。褚春莹等[41-42]制备了阳离子表面活性剂(2-羟基-3-二甲基十四烷基铵基)丙基甲壳低聚糖,其有较高的表面活性并能与正丁醇、正己烷及水形成四组分的微乳液。作者课题组[43]用自制的 3-氯-2-羟丙基三甲基氯化铵与壳聚糖反应制备了O-季铵盐-N,N-双烷基壳聚糖,与水的表面接触角比未季铵化的疏水性N,N-双烷基壳聚糖明显降低,具有表面活性。
1.2.6 其它改性壳聚糖衍生物的表面活性
聚乙二醇(PEG)具有良好的水溶性、柔韧性、生物相容性和生物降解性。PEG改性的壳聚糖往往会保留PEG的优良性能,其自组装形成的胶束表面由于长链亲水基团的存在,能有效减少血浆中蛋白质和血小板的黏附作用,具有较好的血液相容性。Yang等[44]用甲醛作为交联剂制备了 mPEG改性壳聚糖,PEG链的引入不仅增加了产物的溶解性,而且使分子链更加柔顺,有利于胶束的形成。随着PEG取代度的增大,产物的CMC从0.05 mg/mL升高到 0.082 mg/mL,平均粒径从 286.6 nm降低到258.6 nm。
近年来研究者将目光转向壳聚糖的多官能团改性,将多种基团引入到水溶性的 PEG化壳聚糖中,可大大提高其性能,拓宽其应用范围。Sagnella等[45]将亲水性 PEG基团和疏水性己烷基团引入到壳聚糖主链上,制备了壳聚糖基高分子表面活性剂,能显著降低产物/水界面的接触角。Opanasopit等[46]制备了 PEG 改性的N-邻苯二甲酰基壳聚糖,其CMC 可达 28 μg/mL。Yao等[47-48]制备了系列N-mPEG-N-辛基-O-硫酸酯钠壳聚糖,其临界胶束浓度为0.011~0.079 mg/mL,并随着辛基、硫酸酯钠和壳聚糖单元取代度的增大而减小,随着mPEG取代度的增大而增大。Cai等[49]制备了PEG改性的己酰化壳聚糖,其CAC为6.61×10-6g/mL,受PEG取代度的影响不大。但胶束的平均粒径随PEG取代度的增大而减小,并且当pH值从7.2 降至 6.8时,纳米粒的平均粒径从180 nm降至60 nm,具有pH值相应性。Ngawhirunpat等[50]制备了PEG改性的胆酸壳聚糖,CMC最低为7.08 μg/mL,可形成直径约为93 nm的胶束。
随着生物医药领域研究的不断深入,具有细胞靶向性的基团开始用于壳聚糖的改性。Lin等[51]用PEG和具有肝靶向的半乳糖对壳聚糖进行改性,其中间产物 2-N-邻苯二甲酰基壳聚糖-O-PEG具有表面活性,CMC为0.56 mg/mL,可形成粒径为 294.5 nm的胶束。Sahu等[52]用具有细胞靶向性的叶酸改性羧甲基壳聚糖,产物可自组装形成纳米粒,平均直径为150 nm。
2 改性壳聚糖衍生物的药物增溶性
由于改性壳聚糖衍生物具有优良的表面活性,可自组装形成纳米级的胶束,胶束的内核由疏水性的基团组成,可使一些难溶性药物的溶解性大大提高。
2.1 改性壳聚糖衍生物对紫杉醇药物的增溶性
紫杉醇是一种有效的抗癌药物,但水溶性很差(溶解度约为0.001 mg/mL),限制了药效的发挥。Zhang等[13-16]制备了载紫杉醇的N-辛基-O-硫酸酯壳聚糖胶束,在胶束溶液中紫杉醇的浓度可达2.01 mg/mL,远高于紫杉醇在水中的溶解度。Kim 等[8]用 5β-胆甾烷酸改性的壳聚糖制备了载紫杉醇的自组装纳米粒,载药量达10%,直径范围为200~400 nm。Yao等[47-48]以N-mPEG-N-辛基-O-硫酸酯钠壳聚糖制备了载紫杉醇的胶束,直径为100~130 nm,紫杉醇在胶束溶液中的浓度达3.94 mg/mL,并发现了结晶性较差的样品,分子链比较容易弯曲,增溶效果较好。
Zhang等[37]用N-辛基-N,O-羧甲基壳聚糖制备了载紫杉醇胶束,载药率32.17%,包封率80.61%,胶束粒径约为202 nm,Liu等[19-20]分别用N-辛基-N-(2-羧基苯甲酰基)壳聚糖和N-辛基-N-(2-羧基环己甲酰基)壳聚糖制备了载紫杉醇胶束,其载药率分别为30.7%~65.3%和30.47%~48.10%,包封率分别为44.2%~61.4%和42.22%~59.24%。Huo等[17]用N-辛基-O-羟丙基壳聚糖制备了载紫杉醇的胶束,辛基的取代度越高胶束的直径越小。Li等[5]用N-脱氧胆酸-N,O-羟乙基壳聚糖制备了载紫杉醇的胶束,随着脱氧胆酸取代度的增加,溶液中的疏水内核增加,有利于紫杉醇的增溶,载药胶束的直径、载药率和包埋率增大。
改性壳聚糖的疏水部分与紫杉醇相互作用,使紫杉醇包覆于胶束的疏水内核中,大大增加了紫杉醇的溶解度,延长了药物释放时间,提高了药物利用率,降低了紫杉醇的细胞毒性,并可赋予胶束一定pH值响应性和靶向性。
2.2 改性壳聚糖衍生物对喜树碱药物的增溶性
喜树碱是抗癌药物,但难溶于水限制了其药效的发挥。10-羟基喜树碱是喜树碱的衍生物,其抗癌活性超过喜树碱。喜树碱和 10-羟基喜树碱结构中的内酯环在生理条件下容易水解成羧酸盐形式,从而降低抗癌活性,并且具有潜在的毒性[9,50]。
壳聚糖衍生物自组装胶束中的疏水性内核不仅可以提高喜树碱的水溶性,还可以有效地抑制喜树碱内酯环的水解。Opanasopit等[46]用PEG改性的N-邻苯二甲酰基壳聚糖制备了载喜树碱的胶束,载药量随投药量的增大而增大,并且能有效防止喜树碱内酯环结构的水解。Zhang等[40]用N-辛基-N-三甲基壳聚糖制备了载 10-羟基喜树碱的胶束,胶束呈球状直径为 24~280 nm。10-羟基喜树碱在胶束溶液中的浓度达1.9 mg/mL,远高于其在水中的溶解度(2 ng/mL),载药率达4.1%~32.5%,表现出良好的缓释作用,并且增强了 10-羟基喜树碱的内酯环的稳定性。Min等[9]用5β-胆甾烷酸改性的羟乙基壳聚糖制备了载喜树碱的胶束,药物包封率达80%,直径为 280~330nm,能有效保护喜树碱中内酯环结构,并且具有一定的靶向性。Ngawhirunpata等[50]用PEG改性的胆酸壳聚糖制备了载喜树碱的胶束,直径为150~390 nm,对喜树碱的内酯环具有很好的保护作用。
2.3 改性壳聚糖衍生物对阿霉素药物的增溶性
阿霉素是一种广谱抗癌药,主要适用白血病的治疗。Xu等[29]用N-丁二酰化-N'-辛基壳聚糖制备了载阿霉素胶束,直径为100~200 nm,细胞毒性低于阿霉素。增加投药量和辛基取代度都能增加载药量和包封率;辛基取代度越高,药物释放速率越小。Liu等[32]用N-烷酰化-O-羧甲基壳聚糖制备了载阿霉素纳米粒,阿霉素含有的氨基能与羧基发生静电作用,羧甲基化度提高有利于包封率的提高。由于长链酰化烷基与阿霉素存在疏水性作用,使得包封率和载药量相比于羧甲基壳聚糖有明显的提高。Zhang等[53]制备了载阿霉素的油酰化壳聚糖纳米粒,粒径为131.8~334.1 nm,并随分子量的增大而增大。在PBS中释放发现,分子量高的纳米粒由于水溶性差,黏度大,使药物释放速率变慢。而分子量较小的纳米粒由于粒径较小,对癌细胞的抑制作用最为明显。Zhou等[6]用N-脱氧胆酸-N-丙二醇壳聚糖制备了载阿霉素的纳米粒,随着脱氧胆酸取代度的增大载药率增大。载药纳米粒在PBS中具有明显的缓释性,由于疏水部分与阿霉素间存在强烈的相互作用,所以脱氧胆酸取代度越大,药物释放速率越小。
抗癌药物的靶向性载体是近年来研究的热点。Sahu等[52]用叶酸改性的羧甲基壳聚糖制备了载阿霉素的纳米粒。纳米粒的直径为180 nm,药物释放量随pH值的增大而减小,并且细胞毒性低,具有靶向性。
2.4 改性壳聚糖衍生物对甲氨基叶酸药物的增溶性
甲氨基叶酸是较好的抗肿瘤药物,用于急性淋巴白血病等,但几乎不溶于水限制了它的应用范围。Yang 等[44]用mPEG改性壳聚糖制备了载甲氨基叶酸的胶束,随着投药量的增大,载药率增大,包封率降低。Seo等[54]用PEG改性壳聚糖制备了载甲氨基叶酸的胶束,胶束直径为50~300 nm,细胞毒性低。PEG的取代度越高,载药率和包封率越低。
2.5 改性壳聚糖衍生物对其它药物的增溶性
改性壳聚糖衍生物除了用于抗癌药物的增溶外,还可作为常规药物的载体,尤其是阴离子药物和蛋白类药物。Liu等[11]制备的亚麻酸改性壳聚糖纳米粒,由于氨基与BSA具有相反电荷且本身具有两亲性,可作为BSA的载体,并且浓度越高BSA的载药率越高。Jiang等[26]制备了载布洛芬的N-十六酰壳聚糖胶束,胶束具有药物缓释性,酰基取代度越高,药物释放速率越慢,并且药物释放具有pH响应性。Peng等[30-31]制备的N-邻苯二甲酰-O-羧甲基壳聚糖可形成载盐酸左氧氟沙星和牛血清蛋白胶束,在PBS中于72 h左右释放达到平衡。Li等[33]以利福平为模型药物制备了油酰基羧甲基壳聚糖纳米粒子,药物释放具有pH值响应性,并且加入三聚磷酸盐有利于降低药物的释放速率。
3 结 语
采用偶联、烷基化、酰基化、羧基化、季铵化等制备具有表面活性的壳聚糖衍生物,在生物医药和日用化工等行业的应用研究日益增多。通过形成胶束载药可以增加难溶药物的溶解度,延长释药时间,提高药物利用率,降低细胞毒性等优点,因此在药物载体方面具有广阔的应用前景。探索壳聚糖基表面活性剂的改性新方法和生产工艺,进一步提高壳聚糖衍生物的生物相容性、降低毒性、提高安全性和可靠性;引入具有特殊功能的基团,使其具有靶向性、非抗原性、抗菌性、血液相容性、pH值和温度响应性等,扩大应用范围;探索具有功能性的智能载药胶束是今后发展的方向。
[1]Amiji M M.Pyrene fluorescence study of chitosan self- association in aqueous solution[J].Carbohydrate Polymers,1995,26:211-213.
[2]陈天,张晓红,郭荣.壳聚糖的表面活性和聚集[J].物理化学学报,2000,16(11):1039-1042.
[3]Payet L,Terentjev E M.Emulsi fi cation and stabilization mechanisms of O/W emulsions in the presence of chitosan[J].Langmuir,2008,24:12247-12252.
[4]Kim K,Kwon S,Park J H,et al.Physicochemical characterizations of self-assembled nanoparticles of glycol chitosan-deoxycholic acid conjugates[J].Biomacromolecules,2005,6:1154-1158.
[5]Li H,Huo M R,Zhou J P,et al.Enhanced oral absorption of paclitaxel inN-deoxycholic acid-N,O-hydroxyethyl chitosan micellar system[J].Journal of Pharmaceutical Sciences,2010,99:4543-4553.
[6]Zhou H F,Yu W T,Guo X,et al.Synthesis and characterization of amphiphilic glycidol-chitosan-deoxycholic acid nanoparticles as a drug carrier for doxorubicin[J].Biomacromolecules,2010,11:3480-3486.
[7]Kwon S,Park J H,Chung H,et al. Physicochemical characteristics of self-assembled nanoparticles based on glycol chitosan bearing 5β-cholanic acid[J].Langmuir,2003,19:10188-10193.
[8]Kim J H,Kim Y S,Kim S,et al.Hydrophobically modified glycol chitosan nanoparticles as carriers for paclitaxel[J].Journal of Controlled Release,2006,111:228-234.
[9]Min K H,Park K,Kim Y S,et al.Hydrophobically modified glycol chitosan nanoparticles-encapsulated camptothecin enhance the drug stability and tumor targeting in cancer therapy[J].Journal of Controlled Release,2008,127:208-218.
[10]Wang Y S,Liu L R,Weng J,et al.Preparation and characterization of self-aggregated nanoparticles of cholesterol-modifiedO-carboxymethyl chitosan conjugates[J].Carbohydrate Polymers,2007,69:597-606.
[11]Liu C G,Desai K G H,Chen X G,et al.Linolenic acid-modified chitosan for formation of self-assembled nanoparticles[J].Journal of Agricultural and Food Chemistry,2005,53:437-441.
[12]Ortona O,D’Errico G,Mangiapia G,et al.The aggregative behavior of hydrophobically modi fi ed chitosans with high substitution degree in aqueous solution[J].Carbohydrate Polymers,2008,74:16-22.
[13]Zhang C,Ping Q,Zhang H J,et al.Preparation ofN-alkyl-O-sulfate chitosan derivatives and micellar solubilization of taxol[J].Carbohydrate Polymers,2003,54:137-141.
[14]Zhang C,Qineng P,Zhang H J.Self-assembly and characterization of paclitaxel-loadedN-octyl-O-sulfate chitosan micellar system[J].Colloids and Surfaces B:Biointerfaces,2004,39:69-75.
[15]Zhang C,Qu G W,Sun Y J,et al.Pharmacokinetics,biodistribution,ef fi cacy and safety ofN-octyl-O-sulfate chitosan micelles loaded with paclitaxel[J].Biomaterials,2008,29:1233-1241.
[16]Zhang C,Qu G W,Sun Y J,et al.Biological evaluation ofN-octyl-O-sulfate chitosan as a new nano-carrier of intravenous drugs[J].European Journal of Pharmaceutical Sciences,2008,33:415-423.
[17]Huo M R,Zhang Y,Zhou J P,et al.Synthesis and characterization of low-toxic amphiphilic chitosan derivatives and their application as micelle carrier for antitumor drug[J].International Journal of Pharmaceutics,2010,394:162-173.
[18]胡印滔.壳聚糖基表面活性剂的制备及其性能研究[D].福建:华侨大学,2011.
[19]Liu J,Li H X,Jiang X Q,et al.Novel pH-sensitive chitosan-derived micelles loaded with paclitaxel[J].Carbohydrate Polymers,2010,82:432-439.
[20]Li H X,Liu J,Ding S,et al.Synthesis of novel pH-sensitive chitosan graft copolymers and micellar solubilization of paclitaxel[J].International Journal of Biological Macromolecules,2009,44:249-256.
[21]Ngimhuang J,Furukawa J,Satoh T,et al.Synthesis of a novel polymeric surfactant by reductiveN-alkylation of chitosan with 3-O-dodecyl-D-glucose[J].Polymer,2004,45:837-841.
[22]范金石.甲壳低聚糖类表面活性剂的制备及其性能研究[D].山东:青岛海洋大学,2002.
[23]范金石,张启凤,徐桂云,等.分子量对非离子型壳聚糖表面活性剂表面活性的影响[J].高分子材料科学与工程,2004,20(1):117-120.
[24]Sui W P,Song G L,Chen G H,et al.Aggregate formation and surface activity property of an amphiphilic derivative of chitosan[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2005,256:29-33.
[25]Sui W P,Wang Y H,Dong S L,et al.Preparation and properties of an amphiphilic derivative of succinyl-chitosan[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2008,316:171-175.
[26]Jiang G B,Quan D P,Liao K R,et al. Novel polymer micelles prepared from chitosan grafted hydrophobic palmitoyl groups for drug delivery[J].Molecular Pharmaceutics,2006,3:152-160.
[27]Jiang G B,Quan D P,Liao K R,et al.Preparation of polymeric micelles based on chitosan bearing a small amount of highly hydrophobic groups[J].Carbohydrate Polymers,2006,66:514-520.
[28]Zhu A P,Chen T,Yuan L H,et al.Synthesis and characterization ofN-succinyl-chitosan and its self-assembly of nanospheres[J].Carbohydrate Polymers,2006,66:274-279.
[29]Xu X Y,Li L,Zhou J P,et al.Preparation and characterization ofN-succinyl-N-octyl chitosan micelles as doxorubicin carriers for effective antitumor activity[J].Colloids and Surfaces B:Biointerfaces,2007,55:222-228.
[30]Peng X H,Zhang L N.Formation and morphologies of novel self-assembled micelles from chitosan derivatives[J].Langmuir,2007,23,10493-10498.
[31]Peng X H,Zhang L N.Self-assembled micelles ofN-phthaloylcarboxymethychitosan for drug delivery[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2009,337:21-25.
[32]Liu K H,Chen B R,Chen S Y,et al.Self-assembly behavior and doxorubicin-loading capacity of acylated carboxymethyl chitosans[J].Journal of Chemical Physics B,2009,113:11800-11807.
[33]Li Y Y,Zhang S S,Meng X J,et al.The preparation and characterization of a novel amphiphilicoleoyl-carboxymethyl chitosan self-assembled nanoparticles[J].Carbohydrate Polymers,2011,83:130-136.
[34]Zhu A P,Chan-Park M B,Dai S,et al.The aggregation behavior ofO-carboxymethylchitosan in dilute aqueous solution[J].Colloids and Surfaces B:Biointerfaces,2005,43:143-149.
[35]隋卫平,陈国华,高先池,等.一种新型疏水改性的两亲性壳聚糖衍生物的表面活性研究[J].高等学校化学学报,2001,22(1):133-135.
[36]隋卫平,蒋晓杰,翟利民,等.两亲性羧甲基壳聚糖衍生物的表面活性研究[J].高等学校化学学报,2004,25(1):99-102.
[37]Zhang Y,Huo M R,Zhou J P,et al.Potential of amphiphilically modi fi ed low molecular weight chitosan as a novel carrier for hydrophobic anticancer drug:Synthesis,characterization,micellization and cytotoxicity evaluation[J].Carbohydrate Polymers,2009,77:231-238.
[38]Uchegbu I F,Sadiq L,Arastoo M,et al.Quaternary ammonium palmitoyl glycol chitosan-a new polysoap for drug delivery[J].International Journal of Pharmaceutics,2001,224:185-199.
[39]孙晓丽.新型N-甲基-N,N-双长链烷基壳聚糖季铵盐的表面性能和抗菌性研究[D].泉州:华侨大学,2005.
[40]Zhang C,Ding Y,Yu L L,et al.Polymeric micelle systems of hydroxycamptothecin based on amphiphilicN-alkyl-N-trimethyl chitosan derivatives[J].Colloids and Surfaces B:Biointerfaces,2007,55:192-199.
[41]褚春莹.季铵化壳低聚糖的合成及性能研究[D].青岛:中国海洋大学,2003.
[42]褚春莹,陈国华,范金石,等.季铵盐型阳离子甲壳低聚糖表面活性剂的相图和微乳液结构[J].高分子材料科学与工程,2003,19:154-156.
[43]周景润,辛梅华,李明春,等.O-季铵盐-N,N-双长链烷基壳聚糖的制备及其性能[J].化工进展,2008,27(10):1654-1658.
[44]Yang X D,Zhang Q Q,Wang Y S,et al.Self-aggregated nanoparticles from methoxy poly(ethylene glycol)-modi fi ed chitosan:Synthesis,characterization,aggregation and methotrexate release in vitro[J].Colloids and Surfaces B:Biointerfaces,2008,61:125-131.
[45]Sagnella S,Mai-Ngam K.Chitosan based surfactant polymers designed to improve blood compatibility on biomaterials[J].Colloids and Surfaces B:Biointerfaces,2005,42:147-155.
[46]Opanasopit P,Ngawhirunpat T,Chaidedgumjorn A,et al.Incorporation of camptothecin intoN-phthaloyl chitosan-g-mPEG self-assembly micellar system[J].European Journal of Pharmaceutics and Biopharmaceutics,2006,64:269-276.
[47]Yao Z,Zhang C,Ping Q N,et al.A series of novel chitosan derivatives:Synthesis,characterization and micellar solubilization of paclitaxel[J].Carbohydrate Polymers,2007,68:781-792.
[48]Qu G W,Yao Z,Zhang C,et al.PEG conjugatedN-octyl-O-sulfate chitosan micelles for delivery of paclitaxel:In vitro characterization and in vivo evaluation[J].European Journal of Pharmaceutical Sciences,2009,37:98-105.
[49]Cai G Q,Jiang H L.pH-sensitive nanoparticles self-assembled from a novel class of biodegradable amphiphilic copolymers based on chitosan[J].Journal of Materials Science:Materials in Medicine,2009,20:1315-1320.
[50]Ngawhirunpat T,Wonglertniranta N,Opanasopit P,et al. Incorporation methods for cholic acid chitosan-g-mPEG self-assembly micellar system containing camptothecin[J].Colloids and Surfaces B:Biointerfaces,2009,74(1):253-259.
[51]Lin W J,Chen M H.Synthesis of multifunctional chitosan with galactose as a targeting ligand for glycoprotein receptor[J].Carbohydrate Polymers,2007,67:474-480.
[52]Sahu S K,Mallick S K,Santra S,et al.In vitro evaluation of folic acid modi fi ed carboxymethyl chitosan nanoparticles loaded with doxorubicin for targeted delivery[J].Journal of Material Science,2010,21:1587-1597.
[53]Zhang J,Chen X G,Sun G Z,et al.Effect of molecular weight on the oleoyl-chitosan nanoparticles as carriers for doxorubicin[J].Colloids and Surfaces B:Biointerfaces,2010,77:125-130.
[54]Seo D H,Jeong Y,Kim D G,et al.Methotrexate-incorporated polymeric nanoparticles of methoxy poly(ethylene glycol)-grafted chitosan[J].Colloids and Surfaces B:Biointerfaces,2009,69:157-163.
Research progress of chitosan derivatives’ surface activity and drug solubility
HU Yintao,XIN Meihua,LI Mingchun
(College of Materials Science and Engineering,Huaqiao University,Engineering Research Center of Environment-Friendly Functional Materials,Ministry of Education,Xiamen 361021,Fujian,China)
The application of chitosan-based surfactants in biomedicine and daily chemicals are progressively increasing for their feature of non-toxic and biodegradable. The micelles formed by amphiphilic modified chitosan can solubilize water-insoluble drugs, slow the drug release, reduce the cytotoxicity and improve the bioavailability of drugs. This paper reviews the researches on the surface activity of chitosan derivatives and their application in drug solubilization and drug carrier. The recent studies on coupling, alkylation, acylation, carboxymethyl-based, quaternary ammonium derivatives of chitosan, and on the drug solubilization of paclitaxel, camptothecin, doxorubicin and methyl-amino folic acid by chitosan-based surfactants are introduced in detail. In the new method of modified chitosan, two ways are worth to notice. The first is to use hydrophobic interactions to constitute the self-assembly system, the second is to introduce the functional groups to form the intelligent drug-loaded micelles.
modified chitosan;surface activity;self-assembly;drug solubilization
O 636.1
A
1000–6613(2011)10–2228–07
2011-05-23;修改稿日期2011-06-05。
福建省重点科技项目(2009H0030)、福建省自然科学基金(2009J01029和2011J01312)及科技部科技人员服务企业项目。
胡印滔(1984-),男,硕士研究生。联系人:李明春,教授,博士生导师,从事功能高分子材料研究。E-mail mcli@hqu.edu.cn。

