双模态分子影像探针研究进展
黄佳国, 曾文彬, 周 明, 高 峰
1.中南大学药学院,长沙 410013;
2.中南大学湘雅三医院,长沙 410013
双模态分子影像探针研究进展
黄佳国1, 曾文彬1, 周 明1, 高 峰2
1.中南大学药学院,长沙 410013;
2.中南大学湘雅三医院,长沙 410013
分子影像技术可以在分子水平上实现生物有机体生理和病理变化的在体、实时、动态、无创的三维成像,融合不同影像的双、多模态技术,可实现不同影像设备的优势互补,同时亦可减少假阳性和假阴性,从而使获取的结果更为精确可靠。双、多模态融合已成为生物医学成像的发展趋势,并逐渐在疾病的治疗、诊断及监测等方面发挥重要作用。本文综述了双模态分子探针的优势和面临的挑战,总结了当前双模态分子探针独特的设计策略及其相关应用研究,并对目前的热点和前景进行了总结和展望。
分子影像;分子探针;双模态;多模态
引 言
分子影像学 (molecular imaging)是运用影像学手段,在组织水平、细胞水平或分子水平对特定的分子进行活体显像,来反映特定分子的生物学行为,并对其进行定性、定量研究的一门新兴的边缘学科[1,2]。该学科由Ralph Weissleder教授于1999年首次提出[3],融合了化学、分子生物学、物理学、放射医学、核医学等多个学科及其技术,主要成像方法包括磁共振成像 (magnetic resonance imaging,MRI)、核医学成像和光学成像,其中,核医学成像技术主要有γ照相、单光子发射型计算机断层 (single photon emission computed tomography,SPECT)及正电子发射型计算机断层 (positron emission tomography,PET)。分子影像学对影像医学的发展有很大的推动作用,使传统的解剖、生理功能的研究,深入到细胞和分子水平的成像,并能探索疾病分子水平上的变化,对药物的研发、新的医疗模态的形成和人类健康有着深远的影响。
实现特定靶点的活体成像,除了要有高分辨率、高敏感度、快速的成像技术,还需要特定的分子探针。分子探针是成像成功的关键,它的合成和检测是分子影像学研究中最热门、最前沿的问题之一。实际上,正是由于探针的深入研发,才使得分子影像从一项技术成为一门新学科。然而,在目前所有的分子影像技术中,并没有一种完美的影像技术能够提供关于检测对象的所有信息,任何一种影像技术都存在自身的优缺点;传统的分子探针中,也没有一种能够提供关于组织的所有结构、功能和分子的信息。为了克服这些缺陷,人们开始研究双模态或者多模态分子探针,综合两种或多种模态探针的优点,使分子探针在诊断、治疗和监测等方面可获得一些全新的信息[4]。目前,将各类不同模态的分子探针进行有效结合,初步形成了包括PET-光学、SPECT-光学、PET-MRI等在内的多种新型双模态探针。这些“一体化”的双模态分子影像探针必将成为未来进行体内成像的重要工具[5]。本文具体介绍了双模态分子探针的优势及面临的新挑战,并总结了当前双模态探针所采用的设计策略、不同类型及其相关应用研究。
PET-光学成像双模态分子影像探针
PET的临床应用是核医学发展的一个重要里程碑。它可以定量探测正电子核素的空间分布和实时变化,不仅无创伤地打开了人们探讨大脑奥秘的窗口,而且在心、肺疾病和肿瘤等的诊断中,均获得了广泛的临床应用。PET的优势在于它使用的核素 (11C、15O、13N、18F等)本身为人体组织的组成元素,故可应用这些核素标记人体或肿瘤代谢所必需的化合物。PET具有高分辨率的优点,但主要的缺陷在于较低的空间分辨率,常常很难得到清楚的信号,从而限制了组织信息的获得[6]。此外,高昂的价格也增加了推广应用的难度。光学显像因具有显像剂无辐射、标记后化合物稳定性好,以及适合在同一活体内一次注射后反复显像等优点,近年来得到迅猛发展,并广泛应用于不同领域。特别是随着光学信号探测仪器的发展,以及新型的组织穿透力更强的荧光物质 (如生物荧光[7])的研制成功,已成为分子显像的一个重要分支[8~10]。然而具有这种特性的双模态探针为数不多,目前很大程度上还集中在体外和小动物成像[11]。如我们先后报道的基于此原理设计并合成的PET-光学双模态探针DNSBA和BNSBA,可在体外特异性识别肿瘤细胞凋亡[12,13]。
基于64Cu-量子点的PET-光学成像双模态分子影像探针
纳米技术的发展为纳米材料型影像探针的设计提供了新方法,该类新型探针具有较大的表面积,有利于对成像功能基团进行修饰,以及稳定性的提升和靶向性的增强[14,15]。研究表明,基于此技术的量子点 (quantum dots,QDs)分子探针已用于细胞标记、荧光杂交、核酸检测和其他研究[16,17]。非特异性QDs已用于体内胚胎形成的成像,以及管脉系统、淋巴结和其他疾病的诊断[18,19]。例如,有报道称,以QDs为荧光发射基团的双模态探针可用于整联蛋白αvβ3的成像。整联蛋白αvβ3在肿瘤管脉系统和肿瘤细胞中是过量表达的,但在休眠的内皮细胞和大多数正常器官系统中不易被检测[20],因而可作为体内成像的优良靶点。如图1所示,该研究合成了一种新颖的肿瘤靶向PET-近红外双模态探针,体内靶向通过精氨酸-甘氨酸-天冬氨酸链 (Arg-Gly-Asp,RGD)与整联蛋白αvβ3结合来完成,DOTA与QD表面结合后再与核素64Cu进行螯合,从而实现了PET成像与QD近红外荧光成像的结合。通过对机体器官和肿瘤的QDs结合物吸收水平的定量研究,从而准确评价探针对肿瘤的靶向特异性。另外,该探针PET的溶度比体内光学成像使用的溶度要低得多,在很大程度上可减少QDs在体内潜在的毒性[21]。
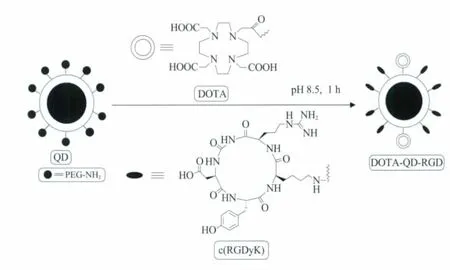
图1 DOTA-QD-RGD PET-光学成像双模态分子影像探针[21]Fig.1 DOTA-QD-RGD PET-optical dual-modality probes[21]
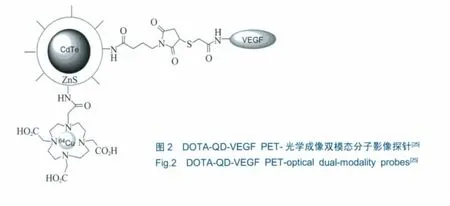
相近报道则多基于肿瘤成像和癌症治疗的新靶点、可作为多数血管原调节器的内皮管脉系统生长因子 (vascular endothelial growth factor,VEGF)及其受体 (VEGF receptors,VEGFRs)[22~24]。Chen[25]将QD功能性氨基酸与VEGF蛋白结合后,再与大环DOTA螯合来识别VEGFR,并利用64Cu标记实现了PET成像,该探针的结构如图2所示。
基于86Y-近红外的PET-光学成像双模态分子影像探针
正电子11C和18F因具有良好的生物特性和低原子量而受到广泛的青睐,但由于半衰期短,相关分子探针需要在短时间内完成合成、纯化、聚集及显像。而86Y、64Cu、68Ga和124I等正电子拥有较长的半衰期和优良的螯合特性,在设计分子探针时也存在一定的优势[5]。图3所示的赖氨酸衍生物双模态分子探针,由近红外染料Cy5.5通过脂肪链连接到配体CHX-A上,后者可与核素111In螯合。由于近红外荧光成像分辨率达1~2 mm,能穿透8 cm的组织,该探针能够与肿瘤特异性单克隆抗体(曲妥单抗)相结合,实现肿瘤的特异性光学和PET成像。在体外实验中还发现,Cy5.5-Lys(SMCC)-CHX-A和曲妥单抗能竞争性地作用于SKOV3癌细胞。此外,该探针也可与86Y螯合而用于PET显像[26]。
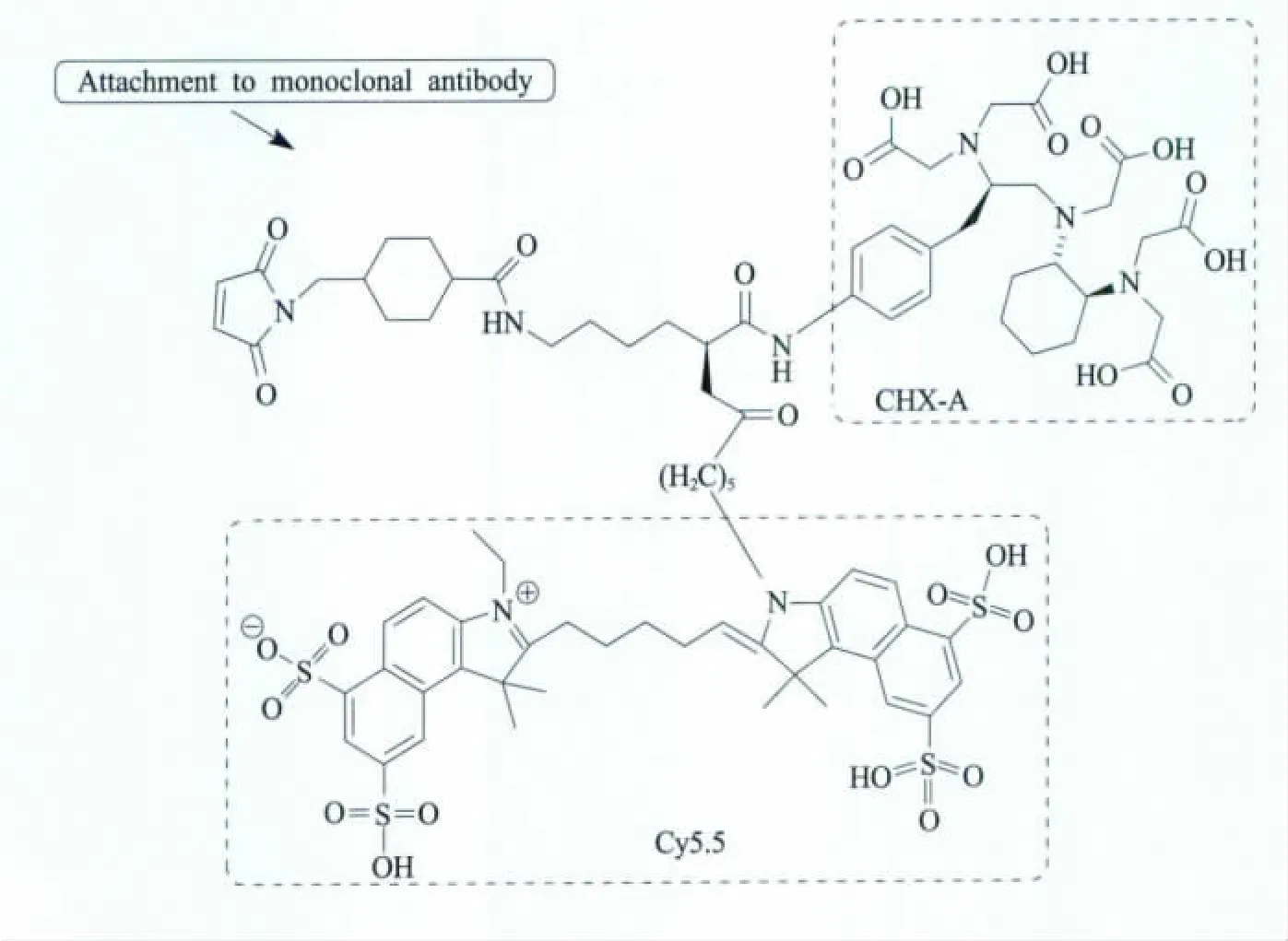
图3 Cy5.5-Lys(SMCC)-CHX-A PET-光学成像双模态分子影像探针[26]Fig.3 Cy5.5-Lys(SMCC)-CHX-A PET-optical dual-modality probes[26]
SPECT-光学成像双模态分子影像探针
SPECT既继承了γ照相机的功能和特性,又应用了计算机断层的原理,较γ相机增加了断层显像的能力,是核素显像技术继扫描机和γ照相机之后又一重大进步。其突出优点是,可反映人体功能和代谢方面的变化,这与X射线CT、MRI等影像技术有所不同。SPECT结合光学成像已成为分子显像的一个重要分支[27,28]。基于111In-红外的SPECT-光学成像双模态分子影像探针
Sampath等设计并合成了一类双模态探针(111In-DTPA)n-trastuzumab-(IRDye800)m,研究证明,其能够在体外及体内对人体表皮生长因子受体HER2过量表达的肿瘤特异性成像[29]。人体表皮生长因子受体 (the human epidermal growth factor receptor,HER)是表皮生长因子家族细胞外蛋白配体的一员,由跨膜受体酪氨酸激酶组成,通过复杂的细胞内信号网来控制正常和病变细胞的增长、恶化及生命活动[30]。在许多HER家族中,HER2的过量表达是一个提示恶性肿瘤形成和乳腺癌恶化的重要病情诊断信号。Trastuzumab是一种通过干扰HER2信号而被广泛应用的人体抗HER2抗体,现已批准用于治疗乳腺癌[31~33]。实验表明,(111In-DTPA)n-trastuzumab-(IRDye800)m作用于乳腺癌细胞系SKBr3并显示出HER2处于细胞的外缘。体内静脉注射该双模态探针,近红外荧光显像和SPECT显像均能成功识别荷瘤老鼠中的HER2[29]。此外,相似的方法也已用于设计用来跟踪白细胞间介素受体上IL-11Ra链的分子探针[34]。
基于99mTc-红外的SPECT-光学成像双模态分子影像探针
Bhushan等设计了一种建立在二膦酸盐 (bisphosphonates,BP)基础上的双模态探针,用于乳腺癌微钙化的SPECT-CT-光学成像。具有BP基团的小分子能与羟磷灰石(hydroxyapatite,HA)矿骨物的表面相连[35],BP与放射性示踪剂已用于造骨细胞损伤的成像,亦可研究乳腺癌与骨转移瘤之间的关系[36]。该Pam-Tc/Re-800探针结构如图4所示,BP作为靶向配体,核素99mTc和IRDye800分别作为SPECT和光学成像基团。Pam-Tc/Re-800显示,它在体内与HA特异性的结合比其他钙盐多8倍量,利用SPECT-CT和近红外均可对HA进行高灵敏度检测。此外,Pam-Tc/Re-800在骨骼和微钙化肿瘤中,比在其他器官或组织中具有更高的吸收,亦可作为骨探测型双模态探针[37]。
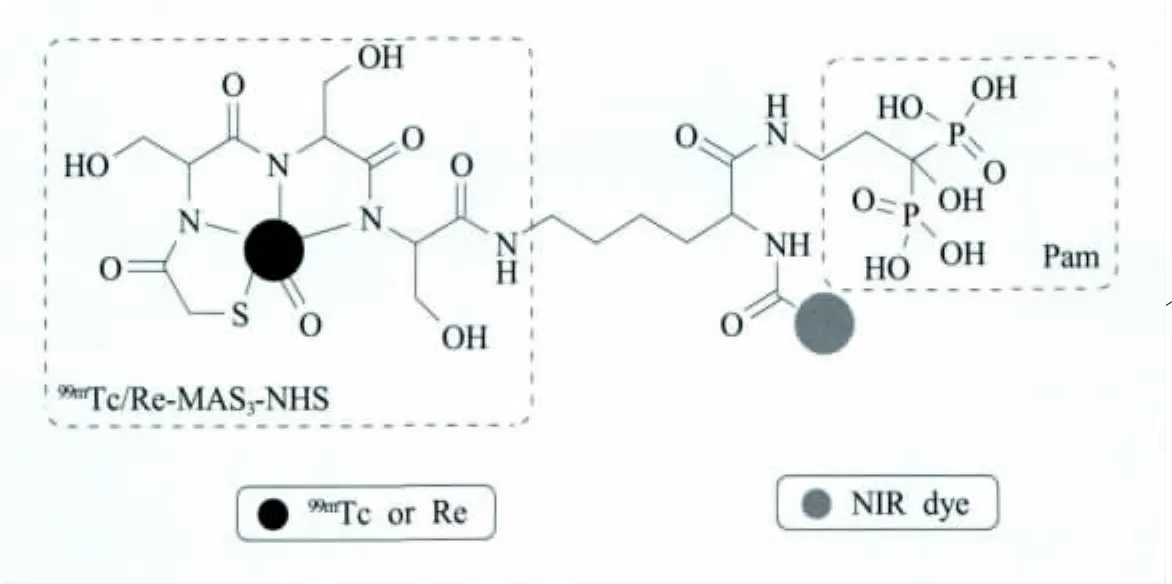
图4 Pam-Tc/Re-800 SPECT-光学成像双模态分子影像探针[37]Fig.4 Pam-Tc/Re-800 SPECT-optical dual-modality probes[37]
基于99mTc-荧光的SPECT-光学成像双模态分子影像探针
SPECT成像常用的核素包括99mTc、111In、123I和67Ga。99mTc具有6 h的半衰期,为药物制备和体内肿瘤组织的吸收积累提供了充足的时间,并且廉价易得 (与PET核素相比),但Tc氧化状态的易改变以及复杂的化学放射性标记等,影响了其广泛应用[38,39]。而基于锝以及铼的核素-荧光双模态探针的研发,可以使生物医学最常用的显像技术 (荧光和放射成像)进行结合并达到优势互补。Stephenson等[40]报道了一种Tc和Re与赖氨酸衍生物为配体的结合物 (图5):核素99mTc与荧光基团螯合生成[99mTc(CO)3],该荧光探针能与fMLF生物结合后作用于特定的受体,与多肽偶联后能进一步得到体内和体外直接相关的成像信息。此外,最近有报道称,这类结构相似的荧光-核素探针可用于神经干细胞和干细胞的转移研究[41]。
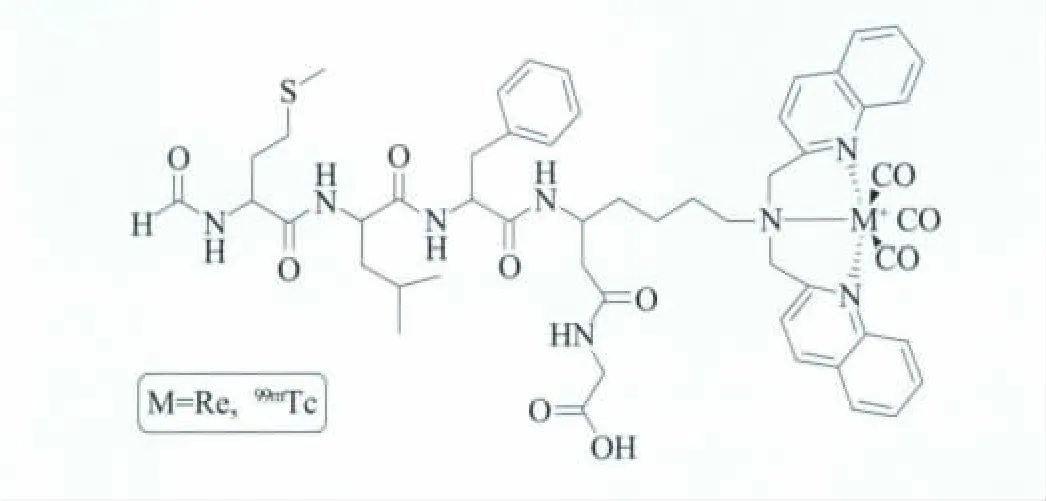
图5 fMLF-[(SAACQ-Re(CO)3+)]G SPECT-光学成像双模态分子影像探针[40]Fig.5 fMLF-[(SAACQ-Re(CO)3+)]G SPECT-optical dual-modality probes[40]
PET-MRI成像双模态分子探针
MRI是利用磁共振成像的无创伤性研究生物细胞内分子过程的一门技术,能在亚毫米水平上提供高分辨率的组织信息的一系列生物参数,并能提供三维结构成像和高分辨率信息[42],但靶向特异性差、灵敏度低,进而在很大程度上又限制了临床应用,在对活体进行显像时须依靠其他的显像技术来加以辅助。PET和MRI两种影像技术存在协同作用的最大互补。因此,将这两种显像技术融合在一起、达到优势互补的PET-MRI双模态探针具有极大的应用前景。近年来,PET-MRI影像逐渐成为分子影像学的热点研究领域,基于此的双模态探针相继开发[43,44],有些已逐步应用到临床诊断[4]。基于124I-纳米材料的PET-MRI成像双模态分子影像探针
利用124I-血红蛋白-MnMEIO双模态探针标记淋巴瘤成像的动物实验已经成功[45]。淋巴系统是生物机体用于抵抗外来侵扰的屏障,也是肿瘤转移的重要途径[46],因此,淋巴瘤的准确成像对诊断和治疗癌症至关重要。如图6所示的PET-MRI双模态探针124I-SA-MnMEIO,是通过将放射性碘素结合到血红蛋白的酪氨酸上,然后在外层表面覆盖一层MnMEIO磁性纳米微粒而得到的。MnMEIO是由镁和氧化铁纳米微粒组成的,其磁性相当于超顺磁性氧化铁 (SPIO)纳米微粒的2至3倍。124I-SA-MnMEIO保持着各单模态探针同等的功能,磁性纳米微粒和核素碘离子之间没有任何干扰作用,当124I-SA-MnMEIO纳米微粒被老鼠的前爪吸收时,体内的上臂淋巴瘤能够被清晰地成像,但124I-SA-MnMEIO纳米微粒在体内的应用研究尚需时日[45]。
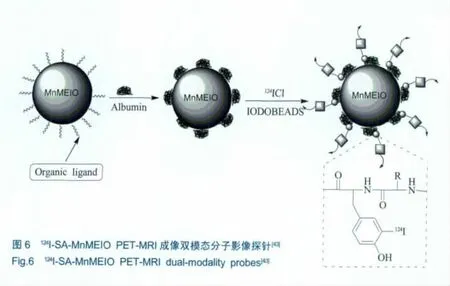
基于64Cu-纳米材料的PET-MRI成像双模态分子影像探针
近来有报道称,开发了一种新型PET-MRI双模态纳米探针用于整联蛋白αvβ3过量表达的肿瘤成像。由于整联蛋白αvβ3与细胞外基质分子 (如玻连蛋白)相连[47],该玻连蛋白含有精氨酸-甘氨酸-天冬氨酸链 (RGD),RGD多肽能紧密地与整联蛋白αvβ3结合,因此,大多数探针都是通过RGD靶向整联蛋白αvβ3的[48]。如图7中,以RGD为靶点的PET-MRI探针的表面是一种DOTA螯合物与天冬氨酸结合的化合物,外层是氧化铁纳米微粒(PASP-IO),它能与环状的RGD多肽进行化学结合来识别整联蛋白αvβ3。氧化铁纳米微粒(PASP-IO)具有容易与64Cu螯合和RGD多肽靶向结合的特性,DOTA-IO-RGD轭合物被发现能够特异性地与U87MG细胞的整联蛋白αvβ3结合[49]。
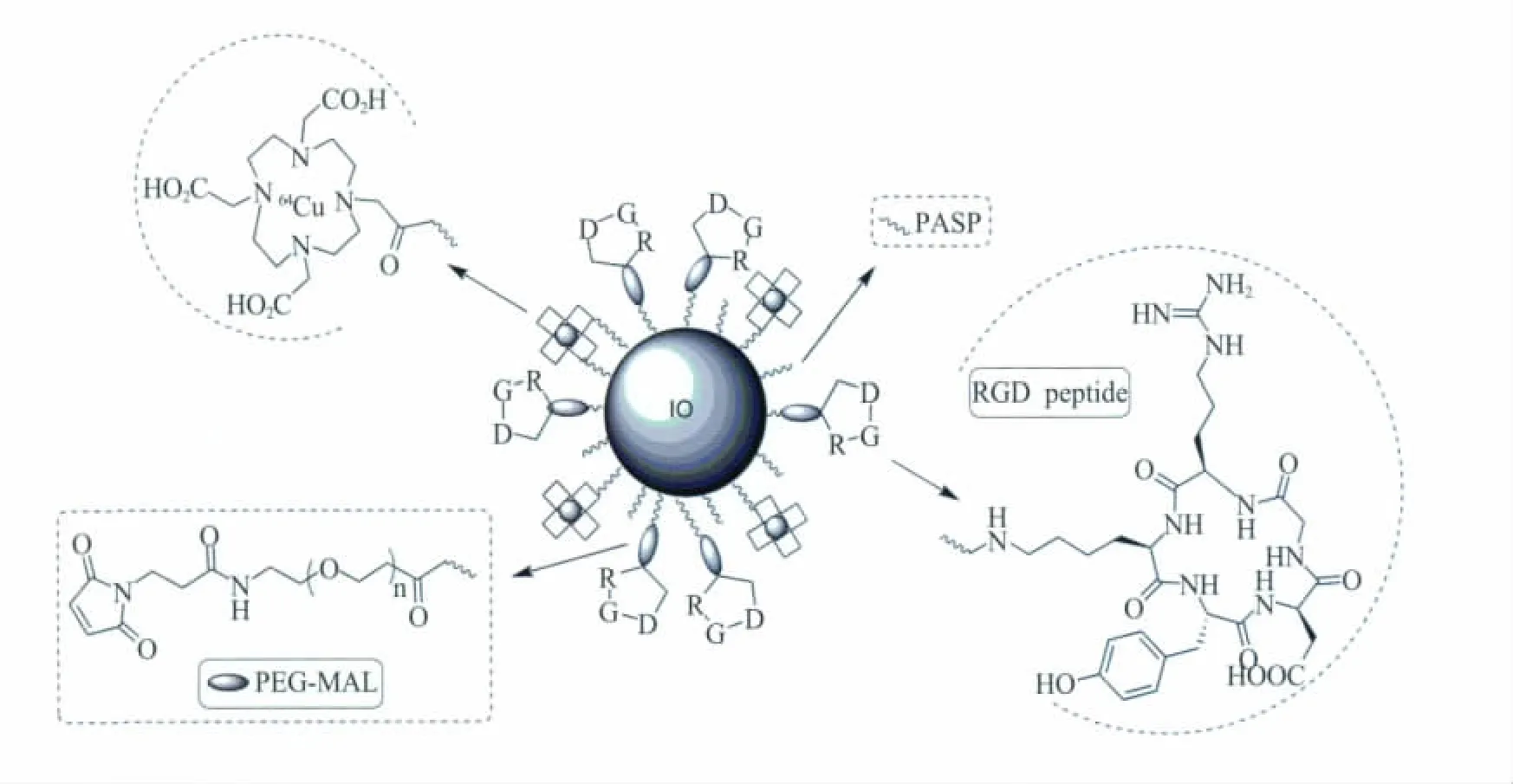
图7 64Cu-DOTA-IO-RGD PET-MRI成像双模态分子影像探针[47]Fig.7 64Cu-DOTA-IO-RGD PET-MRI dual-modality probes[47]
基于111In-超顺磁纳米的PET-MRI成像多模态分子影像探针
细胞的分化在胚胎形成的过程中是至关重要的,特别是在免疫和造血系统、血管形成过程的血管重构及大多数免疫和传染性疾病中[50~52]。传统的细胞标记方法是在流式细胞仪上对离体组织的细胞进行荧光标记[53,54]。对细胞进行标记是对干细胞进行MRI显像的前提,而Tat蛋白源多肽链已作为一种有效的配体用于标记细胞内蛋白[55,56]。Weissleder等[57]曾经报道一种超顺磁性纳米粒-CLIO-Tat多模态分子探针 (磁性、荧光、核素),并首次发现该探针可以标记造血细胞CD34+和神经前体细胞C17.2,并且通过MRI高分辨率显像进一步证明这些被标记的细胞仍然保持着分化能力。该探针结构如图8所示,纳米微粒由5 nm的高顺磁场氧化铁单晶核与外层胺化的葡聚糖交联形成,整个纳米微粒大小为45 nm,多个氨基酸与它进行交联,其中包括半胱氨酸的生物轭合和赖氨酸的荧光结合。葡聚糖外衣与DTPA(diethylenetriamine pentaacetic acid)反应后,用核素111In标记进行核素成像,最后产生了集荧光、顺磁性和放射性核素成像于一体的多模态探针。
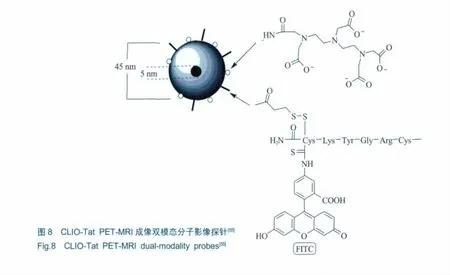
MRI-光学成像双模态分子影像探针
基于MRI和光学成像的分子影像探针是双模态影像中发展相对成熟的领域,被更为广泛地运用到生物医药研发和临床应用中。如钆螯合剂、氧化铁纳米粒子与光学基团的联合使用。
展 望
随着分子影像学的发展及与其他技术间跨学科的交叉研究,新型多模态分子影像探针应运而生。虽然新型探针不断涌现,生物活性相继得到证实或达到预期效果及目的,但多模态影像探针的应用仍然处于初期阶段,许多工作,包括技术上的准确性、重现性和标准化方法的建立等,还有待于提高和深入。
未来双模态分子影像探针的发展,一个重要的方向是“治疗诊断学”的发展,即分子探针在对病灶或目标部位进行显像的同时,还能作为药物对疾病进行治疗。因为一般探针分子在体内的分布位点与治疗药物在体内的分布位点要求是一致的,如果能够成功地将探针分子的显像部位与治疗药物相结合,形成一个全新的治疗诊断探针,将具有巨大的临床应用前景。此外,合成新型可控的分子探针也将是另一个研究热点。
总之,优良的多模态影像探针的研究有赖于合成化学家、分子生物学家和影像学家之间跨学科的共同努力,同时也必将给未来生物、临床医学的研究和新药研发带来更多更大的影响。
1. Weissleder R.Molecular imaging in cancer.Science,2006,312:1168~1171
2.Herschman HR.Molecular imaging:Looking at problems seeing solutions.Science,2003,302:605~608
3. WeisslederR. Moleculare imaging: Exploring the next frontier.Radiology,1999,212:609~614
4. Lee S,Chen X.Molecular dual-modality probes forin vivo molecular imaging.Mol Imaging,2009,8(2):87~100
5.Jennings L,Long N.'Two is better than one'——Probes for dual-modality molecular imaging.Chem Commun,2009,24:3511~3524
6. Catana C,Wu Y,Judenhofer M,Qi J,Pichler B,Cherry S.Acquisition of multislicePET and MR images:Initial results with a MR-compatible PET scanner.J Nucl Med,2006,47(12):1968~1976
7.王建东,张帆,黄惠莲,藏风超,赵艳娥,张禄卿,李朝军,田捷,腾皋军,何玉龙,周晓军,卢光明.荧光素酶活体发光技术在肺癌分子影像学研究中的初步应用.临床放射学杂志,2008,27(2):270~272 Wang JD,Zhang F,Huang HL,Zang FC,Zhao YE,Zhang LQ,Li CJ,Tian J,Teng GJ,He YL,Zhou XJ,Lu GM. Preliminary experiment with lung cancer cell expressing luciferase reporter forin vivomolecular imaging.J Clin Radiol,2008,27(2):270~272
8. Vu N, Silverman R, Chatzioannou A. Preliminary performance of optical PET detectors for the detection of visible light photons. Nucl Instrum Methods PhysRes,(Sect A),2006,569:563~566
9. Lin Y,Weissleder R,Tunguarded CH.Novel near-infrared cyanine fluorochromes: Synthesis, properties, and bioconjugation.Bioconjugate Chem,2002,13:605~610
10.Olson ES,Jiang T,Aguilera TA,Nguyen QT,Ellies LG,Scadeng M,Tsien RY.Activatable cell penetrating peptides linked to nanoparticles as dual probes for in vivo fluorescence and MR imaging of proteases. Proc Natl Acad Sci USA,2010,107(9):4311~4316
11.Li C,Wang W,Wu Q,Ke S,Houston J,Sevick-Muraca E,Dong L,Chow D,Charnsangavej C,Gelovani J.Dual optical and nuclear imaging in human melanoma xenografts using a single targeted imaging probe. Nucl Med Biol,2006,33:349~358
12.Zeng W,Miao W,LePuil M,Shi G,Biggerstaff J,Kabalka G,Townsend D.Design,synthesis,and biological evaluation of 4- (5-dimethylamino-naphthalene-1-sulfonamido)-3-(4-iodophenyl)butanoic acid as a novel molecular probe for apoptosis imaging.Biochem Biophys Res Comm,2010,398:571~575
13.Zeng W,Miao W,Kabalka G,Le Puil M,Biggerstaff J,Townsend D.Design,synthesis,and biological evaluation of a dansyled amino acid derivative as an imaging agent for apoptosis.Tetrahedron Lett,2008,49:6429~6432
14. CaiW, Chen X. Smallnanoplatforms fortargeted molecularimaging in living subjects. Small, 2007, 3:1840~1854
15.Cheon J,Lee JH.Synergistically integrated nanoparticles asmultimodal probesfor nanobiotechnology. AceChem Res,2008,41:1630~1640
16.Michalet X,Pinaud F,Bentolila L,Tsay J,Doose S,Li J,Sundaresan G,Wu A,Gambhir S,Weiss S.Quantum dots for live cells, in vivo imaging and diagnostics.Science,2005,307:538~544
17.Li ZB,Cai W,Chen X.Semiconductor quantum dots forin vivoimaging.J Nanosci Nanotechnol,2007,7:2567~2581
18.Cai W,Chen K,Li ZB,Gambhir SS,Chen X.How molecularimaging is speeding up anti-angiogenic drug development.Mol Cancer Ther,2006,5:2624~2633
19.Cai W,Hsu AR,Li ZB,Chen X.Are quantum dots ready forin vivo imaging in human subjects? Nanoscale Res Lett,2007,2:265~281
20.Cai W,Chen X.Anti-angiogenic cancer therapy based on integrin alpha beta antagonism. Anticancer Agents Med Chem,2006,6:407~428
21.Schipper M,Cheng Z,Lee S,Bentolila L,Iyer G,Rao J,Chen X,Wu A,Weiss S,Gambhir S.Micro-PET based biodistribution of quantum dots in living mice.J Nucl Med,2007,48:1511~1518
22.Cai W,Chen K,Mohamedali K,Cao Q,Gambhir S,Rosenblum M,Chen X.PET of vascular endothelial growth factor receptor expression. J NuclMed, 2006, 47:2048~2056
23. CaiW, Chen X. Multimodality imaging ofvascular endothelial growth factor and vascular endothelial growth factor receptor expression. Front Biosci, 2007, 12:4267~4279
24.Wang H,Cai W,Chen K,Li ZB,Kashefi A,He L,Chen X. A new PET tracerspecific forvascularendothelial growth factor receptor 2.Eur J Nucl Med Mol Imaging,2007,34:2001~2010
25.Chen K,Li ZB,Wang H,Cai W,Chen X.Dual-modality opticaland positron emission tomography imaging of vascular endothelial growth factor receptor on tumor vasculature using quantum dots. Eur JNucl Med Mol Imaging,2008,35:2235~2244
26.Xu H,Baidoo K,Gunn A,Boswell C,Milenic D,Choyke P,Brechbiel M.Design,synthesis,and characterization of a dual modality positron emission tomography and fluorescence imaging agent for monoclonal antibody tumor-targeted imaging. J Med Chem, 2007, 50:4759~4765
27.Tokunaga E,Oki E,Nishida K,Koga T,Egashira A,Morita M,Kakeji Y,Maehara Y.Trastuzumab and breast cancer:Developments and current status. Int J Clin Oncol,2006,11:199~208
28. Ntziachristos V, WeisslederR. Charge-coupled-device based scanner for tomography of fluorescent near-infrared probes in turbid media.Med Physics,2002,29(5):803~809
29.Slamon DJ,GodolphinW,JonesLA.Studiesof the HER-2/neu proto-oncogenein human breast and ovarian cancer.Science,1989,244:707~712
30.Carter P,Presta L,Gorman CM,Ridgway JB,Henner D,Wong WL,Rowland AM,Kotts C,Carver ME,Shepard HM. Humanization ofan anti-p185HER2 antibody for human cancer therapy.Proc Natl Acad Sci USA,1992,89(10):4285~4289
31.Yeon CH,Pegram MD.Anti-erbB-2 antibody trastuzumab in the treatment of HER2-amplified breast cancer.Invest New Drug,2005,23:391~409
32.Tokunaga E,Oki E,Nishida K.Trastuzumab and breast cancer:Developments and current status.Int J Clin Oncol,2006,11:199~208
33.Sampath L,Kwon S,Ke S,Wang W,Schiff R,Mawad ME,Sevick-MuracaEM.Dual-labeled trastuzumab-based imaging agent for the detection of human epidermal growth factor receptor-2(HER2)overexpression in breast cancer.E J Nucl Med,2007,48:1501~1510
34.Zurita AJ,Troncoso P,Cardo-Vila M,LogothetisCJ,Pasqualini R,Arap W.Combinatorial screenings in patients:The interleukin-11 receptor α asa candidate target in the progression of human prostate cancer.Cancer Res,2004,64:435~439
35.Van Beek E,Lowik C,Ebetino F,Papapoulos S.Binding and antiresorptive properties of heterocycle-containing bisphosphonate analogs: Structure-activity relationships.Bone,1998,23:437~442
36.Lipton A,Theriault R,Hortobagyi G,Simeone J,Knight R,Mellars K, Reitsma D, Heffernan M, Seaman J.Pamidronate prevents skeletal complications and is effective palliative treatment in women with breast cancer and osteolytic bone metastases:Long-term results of two randomized placebo-controlled trials. Cancer, 2000, 88:1082~1090
37.Bhushan K,MisraP,Liu F,Mathur S,Lenkinski R,Frangioni J.Detection of breast cancer microcalcifications using a dual-modality SPECT/NIR fluorescent probe.J Am Chem Soc,2008,130:17648~17649
38.Bartholoma M,Valliant J,Maresca K,Babich J,Zubieta J.Singleamino acid chelates(SAAC):A strategy for the design of technetium and rhenium radiopharmaceuticals.Chem Commun,2009,5:493~512
39. Bowen ML. Orvig C. 99m-Technetium carbohydrate conjugates as potential agents in molecular imaging.Chem Commun,2008,41:5077~5091
40.Stephenson KA,Banerjee SR,Besanger T,Sogbein OO,LevadalaMK,McFarlaneN,Lemon JA,Boreham DR,Maresca KP,Brennan JD,Babich JW,Zubieta J,Valiant JF.Bridging the gap betweenin vivoandin vivoimaging:Isostructural Re and99mTc complexes for correlating fluorescence and radioimaging studies.J Am Chem Soc,2004,126:8598~8599
41. Schaffer P, Gleave J, Lemon J, Reid L, Pacey L,Farncombe T,Boreham D,Zubieta J,Babich J,Doering L,Valliant J.Isostructural fluorescent and radioactive probes for monitoring neural stem and progenitor cell transplants.Nucl Med Biol,2008,35:159~169
42.Catana C,Wu Y,Judenhofer M,Qi J,Pichler B,Cherry S. Simultaneous acquisition of multislice PET and MR images:Initial results with a MR-compatible PET scanner.J Nucl Med,2006,47(12):1968~1976
43.Patel D,Kell A,Simard B,Xiang B,Lin HY,Tian G.The cell labeling efficacy, cytotoxicity and relaxivity of copper-activated MRI/PET imaging contrast agents.Biomaterials,2010,32:1167~1176
44.OgawaM,Regino CA,Seidel J,Green MV,Xi W,WilliamsM, Kosaka N, Choyke PL, KobayashiH.Dual-modality molecular imaging using antibodies labeled with activatable fluorescence and a radionuclide for specific and quantitative targeted cancerdetection. Bioconjugate Chem,2009,20:2177~2184
45.Choi J,Park J,Nah H,Woo S,Oh J,Kim K,Cheon G,Chang Y,Yoo J,Cheon J.A hybrid nanoparticle probe for dual-modality positron emisson tomography and magnetic resonance imaging.Angew Chem Int Ed Engl,2008,47:6259~6262
46.Misselwitz B.MR contrast agents in lymph node imaging.Eur J Radiol,2006,58:375~382
47. Felding-Habermann B, MuellerBM, RomerdahlCA,Cheresh DA.Requirement of integrin αvβ3gene expression for human melanoma tumorigenicity.J Clin Invest,1992,89:2018~2022
48. BrooksPC, Clark RA, Cheresh DA. Requirement of vascular integrin alpha v beta 3 for angiogenesis.Science,1994,264:569~571
49.Lee H,Li Z,Chen K,Hsu A,Xu C,Xie J,Sun S,Chen X. PET/MRIdual-modality tumorimaging using arginine-glycine-aspartic(RGD)-conjugated radiolabeled iron oxide nanoparticles.J Nucl Med,2008,49:1371~1379
50.Frenette P,Subbarao S,Mazo I,von Andrian U,Wagner D. Endothelial selectins and vascular cell adhesion molecule-1 promote hematopoietic progenitorhoming to bone marrow. Proc NatlAcad SciUSA, 1998, 95:14423~14428
51.Zanjani ED,FlakeAW,Almeida-PoradaG, TranN,Papayannopoulou T.Homing of human cells in the fetal sheep model: Modulation by antibodies activating or inhibiting very late activation antigen-4 dependent function.Blood,1999,94:2515~2522
52.Peled A,Petit I,Kollet O,Michal M,Ponomaryov T,Tamara B,Nagler A,Ben-Hur H,Many A,Shultz L,Lider O,Alon R,Zipori D,Lapidot T.Dependence of human stem cell engraftment and repopulation of NOD/SCID mice on CXCR4.Science,1999,283(5):845~848
53.Lanzkron S,Collector M.Hematopoietic stem cell tracking in vivo: A comparison of short-term and long-term repopulating cells.Blood,1999,93(6):1916~1921
54.Hendrikx PJ,Martens CM,Hagenbeek A,Keij JF,Visser JW.Homing of fluorescently labeled murine hematopoietic stem cells.Exp Hematol,1996,24:129~140
55.Schwarze SR,Ho A,Vocero-Akbani A,Dowdy SF.In vivo protein transduction:Delivery of a biologically active protein into the mouse.Science,1999,285:1569~1572
56.NagaharaH,Vocero-Akbani AM,Snyder EL,Alan H,Latham DG,Lissy NA,Becker-Hapak M.Transduction of full-length TAT fusion proteins into mammalian cells:p27Kip1mediates cell migration.Nat Med,1998,4:1449~1452
57.Lewin M,Carlesso N,Tung C,Tang X,Cory D,Scadden D, Weissleder R. Tat peptide derivatized magnetic nanoparticles allow in vivo tracking and recovery of progenitor cells.Nat Biotechnol,2000,18:410~414
Progress of the Dual-Modality Probes for Molecular Imaging
HUANG Jiaguo1,ZENG Wenbin1,ZHOU Ming1,GAO Feng2
1.School of Pharmaceutical Sciences,Central South University,Changsha 410013,China;
2.The Third Xiangya Hospital of Central South University,Changsha 410013,China
This work was supported by grants from the National Natural Science Foundation of China(30900377),Program for New Century Excellent Talents in University by Ministry of Education (NCET-10-0800), the Fundametal Research Funds for the Central Universities(201022100002)and Mital Innovation Foundation(09MX15)
Sep 26,2010 Accepted:Nov 26,2010
ZENG Wenbin,Tel:+86(731)82650459,E-mail:wbzeng@hotmail.com
Molecular imaging enablesthe visualisation of cellular functions,physiological and pathological changes and the follow-up of molecular process in living organisms with intravital,real-time,non-invansive,dymanic three-dimensional imaging.However,no single modality is sufficient and perfect to obtain all the necessary information. The combination of two ormore imaging technologies, which called dual-or multi-modality imaging,can not only offer the benefits of relevant imagine devices complementary with each other,but also decrease false positive and negative rates,which will significantly improve the accuracy and credibility of diagnosis.Hence,Dual-or multi-modality probesopen up the new horizon for biomedical imaging and play a critical role in the diagnosis and monitoring of disease as well as the treatment.The purpose of this article is to provide an overview of recent development in the design strategies and application of dual-modality probes.The perspective of future trends in this field and the research frontiers nowadays are also briefly outlined.
Molecular imaging;Probe;Dual modality;Multi-modality
2010-09-26;接受日期:2010-11-26
国家自然科学基金项目(30900377),教育部新世纪优秀人才计划项目(NCET-10-0800),教育部中央高校基本科研业务费(201022100002),米塔尔创新项目(09MX15)
曾文彬,电话:(0731)82650459,E-mail:wbzeng@hotmail.com
R445
10.3724/SP.J.1260.2011.00301

