磁性氧化铁纳米颗粒及其磁共振成像应用
乔瑞瑞, 贾巧娟, 曾剑峰, 高明远
中国科学院化学研究所,北京 100190
磁性氧化铁纳米颗粒及其磁共振成像应用
乔瑞瑞, 贾巧娟, 曾剑峰, 高明远
中国科学院化学研究所,北京 100190
磁性氧化铁纳米颗粒在磁共振成像方面的应用,已经在全世界范围内得到了广泛的关注,相关研究也被各国科学家高度重视。目前,磁性氧化铁纳米颗粒正在从早期的基于被动识别的肝部磁共振造影,快速转向基于主动识别的磁共振分子影像应用。本文将围绕磁性氧化铁纳米颗粒的生物体内应用,着重介绍磁性纳米颗粒的制备及其在疾病诊断,尤其是在肿瘤早期影像诊断方面的研究进展。
磁性氧化铁纳米颗粒;磁共振;分子影像探针;肿瘤
引 言
随着纳米科学的发展,纳米材料在生物检测、疾病诊断及疾病治疗等方面均展示出了广阔的应用前景[1]。在众多的纳米材料中,磁性纳米颗粒 (magnetic nanoparticles,MNPs)以其超顺磁特性在磁共振成像 (magnetic resonance imaging,MRI)中表现出独特的造影剂(contrast agent)功能。配合以良好的生物安全性、表面可修饰性及其特殊的体内行为,磁性纳米颗粒在生物体内的应用方面展现出巨大的应用价值,并已经成为在生物医学中得到实际应用的最成功的纳米材料之一[2~7]。
到目前为止,全世界有多家公司企业参与了氧化铁纳米颗粒造影剂的研制与开发,并且已有多种商品化产品上市[2,4,6,7]。例如,Advanced Magnetics公司 (Cambridge,MA,USA)在大量的临床数据基础之上,率先推出了基于磁性氧化铁纳米材料的药物GastroMark®(ferumoxsil,口服肠胃制剂),并于1993年在欧洲获得批准上市;1996年,“美国食品药物管理局” (US Food and Drug Administration,FDA)批准了该公司用于肝部造影的静脉注射制剂Feridex® (中文译名菲力磁®);2000年,先灵公司用于肝部造影的Resovist®(ferucarbotran)在欧洲获得批准上市[8];随后又出现了淋巴造影剂Combidex® (Sinerem®)。目前,以磁性纳米颗粒为基础,已经形成了近10种处于不同临床阶段的产品[7](详见表1)。上述产品除了在临床上用于肝部损伤、节结和肿瘤磁共振影像诊断[9~11]及肿瘤的淋巴转移成像外[12],还被用于血池成像[13]。然而,磁性氧化铁纳米颗粒的上述应用,基本上是通过组织、器官对纳米材料的摄取来实现的,属于被动靶向模式。

表1 商品化或处于临床前期的磁性氧化铁造影剂[7]Table 1 List of iron oxide contrast agents commercialized or at different clinical stages[7]
近5年来,随着纳米颗粒制备技术的不断发展,尤其是伴随着高温热解法在高质量磁性纳米晶体制备方面的重大突破,颗粒尺寸及表面修饰结构更为明确可控的新一代磁性氧化铁纳米颗粒开始出现。通过先进的表面修饰方法,人们不仅可以获得具有长血液循环时间的磁性氧化铁纳米颗粒,同时,通过与特定的配体或受体的偶联,可获得功能更为复杂的新一代磁性氧化铁纳米颗粒MRI分子影像探针[9~11]。这些具有主动识别功能的探针不仅可以用于疾病相关研究,同时有望用于恶性肿瘤的早期诊断及鉴别诊断[11,14,15]。同时,磁性氧化铁纳米颗粒作为MR造影剂,其从被动识别向主动靶向的发展,催生了磁共振分子影像这一崭新的研究领域。
磁共振成像及超顺磁纳米颗粒磁共振造影剂
MRI是利用磁共振现象,借助计算机技术和二维图像重建方法进行成像的一种无创的影像手段。MRI技术的优点首先体现在高成像分辨率,适合于对脑部、软骨、肌肉、韧带等组织的解剖结构及病理改变进行观察。同时,MRI技术可进行多参数、多序列成像,因此可提供多层次诊断信息。由于无电离辐射,与基于X射线的影像技术相比,MRI不仅无创而且更为安全。最后,MRI还可以提供代谢、功能、血液及脑脊液流动等方面的信息。总之,MRI作为一种先进的影像手段,不仅功能强大,而且有着巨大的进一步发展的空间[16]。
磁共振成像的基本原理如下:质子数为奇数的原子核 (如氢原子核)会因其自旋运动而产生磁矩,在用特定频率的射频脉冲 (radio frequency,RF)激发下,该原子核会因能量共振吸收而被激发;停止射频脉冲后,被激发的原子核释放出能量回到基态而产生弛豫现象。弛豫过程包括纵向弛豫 (longitudinal relaxation)和横向弛豫 (transverse relaxation),相应的纵向弛豫时间为T1时间,横向弛豫时间为T2时间。纵向弛豫与能量相关,而横向弛豫则与相位相关。医学磁共振影像是通过具有空间位置依赖性的梯度磁场,实现对人体组织中的氢质子的空间定位,再通过对氢质子MR信号的采集、处理及图像重建实现人体成像。人体不同组织之间的信号强度差异形成了组织之间的对比度 (contrast),其影响因素主要包括:组织T1和T2时间的固有差别、组织氢质子密度的固有差别,以及流动效应引起的差别等。
为了突出显示组织之间的差异,尤其是正常组织与病变组织之间的差别,除了设计特殊的脉冲序列外,一种有效地提高MR成像对比度的方法就是使用造影剂,又称为对比剂。MR造影剂主要是通过影响其周围氢质子的弛豫来改善和提高MR成像的对比度。可以用作MR造影剂的物质主要有顺磁性物质及超顺磁性氧化铁纳米颗粒。一般顺磁性造影剂主要影响T1时间,即通过缩短纵向弛豫时间,使T1加权像变亮,因此顺磁性造影剂 (T1造影剂)一般都是正增强造影剂。典型的T1造影剂主要是含有钆的金属有机络合物。
与之不同的是,超顺磁性氧化铁纳米颗粒则对T2时间有着更为显著的影响。超顺磁性质是指当铁磁性 (ferromagnetic)或亚铁磁性 (ferrimagnetic)物质的颗粒小于某一临界尺寸时,由于磁取向能不足以抵抗热运动能,其磁矩方向可以任意翻转,因此在外磁场不存在的情况下,其磁化强度 (magnetization)基本为零。但是在外界磁场存在的情况下,超顺磁性物质尽管可以像顺磁性物质一样被磁化,然而不同的是,超顺磁性物质较顺磁性物质表现出更大的磁敏感性 (magnetic susceptibility),从而表现出更强的MR造影增强效果。实际上,超顺磁性是小尺寸磁性纳米颗粒独有的特性,也是描述磁性纳米材料的专用名词。由于超顺磁性纳米颗粒在外加磁场作用下会被诱导产生更强的局域磁场,进而强烈地影响颗粒周围水分子中氢质子的弛豫过程,同时能更为有效地缩短T2时间[17],使所得的T2加权像变暗,因此超顺磁纳米颗粒作为T2造影剂表现出负增强效果 (图1)[5]。
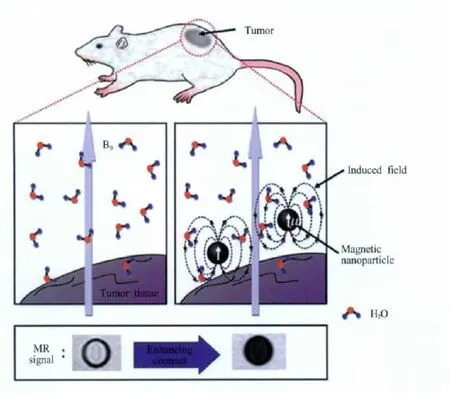
图1 超顺磁性氧化铁纳米颗粒的磁共振造影增强效应[5]Fig.1 MR contrast effects of superparamagnetic iron oxide nanoparticles[5]
除了对横向及纵向弛豫时间有着不同的影响外,超顺磁性的T2造影剂与顺磁性T1造影剂还有着以下诸多差别。
首先,T2造影剂——即超顺磁性纳米颗粒,由于具有更大的尺寸,因此表现出与T1造影剂完全不同的生物体内行为及代谢途径。这是因为,基于磁性纳米颗粒的T2造影剂具有较大的水合尺寸,易被机体的免疫系统,尤其是网状内皮系统 (reticuloendothelial system,RES)所摄取,进而投递到肝、脾、骨髓等巨噬细胞丰富的组织或器官中[7,18]。传统上,商品化的磁性氧化铁纳米颗粒造影剂按照其流体力学尺寸可粗略地分为SPIO(small particle of iron oxide)和USPIO(ultrasmall particle of iron oxide)两种类型。尽管文献中对SPIO和USPIO并没有一个严格的界定,但一般认为40 nm是上述两种造影剂的分类界线,即流体力学尺寸大于40 nm的为SPIO,小于40 nm的为USPIO。同时被广泛接受的是,USPIO由于具有更小的尺寸而容易逃避RES的摄取,因此较SPIO表现出具有更长的血液循环时间。例如,静脉注射的USPIO型磁性氧化铁造影剂Combidex®可以对肿瘤的淋巴转移成像,而尺寸更大的SPIO型造影剂Feridex®则由于其肝部有效摄取而只能用于肝部成像。然而,简单地按照磁性纳米颗粒的流体力学尺寸对其进行分类并对其体内行为进行预测是极不严谨的。目前越来越多的实验结果表明,纳米颗粒体内分布行为不仅取决于其流体力学尺寸,而且更为强烈地取决于纳米颗粒表面的物理化学性质[19],也就是说,流体力学尺寸远小于40 nm的纳米颗粒也可能因RES的摄取而表现出较短的血液循环时间[6]。总之,与T1造影剂相比,T2造影剂的应用方法及应用范围强烈地依赖于RES对其的摄取,因此表现出非常独特的组织分布及器官分布特点。
其次,T2造影剂由于具有更大的尺寸,不能像小分子T1造影剂那样自由穿越各种生理屏障,这不仅使得T2造影剂具有非常独特的体内分布行为,同时使其非常适合于肿瘤的造影。一方面可利用巨噬细胞在正常组织与肿瘤组织之间的分布差异实现对肿瘤的造影,另一方面,也可利用肿瘤血管的高通透、高滞留效应 (enhanced permeability and retention effect,EPR effect)实现对肿瘤的造影。同时,T2造影剂由于其纳米尺寸 (流体力学尺寸大于10 nm)表现出血液滞留效应,因此,磁性纳米颗粒造影剂还适用于血池造影。
再次,作为T2造影剂的磁性纳米颗粒,由于具有大量的表面结合位点,使其更适合于作为携带不同检测信号分子 (原子)的载体,进而实现多模态影像探针的构建[16]。再通过在颗粒表面加载可以对肿瘤进行有效识别的靶向分子,可实现肿瘤的多模态分子影像。
最后,与T1造影剂相比,基于磁性纳米颗粒的T2造影剂的对比度增强效果更为显著。例如,Gd络合物造影剂成像时的最低检测限为10-4mol/L[20],而目前报道的磁性纳米颗粒的最低检测限可达10-12mol/L[21]。不过,磁性纳米颗粒的磁共振检测限还强烈地取决于磁性纳米颗粒的尺寸、结晶度及表面修饰等因素[20]。
到目前为止,基于磁性氧化铁纳米颗粒的核磁共振造影剂的发展历程,可粗略地划分为如下三个阶段:第一阶段为SPIO和USPIO类型造影剂的临床评估阶段 (1980~90年代中后期);第二阶段为商用造影剂的应用拓展阶段 (上世纪末到本世纪初),包括USPIO型造影剂在淋巴转移临床诊断中的应用、商用造影剂表面功能化修饰及细胞标记应用等;第三阶段为目前以磁共振分子影像探针为主流的再发展阶段 (最近5年),在这一阶段先后出现了MRI-PET多模态造影剂、蛋白和多肽介导的生物靶向磁共振分子探针,以及MRI-光学、MRI-PET、MRI-SPECT多模态分子探针。磁性氧化铁纳米颗粒造影剂之所以在过去短短几年经历了高速的再发展阶段,其根本原因在于,磁性纳米颗粒的合成技术发生了革命性的变化[7]。
磁性氧化铁纳米颗粒的合成
磁性氧化铁纳米颗粒的合成,按照合成原理,可以粗略地分为水相合成和非水相合成。水相合成方法主要依赖于铁离子的水解来实现磁性纳米颗粒的制备,而作为非水相合成的典型方法——高温热分解方法,则主要依赖于铁的金属有机化合物的热解来实现磁性氧化铁纳米颗粒的制备,下面将就这两种方法分别进行介绍。
水相合成
早在1925年,Welo等人[22]就报道了在水溶液中应用共沉淀法获得四氧化三铁的方法。原则上讲,制备磁性氧化铁纳米颗粒的方法与制备体相磁性氧化铁方法类似,主要区别在于,制备氧化铁纳米颗粒时需要有效控制成核生长过程,以获得纳米尺寸的颗粒。到目前为止,采用水相合成制备磁性氧化铁纳米颗粒的方法主要包括:微乳液 (micro-emulsion)法、溶胶-凝胶 (gel-sol)法、超声化学法 (sonochemistry)和共沉淀 (coprecipitation)法等。采用水相合成法制备氧化铁纳米颗粒的优点是制备过程简单,因此,目前商品化的磁性纳米颗粒造影剂基本上都是采用水相合成制备获得的。然而,水及氢氧根离子与三价铁离子有着非常强的配位能力,因此,通过水解方法获得的磁性氧化铁纳米颗粒,其表面结构复杂,表面功能化修饰困难。同时,因为铁离子水解过程涉及诸多反应平衡,水解产物结构复杂,难于获得尺寸可控的高质量窄粒度分布纳米颗粒[23,24]。最后,受水的沸点温度限制,在水体系中合成纳米材料,产物结晶度也是一个面临的问题。总之,水相合成方法制备的磁性氧化铁颗粒一般粒度分布较宽,磁响应相对较弱,表面结构不明确[7]。
非水相合成
磁性氧化铁纳米颗粒非水相合成法的主要代表,是近几年发展的高温热分解法。高温热分解方法摒弃了铁离子的水解反应,转而采用金属有机铁化合物的热解反应来实现磁性氧化铁纳米晶体的制备。高温热分解方法的技术特点是,采用高沸点的弱极性或非极性有机溶剂作为反应传热介质,通过分解铁前驱体的方式,实现磁性氧化铁纳米晶体的制备。
1999年,美国伯克利大学的Alivisatos研究组[25]率先报道了磁性氧化铁纳米晶体的热分解制备技术。他们首先将高沸点的三辛胺溶剂和溶解有FeCuP3(亚硝基羟基苯胺合铁,铜铁试剂)的辛胺溶液,分别在110℃和60℃通入N2除水除氧,然后将三辛胺加热至300℃,在剧烈搅拌下迅速注入FeCuP3的辛胺溶液,加热回流30 min后冷却至室温,经过溶剂尺寸选择沉淀处理,得到平均尺寸为(10±1.5)nm的γ-Fe2O3磁性纳米晶体 (图2A)。2001年,Hyeon等人[26]发展了上述方法,他们采用Fe(CO)5取代上述方法中的铜铁试剂,同样得到了γ-Fe2O3磁性纳米晶体。在该方法中,由于Fe(CO)5初始分解时得到的是Fe纳米晶体,因此后期采用氧化法以获得γ-Fe2O3磁性纳米晶体 (图2B)。该方法最大的进展在于,得到的纳米颗粒具有非常窄的尺寸分布 (<5%),通过调节Fe(CO)5与油酸的比例,还可获得尺寸在4~11 nm之间的纳米颗粒。
2002年,Sun等人[27]以Fe(acac)3(乙酰丙酮铁)为铁前驱体,油酸和油胺为稳定剂,1,2-十六醇为还原剂,在高沸点溶剂苯醚中,成功地合成了4 nm球形Fe3O4纳米晶体,并以此为晶种,通过调节晶种与乙酰丙酮铁的比例,制得了不同尺寸的球形Fe3O4纳米晶体(图2C)。在此基础上,采用类似的方法,作者还合成了一系列的单分散的MFe2O4(M=Fe、Mn、Co)磁性纳米晶体[28]。
此后,Peng等人[29]报道了基于金属脂肪酸盐高温热分解法制备Fe3O4纳米颗粒的方法,所制备的纳米颗粒尺寸可在6~50 nm范围可调。Hyeon等人[30]利用该方法发展了单分散性的磁性氧化铁纳米颗粒 (10 g级)(图2D)的大规模制备技术,通过控制反应温度,还可得到不同尺寸的纳米颗粒,例如,在274、287、317、330和365℃条件下可分别得到5、9、12、16及22 nm的氧化铁纳米颗粒。他们认为,制备单分散性磁性氧化铁纳米颗粒的关键在于将成核与生长过程分开。此外,Cheon等人[11]还采用Fe(acac)3为铁前驱体,制备了金属掺杂型铁氧体 (metal-doped magnetism-engineered iron oxide,MEIO)MFe2O4(M=Mn、Fe、Co、Ni)。其中,MnFe2O4纳米颗粒的饱和磁化强度最强,因此有可能进一步提高MRI造影的对比度。

图2 (A)以FeCup3为前驱体,采用高温热分解法制备的γ-Fe2O3纳米颗粒的TEM照片[25];(B)以Fe(CO)5为前驱体,采用高温热分解法制备的γ-Fe2O3纳米颗粒的TEM照片[26];(C)以Fe(acac)3为前驱体,采用高温热分解法制备的Fe3O4纳米颗粒的TEM照片[27];(D)以油酸铁为前驱体制备的Fe3O4纳米颗粒的TEM照片[30]Fig.2 (A) γ-Fe2O3nanocrystals synthesized by thermal decomposition of FeCup3[25];(B) γ-Fe2O3nanocrystals synthesized by thermal decomposition of Fe(CO)5[26];(C)Fe3O4nanocrystals prepared by pyrolyzing Fe(acac)3[27];(D)Magnetic iron oxide nanocrystals prepared by using iron oleate as precursor[30]
除金属有机铁前驱体外,无机铁化合物也可作为前驱体制备磁性氧化铁纳米颗粒,Colvin等人[31]利用FeOOH在油酸中良好的溶解性,以FeOOH作为前驱体,制备出粒径为12.5 nm的单分散性Fe3O4纳米颗粒。当然,该方法可分类为非水相合成,但并非严格意义的高温热分解方法。
上述合成方法的共同特点有:1)均采用非极性或弱极性溶剂作为反应传热介质;2)为了解决磁性氧化铁纳米晶体与溶剂的相容性,反应过程中均需要使用带有疏水长烷基链的酸、醇和胺等表面配体,所得到的产物均表现出疏水性。欲将上述方法制备的磁性纳米晶体用作磁共振造影剂,还需通过进一步的配体交换或表面修饰等复杂过程,才能得到在水中具有溶解分散性质的磁性纳米颗粒[9,32,33]。尽管如此,磁性氧化铁纳米晶体高温分解方法仍以其产物的高结晶度和窄粒度分布方面的优势,为磁性氧化铁纳米颗粒的生物应用揭开了新的篇章。

图3 采用强极性2-吡咯烷酮作为配位溶剂,利用“一锅”反应制备的水溶性Fe3O4纳米颗粒的TEM照片[35]左图中颗粒的平均尺寸为5 nm,右图中颗粒的平均尺寸为11 nm,标尺对应100 nmFig.3 TEM images of water-soluble Fe3O4nanoparticles by using 2-pyrrolidone as coordinating solvent[35]The average particle sizes of those shown in the left-hand side image and right-hand side image are of 5 and 11 nm,respectively.The scale bars correspond to 100 nm
最近,高明远课题组进一步发展了磁性氧化铁纳米晶体的高温热分解方法,他们摒弃了高沸点弱极性或非极性溶剂,转而采用高沸点的强极性溶剂 (2-吡咯烷酮)作为反应传热介质及配位溶剂,通过加热分解Fe(acac)3,成功地通过“一锅”反应制备出了不同尺寸的Fe3O4纳米晶体 (图3)[34,35]。尽管该磁性纳米晶体不能直接分散于中性水溶液中,但却能在酸性或碱性溶液中很好地溶解分散。该技术路线的最大优势是,所采用的溶剂与诸多种类的表面配体均具有很好的相容性,为纳米晶体表面配体的多样化原位修饰提供了可能。在深入研究Fe3O4纳米晶体形成机理的同时[36],针对磁性氧化铁纳米晶体的生物应用,他们进一步发展了该技术路线,通过在反应体系中加入羧基化聚乙二醇 (PEG),在磁性氧化铁纳米颗粒形成的同时,原位地实现了磁性纳米颗粒的表面生物相容性修饰,成功地建立了生物相容性磁性纳米颗粒的“一锅”反应制备技术 (图4)[37,38]。PEG修饰不仅大大地改善了Fe3O4纳米颗粒的生物相容性,提高了Fe3O4纳米颗粒的血液循环时间,更为最重要的是,PEG以其良好的亲水性,使环境中的水分子更容易接近纳米颗粒表面,因此,PEG修饰的Fe3O4纳米颗粒在相同条件下可表现出更为优异的MRI造影功能[39]。此外,该技术路线还提供了制备表面带有羧基残基的生物相容性磁性氧化铁纳米颗粒的“一锅”反应方法(图5)[10,40],生物相容性纳米颗粒表面的羧基残基,为进一步将磁性氧化铁纳米颗粒与生物大分子偶联,进而获得磁共振分子影像探针提供了可能。


图5 表面具有可反应官能团的生物相容性Fe3O4纳米颗粒的TEM照片[40](A)颗粒的平均尺寸为12 nm;(B)颗粒的平均尺寸为27 nm。标尺对应100 nmFig.5 TEM images ofbiocompatible Fe3O4nanoparticles with surface reactive moieties[40] The average particle sizes of those shown in(A)and(B)are of 12 and 27 nm,respectively.The scale bars correspond to 100 nm
高明远课题组发展的生物相容性磁性氧化铁纳米颗粒的“一锅”反应制备技术,一方面充分利用了高温热分解反应的优势,同时摆脱了复杂的纳米颗粒表面后处理过程。后处理过程的缺点可概括为以下几个方面:1)表面配体置换方法缺乏对纳米颗粒表面结构的有效控制,所得到的纳米颗粒在水及生理盐水中溶解性欠佳;2)采用相转移法尽管可以克服表面配体置换法的缺点,但无谓地增大了水溶性磁性纳米颗粒的尺寸,不利于实现纳米颗粒的长血液循环时间。最重要的是,得到的纳米颗粒由于表面存在一个疏水层而增大了环境中氢质子与中心纳米颗粒间的距离,从而降低了磁性纳米颗粒的磁共振对比增强效果。
采用相似的方法,以N-乙烯基吡咯烷酮 (N-vinyl-2-pyrrolidone,NVP)为溶剂,加热分解Fe(acac)3,通过简单“一锅”反应,还可合成出具有超级溶解性能的磁性Fe3O4纳米晶体[41]。研究结果表明,在反应体系中,NVP不但作为高温传热介质,而且作为自由基聚合单体;同样,Fe(acac)3既作为高温热分解反应的有机前驱体,又作为自由基聚合的引发剂。反应过程成功地将自由基聚合过程和高温热分解生成Fe3O4纳米晶体结合起来。聚合生成的聚乙烯基吡咯烷酮 (polyvinylpyrrolidone,PVP)高分子链段的一部分,与Fe3O4纳米粒子进行配位起到稳定剂的作用,未配位的PVP高分子链段赋予其超级溶解性能,使其不但能够溶于不同pH值的水溶液及PBS生理缓冲液中,而且能够溶于多种有机溶剂中,并能形成稳定的胶体溶液[41]。
总之,与水解方法相比,磁性氧化铁纳米晶体的高温热分解制备方法表现出了诸多优势:1)高温热分解方法采用高沸点的溶剂作为反应传热介质,因此获得的产物结晶度高,磁响应强;2)反应体系中无水参与反应,纳米晶体表面修饰结构更为清晰,反应过程中对纳米晶体表面进行原位修饰更为容易;3)磁性氧化铁纳米晶体在非极性溶剂中的生长过程更倾向于热力学控制过程,所得纳米颗粒尺寸的单分散性更好[30]。因此,高温热分解方法以其在所制备的磁性纳米晶体质量方面的绝对优势,正在掀起磁性纳米颗粒在磁共振分子影像技术中应用的新一轮研究热潮[10,11,30,32]。
磁性纳米颗粒在磁共振成像中的应用
磁性氧化铁纳米颗粒的早期临床应用是利用肝部Kuffers细胞对其的吞噬,从而实现肝部成像的,在此基础上,FDA于1996年批准了Feridex®(水合尺寸大约在80~150 nm[5])造影剂。尽管都是由右旋糖苷修饰形成的磁性纳米颗粒,与Feridex®不同的是,后期发展的Combidex®(水合尺寸为20~40 nm)由于尺寸更小而表现出更长的血液循环时间,在经静脉注射后,Combidex®可以从血液系统进入淋巴系统,因此具有更广阔的临床应用前景。例如,Weissleder课题组[12]采用Combidex®,成功地在临床中实现了尺寸小于2 mm的肿瘤淋巴结转移成像。对磁性氧化铁纳米颗粒的临床应用来讲,这一研究工作与FDA批准Feridex®一样具有重要的里程碑意义。
在分子水平上,人们利用超顺磁氧化铁纳米颗粒与各种生物大分子复合来制备磁共振分子探针,进而实现在生物活体中检测细胞内外的分子过程和细胞凋亡过程、追踪基因表达或对疾病进行诊断,这已经成为磁共振分子影像学发展的重要方向。Weissleder等人[42]采用全转铁蛋白 (holo-transferrin)标记的单晶氧化铁纳米颗粒造影剂 (monocrystal iron-oxide nanoparticle,MION)首次实现了转基因表达的无损活体检测。Zhao等人[43]用C2domain标记的超顺磁氧化铁颗粒造影剂 (SPIO,采用共沉淀法按照欧洲专利合成)检测了早期肿瘤内部的细胞凋亡过程。
在细胞水平上,利用细胞与磁性纳米晶体的相互作用来对特定细胞进行标记,从而实现对细胞在活体内的生物学过程的动态监测和可视化跟踪,已经成为磁共振细胞影像技术的重要基础。例如,利用磁性纳米颗粒 〔Feridex®和单晶氧化铁纳米粒子MION,前者的流体力学尺寸>50 nm,后者为表面修饰有右旋糖苷 (Dextran)的20~40 nm的颗粒〕[44],人们已经实现了对巨噬细胞浸润、癌细胞转移、干细胞或祖细胞的迁徙与分化、树突状细胞的迁移等重要生物过程的活体可视化[45~47]。细胞标记磁性氧化铁纳米颗粒的关键在于细胞载量,即在不产生细胞毒性并对其活性没有明显影响的情况下,使细胞标记足够量的磁性氧化铁纳米颗粒,从而有利于体内成像观察。而决定细胞载量的主要因素包括磁性氧化铁纳米颗粒的尺寸、表面电荷以及表面配体。Cheon等人[48]通过研究骨髓干细胞对带有不同电荷的磁性氧化铁纳米颗粒的吞噬效果,发现带有正电荷的磁性氧化铁纳米颗粒更容易被骨髓干细胞所吞噬;最近,Gu等人[49]发现,采用低分子量的两亲性聚阳离子包覆的SPIO纳米颗粒,较商品化的PEI25k更易被干细胞吞噬。
利用PEG修饰的Fe3O4纳米颗粒具有较长的血液循环时间的特性,Lei等人[50]以弓形虫脑炎为模型开展了小鼠脑部MR成像研究。弓形虫感染引起的血脑屏障 (blood brain barrier,BBB)透过性变化,一般认为是由炎症或BBB损伤引起的,由于Fe3O4纳米颗粒较小分子Gd-基造影剂具有更大的尺寸,因此会滞留于被损伤的血管附近,从而更好地显示了弓形虫感染引起的小鼠脑部损伤。实际上,肿瘤组织的血管较正常组织表现出更大的通透性,从而使肿瘤组织具有高通透、高滞留效应,即EPR效应。利用这一效应,Lee等[51]以聚合物包覆的Fe3O4磁性纳米颗粒为造影剂,开展了肿瘤的活体MR成像研究。
针对正常组织的血管来讲,血管壁的通透性允许小分子自由通过,而大尺寸的纳米颗粒却很不容易通过,因此,具有长血液循环时间的磁性氧化铁纳米颗粒还适用于血管造影成像,在血池造影方面展现出良好的应用前景。
然而,以上成像应用或是基于RES对磁性纳米颗粒的吞噬,或是基于磁性纳米颗粒在机体内的特殊组织分布,因此还不能进一步在细胞水平或分子水平上进行成像应用。
近几年来,随着纳米材料合成技术的发展和完善,表面修饰结构及功能更为复杂的新一代超顺磁性氧化铁纳米颗粒MRI造影剂开始出现,并促进了磁共振细胞影像和分子影像新技术的诞生。在这些应用当中,针对肿瘤早期诊断检测的分子成像技术的发展,引起了各国科学家的广泛重视与研究,涌现出多种基于磁性氧化铁纳米颗粒的新成像方法和技术。众所周知,恶性肿瘤已成为威胁人类健康和生命的头号“杀手”,其死亡率多年居高不下,而提高早期肿瘤和肿瘤转移诊断的准确率,并结合个体化治疗是提高5年生存率的关键。因此,将磁性纳米颗粒与可以有效识别肿瘤的分子进行偶联,进而获得可主动识别肿瘤的磁共振分子影像探针,来有效实现对微小肿瘤的早期诊断,已经成为肿瘤MR影像诊断的一个重要的发展趋势。而高温热解法提供的磁性氧化铁纳米晶体以其高结晶度、窄粒度分布、表面可修饰性等优势,为开展上述研究提供了可能。
韩国几个研究集体和中国科学院化学研究所高明远课题组率先在国际上开展了相关研究工作,并取得了重要的突破性进展。如:Cheon课题组[9]用Herceptin标记的超顺磁氧化铁纳米颗粒成功地实现了对接种在小鼠体内乳腺癌肿瘤的活体检测,在此基础上,他们又进一步采用Herceptin标记的锰掺杂氧化铁颗粒,成功地实现了~50 mg小肿瘤的活体检测[11],该尺寸比采用核医学所能检测到的肿瘤尺寸还要小[52]。由图6可知,Herceptin标记的MnFe2O4的造影效果要远远优于同样条件下制得的Fe3O4和常用造影剂CLIO(cross-linked iron oxide)。

图6 Herceptin标记的MnFe2O4磁性纳米颗粒与Herceptin标记的CLIO磁性纳米颗粒在小鼠体内检测肿瘤的造影结果[11]Fig.6 MR imaging results onin vivotumor detection by using MnFe2O4-Herceptin and CLIO-Herceptin conjugates(CLIO:cross-linked iron oxide)[11]
几乎同时,高明远课题组开展了相似的研究工作,并将利用具有自主知识产权方法制备的磁性纳米晶体成功地用于肿瘤的活体诊断。他们以结肠癌荷瘤裸鼠为活体肿瘤成像模型,以癌细胞表面癌胚抗原 (carcinoembryonic antigen,CEA)为靶点,以人源化抗CEA单克隆抗体rch 24为特异性识别分子,设计合成了具有肿瘤靶向功能的磁共振成像探针(Fe3O4-rch 24),并在活体动物模型上开展了磁共振成像 (图7)。结果表明,Fe3O4-rch 24探针能够特异性识别移植肿瘤病灶,产生T2成像对比增强信号。增强信号于注射探针后24 h达到峰值,与注射前相比,T2值下降10%,而对照组 (未偶联抗体的Fe3O4纳米颗粒)则无明显下降[10]。他们最近的研究结果进一步表明,改变磁性氧化铁纳米颗粒的表面结构,不仅可以有效调控磁性纳米颗粒与血浆蛋白的相互作用[19],同时还可以大大提高氧化铁纳米颗粒的血液循环时间及磁共振造影增强效果,如:采用油胺和PEG共修饰的Fe3O4与胃癌单克隆抗体3H11构建的磁共振探针,在静脉注射24 h后,肿瘤部位的T2值下降高达30%(图8)[39]。上述研究结果进一步表明,磁性氧化铁纳米颗粒的表面化学结构及其物理性质,对探针的磁共振信号增强效果有着巨大的影响。

图7 (A)Fe3O4纳米颗粒的TEM照片;(B)静脉注射Fe3O4-rch 24探针前及24 h后采集的荷瘤裸鼠肿瘤部位 (红虚线圈)的T2*加权像;(C)静脉注射Fe3O4-rch 24探针及其对照样品Fe3O4@PEG-COOH颗粒前后,24 h内不同时间点采集的肿瘤部位的T2*加权像[10]Fig.7 (A)TEM image of Fe3O4nanoparticles;(B)T2*-weighted MR images acquired before and after the injection of Fe3O4-(rch 24 mAb)conjugates;(C)T2*-weighted MR images of two tumors acquired before and at different times after intravenous injections of Fe3O4-(rch 24 mAb)conjugates(upper row)and Fe3O4@PEG-COOH nanocrystals(lower row),respectively[10]
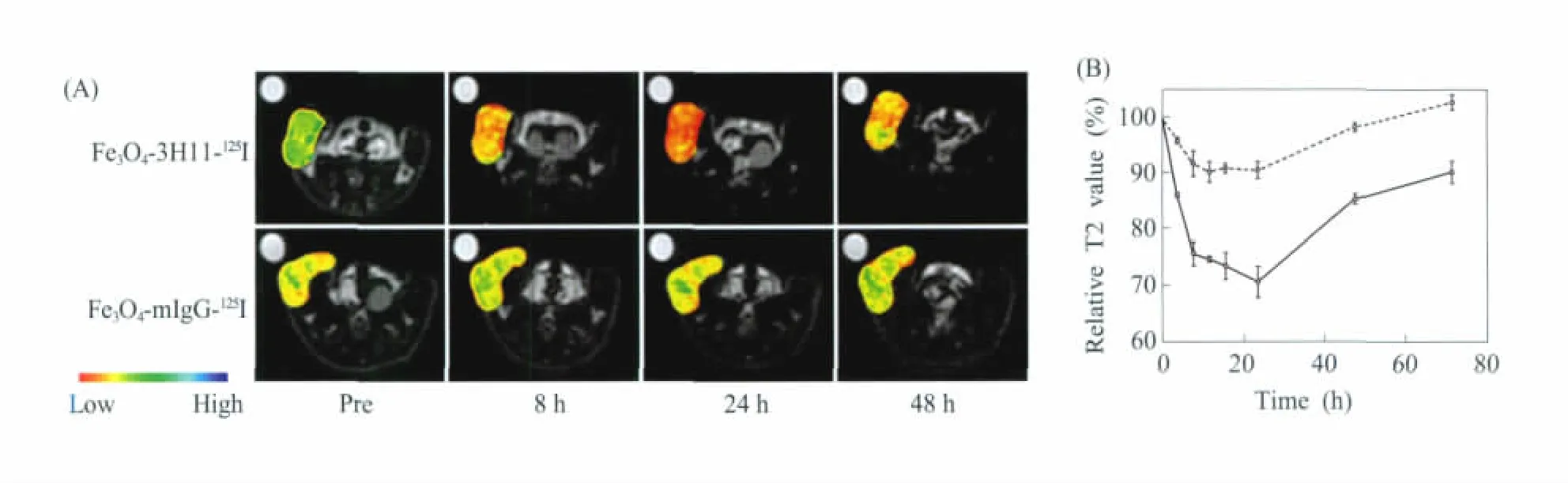
图8 (A)荷瘤裸鼠静脉注射Fe3O4-3H11-125I及不相关探针Fe3O4-mIgG-125I后的磁共振T2加权像;(B)静脉注射Fe3O4-3H11-125I(实线)及Fe3O4-mIgG-125I(虚线)后,肿瘤区域的T2值变化曲线。左下侧的伪彩为色阶图[39]Fig.8 (A)T2-weighted MR images of tumor-bearing nude mice acquired before and at different time points after intravenous injections of Fe3O4-3H11-125I and Fe3O4-mIgG-125I,respectively;(B)Variations of T2 values of tumors after the injections of Fe3O4-3H11-125I(solid line)and Fe3O4-mIgG-125I(dotted line),respectively.The tumors are high-lighted by fake color with a color map shown at the left-bottom corner[39]
由上述两个研究报道可以看出,构建肿瘤分子影像探针,一方面需要有机结合纳米晶体先进的制备技术及表面修饰技术,另一方面,还需要对肿瘤具有亲合力的靶向分子。尽管单克隆抗体是一个不错的选择,然而其缺点是尺寸较大,与纳米颗粒偶联后,有可能增加 RES对磁性纳米颗粒摄取的几率,另外,抗体对癌细胞的识别及在肿瘤部位的有效富集需要较长的时间,给实验研究及临床应用带来一定的困难。因此,探索分子量更小的肿瘤靶向分子,对于构建肿瘤分子影像探针具有十分重要的意义。比如,一些科学家们已经开始尝试采用分子量较小的单链抗体、蛋白及多肽等生物分子或叶酸 (folic acid,FA)分子来构建肿瘤磁共振分子探针。
Gao等人[53]以磁性氧化铁纳米颗粒为载体,采用EGFR相关单链抗体ScFvEGFR(single-chain anti-EGFR antibody)作为靶向性分子,构建了磁共振靶向分子探针ScFvEGFR-IO,并成功地将该探针用于体内原位移植胰腺癌肿瘤模型的诊断;北京协和医院的金征宇等人[54]则采用表面为PEG修饰的Fe3O4纳米颗粒,与重组人促性腺激素释放激素融合蛋白——绿脓杆菌外毒素40(recombinant human gonadotrop in releasing hormone-Pseudomonas exotoxin 40,GnRH-PE40)偶联,构建了肿瘤靶向性分子探针,并将该探针通过静脉注入荷瘤鼠体内进行成像,结果表明,与对照组相比,靶向探针可以使肿瘤部位T2信号显著下降 (P<0.05);Josephson等人[55]利用多肽标记的氧化铁纳米颗粒,实现了胰腺癌的活体可视化。在以小分子作为靶向性分子的研究中,以整合素αvβ3作为靶点,采用精氨酸-甘氨酸-天冬氨酸三肽 (arginine-glycine-aspartic acid,RGD)作为靶向性分子的研究独树一帜。RGD多肽与氧化铁纳米颗粒偶联后,可被用于多种肿瘤模型的活体分子成像,例如乳腺癌、恶性黑色素瘤及鳞状上皮细胞癌等[56~59]。由于RGD多肽及其衍生物为小分子化合物,因此磁性氧化铁纳米颗粒表面可以偶联多个RGD分子,从而有效提高影像探针与靶点的结合率[58]。除RGD外,蝎氯毒素 (chlorotoxin,CTX)也可作为靶向分子,用于肿瘤的磁共振分子成像中,同时,CTX还可发挥肿瘤治疗的作用[15]。除此之外,由于多种肿瘤细胞表面叶酸受体表达上调,FA也常常作为肿瘤靶向分子,用于肿瘤磁共振分子影像。例如,Zhang等人[60]采用Fe3O4-FA偶联物进行的体外细胞实验表明,Fe3O4-FA偶联物可以特异性地与肿瘤细胞结合;而Shi等人[32]采用树枝状分子修饰的磁性氧化铁与叶酸偶联后形成的肿瘤分子探针,证明在活体层面上可以实现对表皮癌细胞 (KB)肿瘤的磁共振成像。
在肿瘤磁共振影像诊断应用方面,与早期的磁性纳米颗粒被动模式相比,近年来发展的具有主动识别功能的磁性氧化铁纳米颗粒探针,其在肿瘤病灶部位的富集,主要是基于肿瘤靶向分子与靶点的特异性识别作用,因而能够提供更接近病理的相关信息,因此,以氧化铁纳米颗粒为主流的肿瘤磁共振分子影像技术,将无疑为目前一些难以治疗的重大疾病 (如癌症)开辟新的诊疗蓝图。而磁性氧化铁纳米颗粒作为分子成像载体的最佳选择之一,其原因在于:首先,磁性氧化铁纳米颗粒可以显著增强氢质子的T2和T2*信号;其次,磁性氧化铁纳米颗粒的表面,为更为复杂的探针设计提供了一个理想的多位点平台,在该平台上,结合化学、药学、影像学及肿瘤学知识,完全有机会设计出功能强大的分子影像探针,为深入揭示肿瘤等重大疾病的发生发展机理及有效治疗,提供更为全面的分子信息,从而大幅度提高肿瘤等重大疾病的诊治水平。
展 望
超顺磁氧化铁纳米颗粒因其超顺磁性、生物安全性、可修饰性及其特殊的体内行为,作为新型MRI造影剂具有无可比拟的优越性。目前,基于磁性氧化铁纳米颗粒的磁共振造影剂已经有多种产品上市或处于临床检验阶段。最近几年,以磁性氧化铁纳米颗粒为核心的肿瘤分子影像及其在肿瘤研究与早期诊断方面的应用,无疑将加速磁性氧化铁纳米颗粒的生物医学应用步伐。但从相关文献报道看,所得出的研究结果与结论不尽相同,甚至相反,这主要是由于对纳米颗粒的认识不足造成的。纳米颗粒的生物医学应用,除了与纳米材料自身的化学组成、颗粒尺寸密切相关外,还在非常大的程度上取决于纳米颗粒的表面物理化学性质,表面性质差异将使得纳米材料在生物体内表现出完全不同的行为,包括血液循环行为的差别及体内分布与代谢途径的差别等。总之,现阶段以生物体内应用为目标的磁性纳米颗粒研究,仍有下列值得深入研究的重要问题:1)如何进一步发展纳米颗粒的免疫逃逸策略。磁性纳米颗粒在磁共振分子影像及多模态分子影像中应用的一个重要前提,是能够有效避免免疫系统对纳米颗粒的吞噬,以进一步提高磁性纳米颗粒到达并有效富集于病灶部位的几率。2)纳米颗粒体内分布与其表面修饰结构物理化学性质的相关性。纳米颗粒与调理素 (opsonin)的相互作用,在很大程度上决定了纳米材料的体内分布与代谢途径。3)纳米颗粒尺寸对其体内分布、代谢途径、血液循环行为以及造影效果的影响等。
近年来,随着分子影像技术的出现与发展,整合各种成像技术的优势,发展多模态分子成像手段以弥补单模态成像的缺陷,实现分子影像学在肿瘤早期诊断及在体定量分析方面的应用,已经成为医学影像学进一步发展的重要方向。在这一发展过程中,多模态成像方法与多模态分子影像探针具有同等重要的地位。超顺磁性氧化铁纳米颗粒作为纳米载体,在构建多模态肿瘤分子影像探针方面已经展现出巨大的潜力,因此,磁性氧化铁纳米颗粒无疑将在多模态分子影像这个崭新的研究领域中扮演重要的角色。
1.杨文胜,高明远,白玉白.纳米材料与生物技术.北京:化学工业出版社,2005 Yang WS, Gao MY, BaiYB. Nanomaterials and biotechnology.Beijing:Chemical Industry Press,2005
2. Degen CL,Poggio M,Mamin HJ,Rettner CT,Rugar D.Nanoscalemagnetic resonanceimaging.Proc Natl Acad Sci USA,2009,106(5):1313~1317
3. Weissleder R,Pittet MJ.Imaging in the era of molecular oncology.Nature,2008,452(7187):580~589
4. Sun C,Lee JSH,Zhang MQ.Magnetic nanoparticles in MR imaging and drug delivery.Adv Drug Deliv Rev,2008,60(11):1252~1265
5. Jun YW, Lee JH, Cheon J. Chemicaldesign of nanoparticle probes for high-performance magnetic resonance imaging.Angew Chem Int Ed,2008,47(28):5122~5135
6. Corot C,Robert P,Idee JM,Port M.Recent advances in iron oxide nanocrystal technology for medical imaging.Adv Drug Deliv Rev,2006,58(14):1471~1504
7. Qiao RR,Yang CH,Gao MY.Superparamagnetic iron oxide nanoparticles: From preparations to in vivo MRI applications.J Mater Chem,2009,19(35):6274-6293
8. Wagner V,Dullaart A,Bock AK,Zweck A.The emerging nanomedicinelandscape.Nat Biotechnol,2006,24(10):1211~1217
9. Huh YM,Jun YW,Song HT,Kim S,Choi JS,Lee JH,Yoon S,Kim KS,Shin JS,Suh JS.Cheon J.In vivo magnetic resonance detection of cancer by using multifunctional magnetic nanocrystals. JAm Chem Soc,2005,127(35):12387~12391
10.Hu FQ,Wei L,Zhou Z,Ran YL,Li Z,GaoMY.Preparation of biocompatible magnetite nanocrystals forin vivomagnetic resonance detection of cancer.Adv Mater,2006,18(19):2553~2556
11.Lee JH,Huh YM,Jun Y,Seo J,Jang J,Song HT,Kim S,Cho EJ, Yoon HG, Suh JS, Cheon J. Artificially engineered magnetic nanoparticles for ultra-sensitive molecular imaging.Nat Med,2007,13(1):95~99
12.Harisinghani MG,Barentsz J,Hahn PF,Deserno WM,TabatabaeiS, van de Kaa CH, de la Rosette J,WeisslederR. Noninvasive detection of clinically occult lymph-node metastases in prostate cancer.N Engl J Med,2003,348(25):2491~2495
13.Schnorr A,Wagner S,Abramjuk C,Wojner I,Schink T,KroenckeTJ,Schellenberger E,Hamm B,Pilgrimm H,Taupitz M.Comparison of the iron oxide-based blood-pool contrast medium VSOP-C184 with gadopentetate dimeglumine for first-pass magnetic resonance angiography of the aorta and renal arteries in pigs.Invest Radiol,2004,39(9):546~553
14.Veiseh O,Sun C,Fang C,Bhattarai N,Gunn J,Kievit F,Du K,Pullar B,Lee D,Ellenbogen RG,Olson J,Zhang MQ. Specific targeting of brain tumors with an optical/magnetic resonance imaging nanoprobeacrossthe blood-brain barrier.Cancer Res,2009,69(15):6200~6207
15.Sun C,Veiseh O,Gunn J,Fang C,Hansen S,Lee D,Sze R,Ellenbogen RG,Olson J,Zhang M.In vivoMRI detection of gliomasby chlorotoxin-conjugated superparamagnetic nanoprobes.Small,2008,4(3):372~379
16.Cheon J,Lee JH.Synergistically integrated nanoparticles asmultimodal probesfor nanobiotechnology. AccChem Res,2008,41(12):1630~1640
17.Jun YW,Seo JW,Cheon A.Nanoscaling laws of magnetic nanoparticles and their applicabilities in biomedical sciences.Acc Chem Res,2008,41(2):179~189
18.Moghimi SM,Hunter AC,Murray JC.Long-circulating and target-specific nanoparticles:Theory to practice.Pharmacol Rev,2001,53(2):283~318
19.Liu S,Han Y,Qiao R,Zeng J,Jia Q,Wang YL,Gao MY.Investigations on the interactions between plasma proteins and magnetic iron oxide nanoparticles with different surface modifications. J Phys Chem C, 2010, 114(49):21270~21276
20.Veiseh O,Gunn JW,Zhang MQ.Design and fabrication of magnetic nanoparticles for targeted drug delivery and imaging.Adv Drug Deliv Rev,2010,62(3):284~304
21. Gao J, Hillebrenner HL. Nanotubular probes as ultrasensitive MR contrast agent.USA,20080124281,2008
22.Welo LA,Baudisch O.Thetwo-stagetransformation of magnetite into hematite. Philos Mag, 1925, 50(296):399~408
23.Massart R.Preparation of aqueous ferrofluids without using surfactant——Behavior as a function of the Ph and the counterions.Cr Acad Sci C Chim,1980,291(1):1~3
24. Bate G. Recording materials. In: Wohlfarth EP, ed.Ferromagnetic Materials.North Holland:Elsevier,1980.439
25. RockenbergerJ, ScherEC, Alivisatos AP. A new nonhydrolytic single-precursor approach to surfactant-capped nanocrystals of transition metal oxides.J Am Chem Soc,1999,121(49):11595~11596
26.Hyeon T,Lee SS,Park J,Chung Y,Na HB.Synthesis of highly crystalline and monodisperse maghemite nanocrystallites without a size-selection process.JAm Chem Soc,2001,123(51):12798~12801
27.Sun SH,Zeng H.Size-controlled synthesis of magnetite nanoparticies.J Am Chem Soc,2002,124(28):8204~-8205
28.Sun SH,Zeng H,Robinson DB,Raoux S,Rice PM,Wang SX, LiGX. Monodisperse MFe2O4(M=Fe,Co,Mn)nanoparticles.J Am Chem Soc,2004,126(1):273~279
29.Jana NR,Chen Y,Peng X.Size-and shape-controlled magnetic(Cr,Mn,Fe,Co,Ni)oxide nanocrystals via a simple and general approach.Chem Mat,2004,16(20):3931~3935
30.Park J,An KJ,Hwang YS,Park JG,Noh HJ,Kim JY,Park JH,Hwang NM,Hyeon T.Ultra-large-scale syntheses of monodisperse nanocrystals.Nat Mater,2004,3(12):891~895
31.Yu WW,Falkner JC,Yavuz CT,Colvin VL.Synthesis of monodisperse iron oxide nanocrystals by thermal decomposition of iron carboxylate salts. Chem Comm,2004,20:2306~2307
32.Shi XY,Wang SH,Swanson SD,Ge S,Cao ZY,van Antwerp ME, Landmark KJ, BakerJR. Dendrimerfunctionalized shell-crosslinked iron oxide nanoparticles for in-vivomagnetic resonance imaging of tumors.Adv Mater,2008,20(9):1671~1678
33.Tromsdorf UI,Bigall NC,Kaul MG,Bruns OT,Nikolic MS,Mollwitz B,Sperling RA,Reimer R,Hohenberg H,Parak WJ,Forster S,Beisiegel U,Adam G,Weller H.Size and surface effects on the MRI relaxivity of manganese ferrite nanoparticle contrastagents. Nano lett, 2007, 7(8):2422~2427
34.高明远,李桢.一种高结晶度的水分散磁性纳米微粒的制备方法.中国,03136275.3.2004.11.24 Gao MY,Li Z.A method for preparing a highly crystallized and water dispersible biocompatible magnetic nanocrystal.China,03136275.3.2004.11.24
35.Li Z,Chen H,Bao HB,Gao MY.One-pot reaction to synthesize water-soluble magnetite nanocrystals.Chem Mat,2004,16(8):1391~1393
36. Li Z, Sun Q, Gao MY. Preparation of water-soluble magnetite nanocrystals from hydrated ferric salts in 2-pyrrolidone:Mechanism leading to Fe3O4.Angew Chem Int Ed,2005,44(1):123~126
37.高明远,李桢.一种制备具有生物相容性的磁性纳米微粒的方法.中国,03136273.7.2003.12.10 Gao MY,Li Z.A method for preparing a biocompatible magnetic nanocrystal.China,03136273.7.2003.12.10
38. Li Z, Wei L, Gao MY, Lei H. One-pot reactionto synthesize biocompatible magnetite nanoparticles. Adv Mater,2005,17(8):1001~1005
39.Liu SJ,Jia B,Qiao RR,Yang Z,Yu ZL,Liu ZF,Liu K,Shi JY,Han OY,Wang F,Gao MY.A novel typeof dual-modality molecular probe for MR and nuclear imaging of tumor: Preparation, characterization and in vivo application.Mol Pharm,2009,6(4):1074~1082
40.Hu FQ,Li Z,Tu CF,Gao MY.Preparation of magnetite nanocrystals with surface reactive moieties by one-pot reaction.J Colloid Interface Sci,2007,311(2):469~474
41.Lu XY,Niu M,QiaoRR,GaoMY.Superdispersible PVP-coated Fe3O4nanocrystalsprepared by a "one-pot"reaction.J Phys Chem B,2008,112(46):14390~14394
42. WeisslederR, MooreA, Mahmood U, BhoradeR,Benveniste H,Chiocca EA,Basilion JP.In vivomagnetic resonance imaging of transgene expression. NatMed,2000,6:351
43.Zhao M,Beauregard DA,Loizou L,Davletov B,Brindle KM. Non-invasive detection of apoptosisusing magnetic resonance imaging and a targeted contrastagent. Nat Med,2001,7(11):1241~1244
44.Weissleder R,Bogdanov A,Neuwelt EA,Papisov M.Long-circulating iron-oxides for MR-imaging.Adv Drug Deliv Rev,1995,16(2-3):321~334
45.Bulte JWM,Douglas T,Witwer B,Zhang SC,Strable E,Lewis BK,Zywicke H,Miller B,van Gelderen P,Moskowitz BM, DuncanID, FrankJA. Magnetodendrimersallow endosomal magnetic labeling andin vivotracking of stem cells.Nat Biotechnol,2001,19(12):1141~1147
46.Lewin M,Carlesso N,Tung CH,Tang XW,Cory D,Scadden DT,Weissleder R.Tat peptide-derivatized magnetic nanoparticles allowin vivotracking and recovery of progenitor cells.Nat Biotechnol,2000,18(4):410~414
47.de Vries IJM,Lesterhuis WJ,Barentsz JO,Verdijk P,van Krieken JH,Boerman OC,Oyen WJG,Bonenkamp JJ,Boezeman JB,Adema GJ,Bulte JWM,Scheenen TWJ,Punt CJA,Heerschap A,Figdor CG.Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy.Nat Biotechnol,2005,23(11):1407~1413
48.Song HT,Choi J,Huh YM,Kim S,Jun Y,Suh JS,Cheon J. Surface modulation of magnetic nanocrystals in the development of highly efficient magnetic resonance probes for intracellular labeling.J Am Chem Soc,2005,127(28):9992~9993
49.Liu G,Wang ZY,Lu J,Xia CC,Gao FB,Gong QY,Song B,Zhao XN,Shuai XT,Chen XY,Ai H,Gu ZW.Low molecular weight alkyl-polycation wrapped magnetite nanoparticle clusters as MRI probes for stem cell labeling andin vivoimaging.Biomaterials,2011,32(2):528~537
50.Wei L,Zhou G,Li Z,He L,Gao MY,Tan JQ,Lei H.Detection of toxoplasmic lesions in mouse brain by USPIO-enhanced magnetic resonance imaging. Magn Reson Imaging,2007,25(10):1442~1448
51.Lee H,Lee E,Kim DK,Jang NK,Jeong YY,Jon S.Antibiofouling polymer-coated superparamagnetic iron oxide nanoparticles as potentialmagnetic resonance contrast agents forin vivocancer imaging.J Am Chem Soc,2006,128(22):7383~7389
52.Sharkey RM,Cardillo TM,Rossi EA,Chang CH,Karacay H,McBride WJ,Hansen HJ,Horak ID,Goldenberg DM.Signal amplification in molecular imaging by pretargeting a multivalent,bispecific antibody.Nat Med,2005,11(11):1250~1255
53.Yang LL,Mao H,Wang YA,Cao ZH,Peng XH,Wang XX,Duan HW,Ni CC,Yuan QG,Adams G,Smith MQ,Wood WC,Gao XH,NieSM.Singlechainepidermal growth factor receptor antibody conjugated nanoparticles for in vivotumor targeting and imaging.Small,2009,5(2):235~243
54.陆菁菁,王芳,金征宇,钟定荣.靶向磁性纳米粒子用于肿瘤的磁共振分子成像.中国医学科学院学报,2009,31(2):124~128 Lu JJ,Wang F,Jin ZY,Zhong DR.Targeted magnetic nanoparticles used as probe for magnetic resonance molecular imaging of tumor.Acta Acad Med Sin,2009,31(2):124~128
55.Montet X,Weissleder R,Josephson L.Imaging pancreatic cancer with a peptide-nanoparticle conjugate targeted to normalpancreas. Bioconjugate Chem, 2006, 17(4):905~911
56.Xie J,Chen K,Lee HY,Xu CJ,Hsu AR,Peng S,Chen XY,SunSH.Ultrasmall c(RGDyK)-coatedFe3O4nanoparticles and their specific targeting to integrin alpha(v)-beta(3)-rich tumor cells.J Am Chem Soc,2008,130(24):7542~7543
57.Sunderland CJ,Steiert M,Talmadge JE,Derfus AM,Barry SE. Targeted nanoparticles for detecting and treating cancer.Drug Develop Res,2006,67(1):70~93
58.Montet X,FunovicsM,Montet-Abou K,Weissleder R,Josephson L.Multivalent effects of RGD peptides obtained by nanoparticle display. J Med Chem, 2006, 49(20):6087~6093
59. Zhang CF, Jugold M, Woenne EC, LammersT,Morgenstern B,Mueller MM,Zentgraf H,Bock M,Eisenhut M,Semmler W,Kiessling F.Specific targeting of tumor angiogenesis by RGD-conjugated ultrasmall superparamagnetic iron oxide particles using a clinical 1.5-T magnetic resonance scanner.Cancer Res,2007,67(4):1555~1562
60.Sun C,Sze R,Zhang MQ.Folic acid-PEG conjugated superparamagnetic nanoparticles for targeted cellular uptake and detection by MRI.JBiomed Mater ResA,2006,78A(3):550~557
Magnetic Iron Oxide Nanoparticles and Their Applications in Magnetic Resonance Imaging
QIAO Ruirui,JIA Qiaojuan,ZENG Jianfeng,GAO Mingyuan
Institute of Chemistry,the Chinese Academy of Sciences,Beijing 100190,China
This work was supported by grants from the"973"Program(2011CB935800),the National Natural Science Foundation of China(21003135,81090271,20820102035)
Nov 26,2010 Accepted:Feb 18,2011
GAO Mingyuan,Tel:+86(10)62625212,E-mail:gaomy@iccas.ac.cn
Magnetic iron oxide nanoparticles have
great attention due to their applications as contrast agents for magnetic resonance imaging(MRI).Now,in vivoapplicationsof iron oxide nanoparticlesare gradually shifting from passive targeting mode,such as liver imaging,to active targeting mode,leading to the emerging of a new multidisciplinary field-Molecular Imaging.This review mainly discusses the synthesis of magnetic iron oxide nanoparticles and their MRI applications,especially in molecular imaging of early tumors.Key Words:Magnetic iron oxide nanoparticles;Magnetic resonance;Molecular imaging probe;Tumor
2010-11-26;接受日期:2011-02-18
“973”计划项目(2011CB935800),国家自然科学基金项目(21003135,81090271,20820102035)
高明远,电话:(010)62625212,E-mail:gaomy@iccas.ac.cn
R1,O69
10.3724/SP.J.1260.2011.00272

