珠子参醇提物对小鼠局灶性脑缺血损伤的保护作用
石孟琼,贺海波,卢训丛
珠子参(Panacis majoris rhizoma)为五加科植物珠子参植物的干燥根茎,具补肺养阴、祛瘀止痛、止血之功,主要用于气阴两虚、烦热口渴、虚劳咳嗽、跌扑损伤、关节痹痛、咳血、吐血、衄血、崩漏、外伤出血等症[1]。其化学成分主要为皂苷类(如珠子参苷、竹节参苷、人参皂苷、齐墩果酸、β-谷甾醇等),其次为多糖、倍半萜类以及人体必需微量元素(如Fe、Cu、Zn、Mn、Ni、Co、Mo等)[2]。现代药理学研究显示,珠子参具有较广泛的药理作用,对心血管系统、血液及造血系统、免疫系统、肿瘤等均有作用[3~5]。研究还发现珠子参除具有强心、保护心肌缺血再灌注损伤外,其水提物对小鼠局灶性脑缺血和缺血再灌注损伤也具有较好的保护作用[6~7]。本实验旨在此基础上进一步研究其醇提物对小鼠局灶性脑缺血的影响,为珠子参进一步研究开发和临床应用提供理论基础和实验依据。
1 材料与方法
1.1 实验动物
雄性5周龄昆明小鼠(清洁级),25~30 g,由湖北省实验动物研究中心提供(许可证号:SCXK(鄂) 2008-0005)。室温(22±1)℃,湿度(60±5)%,12 h 明暗循环, 自由饮食和饮水。
1.2 药品和试剂
珠子参购自宜昌市中医院,并经植物与天然产物湖北省重点实验室汪鋆植教授鉴定为五加科人参属植物珠子参,药材标本保存在三峡大学中药药理学三级实验室。珠子参醇提物的制备:珠子参药材烘干称重,粉碎成粗粉,加10倍量60%的乙醇溶液,浸泡2 h后,加热回流提取3次,每次3 h,合并滤液,滤过,得提取液。提取液减压回收溶剂至无醇味,浓缩至生药含量为1.0 gmL-1,4℃保存备用。
尼莫地平片(亚宝药业集团股份有限公司生产,批号090806),水合氯醛(上海化学试剂采购供应,五联化工厂提供,批号060818),2 ,3 ,5-三苯基氯化四氮唑(TTC)(美国Sigma公司生产,上海化学试剂公司进口分装,批号060710),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPX)、丙二醛(MDA)、乳酸(LD)、乳酸脱氢酶(LDH)、Na+-K+-ATP、Ca2+-Mg2+-ATP、考马斯亮蓝试剂盒(南京建成生物工程研究所),其他试剂均为市售分析纯。
1.3 实验动物分组与给药
将小鼠采用完全随机设计分组法分为5组,分别为假手术组(n=20)、模型组(n=30)、尼莫地平组(2 mgkg-1,n=30)和珠子参醇提物低、中、高剂量组(2.5, 5.0, 10.0 gkg-1,每组n=30)。珠子参和尼莫地平分别在术前7 d 开始灌胃给药,每日1次,缺血前0.5 h再给药1次。假手术组和模型组灌胃给予等量蒸馏水。
1.4 小鼠局灶性脑缺血模型复制
于末次给药0.5 h后,按照参考文献[7]叙述的方法,建立小鼠短暂性的大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)模型。以动物清醒后行动不协调、爬行时向左转圈、提尾时左前肢屈曲或作旋转运动为制模成功标志。
1.5 行为学检查
1.5.1 神经症状评分 小鼠MCAO 24 h后的神经症状参照Longa等[8]的分级法评分。0级:无症状;1级:提尾时损伤对侧前肢不能伸直;2级:向损伤侧旋转;3级:向对侧倾倒;4级:无自发活动或意识不清。1.5.2 斜板试验 依据Yonemori等[9]的方法: 将MCAO 2 h,再灌注24 h小鼠放置在一平板(25 cm×15 cm)上,待动物在平板上站稳后, 将平板从水平缓慢倾斜直至垂直, 记录小鼠在平板倾斜时跌落的最大角度, 每只动物每次重复3次, 取平均值。
1.6 梗死面积及脑含水量的测量
进行完行为学检查后,将实验动物分成2部分,一部分断头处死,取出脑,去掉嗅球、小脑和低位脑干,称湿质量。然后冠状均切4刀,共5片,将切片后的脑组织放置0.25% TTC溶液中,37℃避光孵育,每隔7~8 min翻动1次,染色30 min,10 %的福尔马林固定并经图像扫描后用Image/J 图像分析软件测量梗死面积,计算梗死脑组织百分比。
梗死脑组织百分比=梗死区面积/(梗死区面积+非梗死区面积)× 100 %
测量完梗死面积后,然后将染色后的脑组织块置入电热恒温烘箱(100±2)℃中烘干24 h至恒质量,称取干质量。脑含水量用湿质量的百分比表示。
脑含水量=(脑组织湿质量-脑组织干质量)/脑组织湿质量×100%
1.7 脑组织氧化损伤指标的测定
实验动物一部分断头处死,进行脑梗死面积和含水量的测量,另一部分在冰盘上迅速取脑,去掉嗅球、小脑和低位脑干后,用生理盐水制成10%脑组织匀浆,3000 rpmmin-1,离心15 min,取上清液,用分光光度计法测定脑组织中的SOD、GSHPX、MDA、LD、LDH、Na+-K+-ATP、Ca2+-Mg2+-ATP的含量,所有步骤严格按试剂盒说明书进行操作。
1.8 数据统计分析
数据以x¯±s表示,采用 SPSS13.0统计软件,单因素方差分析进行多组间差异的比较,Dunnett-t检验比较两组间均数的差异;神经症状评分结果用非参数Krukal-Wallis检验;缺血侧与对侧的脑体积和神经元密度比较用配对t检验;小鼠死亡率用χ2检验。
2 结果
2.1 珠子参醇提物对局灶性脑缺血小鼠成活率的影响
小鼠局灶性脑缺血小鼠成活率统计时剔除模型组栓塞大脑中动脉时颅内出血引起死亡的小鼠2只,珠子参醇提物低、中剂量组栓塞大脑中动脉时颅内出血引起死亡的小鼠1只。 假手术组成活率为100.0%(20/20),模型组小鼠成活率为60.7%(17/28),用珠子参醇提物(2.5, 5.0, 10.0gkg-1)预处理后,其成活率分别为72.4%(21/29)、79.3%(23/29)和83.3%(25/30),与模型组比较具有统计学差异(P<0.05&P<0.01),阳性药尼莫地平组的成活率为86.7%(26/30),与模型组比较极具统计学差异(P<0.01)。
2.2 珠子参水提物对局灶性脑缺血小鼠行为学的影响
与假手术组比较,模型组小鼠出现严重的神经功能散失(P<0.01),珠子参醇提物均能改善神经症状,其改善作用随剂量的增加而增强,珠子参醇提物(2.5, 5.0, 10.0 gkg-1)与模型组比较具有统计学差异(P<0.05,P<0.01);在斜板实验中,6个组的倾斜角度在MCAO术前无统计学差异(P>0.05),在MCAO 24 h后,模型组小鼠,倾斜角度显著下降,用珠子参醇提物预处理后,倾斜角度呈逐渐恢复,与模型组比较,珠子参醇提物三个剂量组均具有统计学差异(P<0.05,P<0.01),珠子参醇提物中、高剂量几乎与尼莫地平相当。结果见表1。

表1 珠子参醇提物对局灶性脑缺血小鼠神经症状、斜板实验角度的影响( x¯±s)
2.3 珠子参醇提物对小鼠局灶性脑缺血小鼠梗死面积、脑含水量的影响
同假手术组相比,模型组的梗死亡面积和脑含水量增大(P<0.01),造模成功。用珠子参醇提物预处理后,具有明显改善作用,且随剂量的增加而增强;与模型组比较,珠子参醇提物(2.5, 5.0,10.0 gkg-1)均能明显降低脑梗死面积和脑含水量(P<0.05,P<0.01)。结果见图1,表2 。

图1 小鼠脑组织切片用0.25% TTC染色,10 %的福尔马林固定后的典型照片
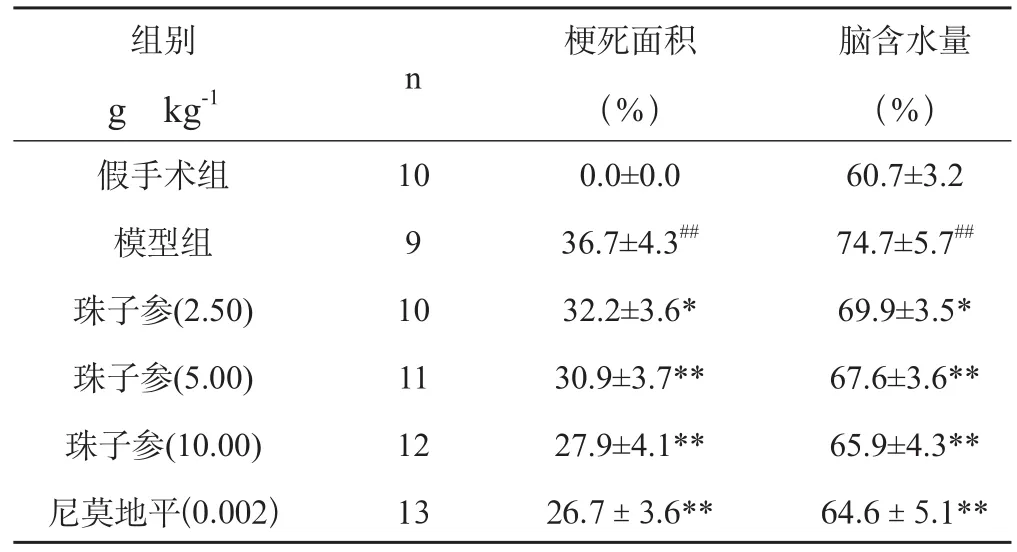
表2 珠子参醇提物对局灶性脑缺血小鼠梗死面积、脑含水量的影响( x¯±s)
2.4 珠子参醇提物对局灶性脑缺血小鼠脑组织匀浆生化指标的影响
与假手术组相比,模型组的MCAO小鼠脑组织内MDA含量显著升高、LD、LDH活性明显增强(P< 0. 01),而GSH-PX,SOD,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性明显减少(P<0. 01)。与模型组相比,珠子参醇提物高、中剂量组可使MCAO小鼠脑组织内MDA含量和LD、LDH活性显著降低(P<0.05,P<0.01),同时GSH-PX和SOD活性明显增加(P<0.05,P<0.01),显著提高Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性(P<0.05,P<0.01);而珠子参醇提物低剂量组除SOD和Ca2+-Mg2+-ATP酶与模型组相比有显著差异外(P<0.05),其余生化指标无显著影响。综合分析珠子参醇提物对局灶性脑缺血小鼠脑组织匀浆生化指标的检测结果,发现其改善作用随剂量的增加而增强,甚至高剂量组在降低MDA含量和改善GSH-PX、SOD活性方面优于尼莫地平组。与模型组相比,尼莫地平也能显著降低MCAO小鼠脑组织内MDA含量和LD、LDH的活性(P<0.01),提高GSH-PX、SOD、Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性(P<0.05,P<0.01)。结果见表 3。
表3 珠子参醇提物对局灶性脑缺血小鼠脑组织匀浆生化指标的影响(, n=8)

表3 珠子参醇提物对局灶性脑缺血小鼠脑组织匀浆生化指标的影响(, n=8)
注:与假手术组比较,#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
组别 MDA GSH-PX SOD LD LDH Na+-K+-ATP Ca2+-Mg2+-ATP(gkg-1) (nmolmg-1) (Umg-1) (Umg-1) (μgmg-1) (μgmg-1) (μgmg-1) (μgmg-1)假手术组 8.68±1.90 21.25±3.23 100.2±7.5 3.47±0.76 9.80±1.81 3.35±0.64 2.24±0.43模型组 18.80±3.88 ## 14.15±2.28 ## 77.3±7.3 ## 7.52±1.55 ## 14.46±2.99 ## 1.88±0.39 ## 1.57±0.32 ##珠子参(2.50) 15.97±2.33 15.25±2.25 83.2±5.2* 6.39±0.93 12.28±1.79 2.13±0.23 1.82±0.23*珠子参(5.00) 15.34±2.00* 18.07±3.07* 85.3±6.6* 6.13±0.80* 11.80±1.54* 2.22±0.25* 1.91±0.25**珠子参(10.00) 12.43±2.64** 18.33±3.26** 87.3±5.9** 5.41±0.65** 11.22±0.95** 2.27±0.25** 1.95±0.26**尼莫地平(0.002g/kg) 13.53±1.61** 17.09±3.02* 86.0±5.4** 4.97±1.05** 10.26±1.24** 2.49±0.53** 2.07±0.44**
3 讨论
脑血管病是临床常见病、多发病,随着社会的不断进步,人民生活水平的提高,其发病率、病死率及致残率呈逐年上升趋势,由于其起病迅速、发病率、死亡率高, 严重威胁人类健康,因而保护脑缺血损伤成为了防治和减轻其危害的重要手段。
竹节参具有较广泛的药理作用,对消化系统、中枢神经系统、心脑血管系统、免疫系统等具有广泛的药理作用[3~4,11]。我们研究发现竹节参水提物预处理对冠脉结扎诱导大鼠急性心肌缺血损伤具有较强的保护作用[6~7],结合前期珠子参水提物对小鼠局灶性脑缺血和缺血再灌注损伤均具有较好的保护作用[6~7],为了进一步观察竹节参对缺血性脑损伤的保护作用及可能的机制,我们设计了本实验。实验研究结果表明,珠子参醇提物能明显增加局灶性脑缺血小鼠成活率,并且其疗效随剂量的增加而增强,在改善脑缺血小鼠行为学方面显示出良好的疗效;在脑形态学和脑含水量的分析中,我们发现珠子参醇提物能明显减少脑缺血再灌注小鼠脑的梗死面积和降低脑含水量,显示出了对局灶性脑缺血性损伤的良好保护作用。
研究表明,脑神经功能与脑能量代谢密切相关,局部的脑缺血障碍,会使脑缺血、缺氧,引起能量代谢和离子平衡被破坏,导致脑组织损伤。而ATP酶是存在于组织细胞及细胞器(如线粒体)等生物膜上的一种逆化学梯度转运离子的蛋白酶,其中Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶与神经系统关系密切,对维持神经细胞的形态、离子浓度平衡及膜兴奋性传导等方面发挥十分重要的作用,其活性可以表示神经细胞质膜功能的状态,它对维持线粒体膜内、外H2O、Na+、Ca2+离子平衡起重要作用[12]。研究表明,当脑缺血缺氧时,细胞能量代谢障碍,一方面,使线粒体合成ATP受阻,依赖于ATP的离子泵Na+-K+-ATP酶活性降低,使得线粒体发生肿胀,而Ca2+-Mg2+-ATP酶活性降低使得线粒体内Ca2+蓄积,使胞内Na+、Ca2+排出障碍,形成恶性循环,加速细胞死亡[13~14];另一方面,由于细胞内能量不足,糖无氧代谢产生的LD增多和LDH大量释放,CO2、H+等代谢产物堆积,造成细胞内酸中毒和高渗透压,导致脑细胞水肿,组织缺血引起酸中毒,加重脑损伤。实验表明,珠子参醇提物预处理局灶性脑缺血模型小鼠能显著改善脑能量代谢,增加脑组织缺血后Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性,减少LD含量,降低神经细胞膜的通透性,使LDH活性降低,减少酸中毒的发生。
近年来,随着对自由基(H2-、H2O2、OH˙、NO及 ONOO-)研究的深入,逐渐证实了自由基的连锁反应,即氧自由基生成及脂质过氧化反应增强是脑缺血性损伤的主要机制之一[10]。大量研究表明,自由基对健康的作用具有双重性,低浓度自由基为维持健康所必须,如自由基参与细胞免疫,对于抗局部感染等具有一定的作用,在正常情况下,机体内氧自由基的产生和清除是平衡的;在脑缺血时很容易受到自由基的攻击,导致自由基大量堆积,引起脂质、蛋白质和核酸的过氧化,使膜结构遭到破坏、蛋白降解、核酸主链断裂、透明质酸解聚、细胞崩解、细胞发生不可逆改变,导致脑梗死的形成。因此,进行清除自由基的抗氧化治疗将是脑缺血性损伤的重要治疗手段之一。在实验中,我们通过分析脑组织中与氧化损伤相关的指标发现,局灶性脑缺血模型小鼠脑组织中的氧化还原系统受到明显破坏,提示小鼠行局灶性脑缺血术诱发了脑组织组织氧化损伤,实验结果也与我们前期的研究结果一致[6~7]。当脑组织缺血时产生大量的氧自由基(及OH˙),一方面,在超氧化物歧化酶的作用下生成H2O2,它又可通过Fenton反应和Haber-weiss反应生成OH-,另一方面, 与NO反应形成ONOO-,引起细胞膜脂质过氧化反应。而OH-是一种特别不稳定氧化剂,可与细胞膜脂质反应,引发细胞膜脂质过氧化连锁反应,导致膜结构遭到破坏,造成细胞死亡[15]。在实验中,实验小鼠经珠子参醇提物预防治疗后脑组织中SOD、GSH-PX酶的活性明显升高,MDA含量显著降低。通过与尼莫地平的对比分析,我们发现珠子参醇提物高剂量组在改善脑组织中GSH-PX和SOD酶活性和降低MDA含量方面优于尼莫地平组。
因此,本实验表明,珠子参醇提物可通过增强受损脑组织中ATP 酶的活性,减少酸中毒,改善脑能量代谢,通过改善受损脑组织中GSH-PX和SOD酶活性和降低MDA含量减轻缺血缺氧对脑组织的损伤,从而对局灶性脑缺血模型小鼠产生保护作用。
[1] 国家药典委员会. 中国药典(一部)[S]. 北京: 中国医药科技出版社, 2010:254.
[2] Morita, T, Kasai, R, Tanaka, O, et al. Saponins of Zu-Tziseng,rhizomes of Panax japonicus C.A. Meyer var. major (Burk.)C.Y. Wu et K.M. Feng, collected in Yunnan, China[J]. Chem.Pharm. Bull, 1982, 30 (10): 4341.
[3] Chan HH, Sun HD, Reddy MVB, et al. Potent α-glucosidase inhibitors from the roots of Panax japonicus C. A. Meyer var.major [J]. Phytochemistry, 2010, 71(11-12):1360.
[4] 赵仁,赵毅,李东明.珠子参研究进展 [J]. 中国现代中药, 2008,10(7):3.
[5] Satoh,Y,Satoh,M,Isobe,K,et al. Studies on panax acetylenes:absolute structure of a new panax acetylene, and inhibitory effects of related acetylenes on the growth of L-1210 cells[J].Chem. Pharm. Bull, 2007, 55(4):561.
[6] 石孟琼, 贺海波, 覃宁玲,等.珠子参水提物预处理对小鼠缺血再灌注损伤的影响[J].第三军医大学学报,2011,33 (3):290.
[7] 苏婧, 石孟琼, 贺海波,等.珠子参水提物对小鼠急性脑缺血损伤的影响[J]. 中国老年学杂志, 2011, 31(录用).
[8] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke, 1989, 20 (1):84.
[9] Yonemori F, Yamaguchi T, Yamada H, et al. Evaluation of a motor def i cit after chronic focal cerebral ischemia in rats [J]. J Cereb Blood Flow Metab, 1998, 18 (10):1099.
[10] 安晶晶,蒋宝泉,孙海岚,等. 富硒SOD绿茶对老龄大鼠机体抗氧化能力的影响[J]. 第三军医大学学报, 2009, 31 (7):608.
[11] Chen Tao, Hu Yueqin, Deng Lirong, et al. Effects of Polysaccharides Extracted from Zhu Zi Shen (Rhizoma Panacis Majoris) on oxidative stress and hemodynamics in the adriamycin-induced chronic congestive heart failure rat[J]. Journal of Traditional Chinese Medicine, SCI-E,2011,9.
[12] Stojanoric T, Mrsulja B. Alterat ion in synaptosmal membrane Na+, K+-ATPase of the gerbil cortex and hippocampus following reversible brain ischemia[J]. Metab Brain Dis,2003, 3 (4): 256.
[13] 张三妹,李光来. 阿米洛利对大鼠脑缺血再灌注损伤后ATP酶的影响[J].中西医结合心脑血管病杂志, 2008, 6(2):186.
[14] 王玉凤,李光来.二氮嗪对大鼠缺血再灌注损伤脑组织线粒体ATP酶活性的影响[J].中西医结合心脑血管病杂志,2011, 9 (3): 337.
[15] Warner DS, Sheng H, Batinić-Haberle I. Oxidants,antioxidants and the ischemic brain [J]. J Exp Biol, 2004,207(Pt 18):3221.

