Cu/活性炭催化剂:水合肼还原制备及催化甲醇氧化羰基化
李 忠 朱琼芳 王瑞玉 牛燕燕 郑华艳
(煤科学与技术教育部和山西省重点实验室,太原理工大学煤化工研究所,太原 030024)
Cu/活性炭催化剂:水合肼还原制备及催化甲醇氧化羰基化
李 忠*朱琼芳 王瑞玉 牛燕燕 郑华艳
(煤科学与技术教育部和山西省重点实验室,太原理工大学煤化工研究所,太原 030024)
以活性炭为载体,水合肼为还原剂制备了负载型Cu/活性炭催化剂,考察了水合肼/硝酸铜物质的量的比对催化甲醇气相氧化羰基化性能的影响,并采用XRD、XPS、H2-TPR和SEM等手段对催化剂进行了表征。结果表明,不加入还原剂水合肼时,催化剂中仅有CuO;随着水合肼/硝酸铜物质的量的比的增加,二价铜逐步被还原为Cu2O和/或单质Cu0,未被还原的Cu(OH)2在催化剂干燥过程中分解形成分散态CuO存在于催化剂表面。当水合肼/硝酸铜物质的量的比为0.75时,催化剂的催化性能最好,碳酸二甲酯的时空收率为120.62 mg·(g·h)-1,选择性为74.51%,甲醇转化率达到3.88%。在93 h反应时间内,催化剂都保持了较高的反应活性和选择性。此时铜物种以Cu2O和分散态CuO为主,Cu2O是主要的活性物种。
Cu/活性炭;水合肼;氧化羰基化;碳酸二甲酯
CuCl2/AC(活性炭)和CuCl2-PdCl2/AC是甲醇气相氧化羰基化合成碳酸二甲酯 (DMC)的重要催化剂[1-3]。该催化剂使用金属氯化物作为前驱物,催化剂中含有大量的Cl-,在催化反应中Cl-易于形成HCl而流失,导致催化剂失活和严重的腐蚀设备。采用固体离子交换制备的Cu/分子筛催化剂[4]和浆液浸渍法制备的负载型Cu2(OH)3Cl/AC[5]催化剂大幅降低了催化剂中Cl-含量,但仍保持较好的催化活性。King等[6-7]在650℃下热处理Cu2O和HY分子筛的物理混合物,制备的无氯Cu2O/HY催化剂也表现出较好的初始催化活性。
Richter等[4]发现分散在Y型分子筛上的CuO几乎没有催化活性,但高温活化后自还原产生的Cu+具有甲醇氧化羰基化催化活性。我们的前期工作[8-9]表明,活性炭表面负载单一组分Cu2O催化剂具有较好的甲醇氧化羰基化催化活性。已有文献[10-11]研究表明,水合肼还原二价铜盐能够制备出多种形貌和价态的铜氧化物,因此,采用水合肼还原制备Cu/AC催化剂有利于深入研究催化活性中心,从而提高催化活性。本工作先将Cu(NO3)2浸渍在AC上,通过改变还原剂水合肼与硝酸铜物质的量的比,制备出含有CuO、Cu2O和单质Cu0的催化剂,并进一步研究甲醇气相氧化羰基化合成DMC催化活性物质的结构和性质。
1 实验部分
1.1 催化剂的制备
将 2.5 g AC(椰壳 AC,福建,筛分为 177~250 μm(60~80 目))搅拌浸渍于 18 mL 0.2 mol·L-1的Cu(NO3)2·3H2O(A.R.,天津市科密欧化学试剂有限公司)的水溶液中,6 h后于98℃下干燥12 h制得催化剂前躯体Cu(NO3)2·3H2O/AC。在室温下快速加入一定体积的 0.2 mol·L-1的 NaOH(A.R.,天津市科密欧化学试剂有限公司)水溶液,搅拌10 min,再加入一定体积的0.2 mol·L-1水合肼 (天津化学试剂三厂,分析纯)水溶液,反应1 h后,过滤洗涤,在80℃下干燥12 h,冷却,即得制备的催化剂,标记为Cu/AC-x,其中x为水合肼/硝酸铜的物质的量的比,分别为 0.25,0.5,0.75,1,1.5,2。Cu(NO3)2·3H2O/AC 中加入过量NaOH水溶液,过滤洗涤后在140℃下干燥12 h制得CuO/AC催化剂,标记为Cu/AC-0。
1.2 催化剂的表征
催化剂的X射线衍射(XRD)测定在日本Rigaku D/Max 2500型X射线衍射仪上进行,实验条件为:Cu Kα 射线(经 Kα2 剥离处理,λ=0.15406 nm)为辐射源,石墨单色器,靶电压40 kV,靶电流30 mA,扫描速率 8°·min-1,扫描范围 5°~80°,步长 0.01°,闪烁计数器记录强度。催化剂形貌由日本JSM-6700F扫描电子显微镜(SEM)观测,加速电压为20 kV,发射电流为95 mA。催化剂中的Cu元素测定采用VARIAN公司的AA240FS型号原子吸收分光光度仪(AAS)进行。程序升温还原(H2-TPR)实验在美国Micromeritics公司AutochemⅡ2920型全自动程序升温化学吸附仪上进行,催化剂用量20 mg,将样品置于U型石英反应管中,N2气氛,流速50 mL·min-1,以10℃·min-1的升温速率升温至150℃,恒温吹扫30 min,降温至 50 ℃,切换 VH2∶VAr=10∶90 混合气体,恒速 40 mL·min-1,系统稳定后,以 10 ℃·min-1的速率升温至450℃,氢消耗信号用热导池检测器(TCD)检测。X射线光电子能谱 (XPS)和俄歇电子能谱(AES)实验采用英国VG Scientific公司ESCAL-ab 220i-XL型光电子能谱仪分析,激发源为Al Kα X射线,功率约为300 W。分析时的基础真空为3×10-4Pa,电子结合能用污染碳的 C1s 峰(284.6 eV)作为内标校正。
1.3 催化反应性能评价
催化剂的活性评价在固定床不锈钢管反应器(φ 16 mm×400 mm,北京昆仑永泰科技有限公司)中进行,甲醇由微量进样泵(SeriesⅡ Pump,Scientific Systems,Inc.,LabAlliance)引入,随着 CO 和 O2两路气体混合进入汽化室,在汽化室内汽化混合后一起进入反应器,流过催化剂床层,反应后的混合物经气液分离器分离,液相混合物经称量后用气相色谱(Agilent HP-6890N气相色谱)分析。在标准状态下,原料气 CO和 O2流速分别为 5.0 mL·min-1和 55 mL·min-1,甲醇进料速度 0.05 mL·min-1,催化剂用量 0.8 g,反应温度 130 ℃,反应压力 0.5 MPa,反应时间9 h。液相混合物中的甲醇,DMC,甲酸甲酯,二甲氧基甲烷用毛细管柱HP-INNO-WAX柱 (30 m×530 μm×1 μm)分离,氢火焰离子化检测器(FID)检测。色谱的基本分析条件为:进样口温度200℃;柱温恒温80℃;FID温度300℃,分流比为50∶1;高纯He(99.999%)为载气,流速 3.0 mL·min-1。
2 结果与讨论
2.1 催化剂的活性及稳定性测试
将不同水合肼/硝酸铜物质的量的比制备的催化剂用于甲醇气相氧化羰基化合成DMC反应9 h,其DMC的时空收率(STYDMC)、选择性(SDMC)和甲醇转化率(XMeOH)的平均值如表1所示。可以看出:不加入还原剂时,催化剂Cu/AC-0对DMC的SDMC、STYDMC以及XMeOH都很低;随着还原剂水合肼的加入,水合肼/硝酸铜物质的量的比逐渐增大,DMC的SDMC、STYDMC和XMeOH逐渐增加,当水合肼/硝酸铜物质的量的比为 0.75(Cu/AC-0.75)时都达到最大,分别为74.51%、120.62 mg·(g·h)-1和 3.88%;当水合肼/硝酸铜物质的量的比在0.25~1区间时,催化剂(Cu/AC-0.25,Cu/AC-0.5,Cu/AC-0.75,Cu/AC-1) 活性都比较高,STYDMC均在 109 mg·(g·h)-1以上。随着水合肼/硝酸铜物质的量的比继续增加时,催化剂活性急剧降低,Cu/AC-2 的 STYDMC只有 66.73 mg·(g·h)-1, 为最高活性时的55%,与Cu/AC-0活性相当。可见,在制备催化剂过程中,还原剂水合肼的加入量对Cu/AC催化的活性影响较大。

表1水合肼/硝酸铜物质的量的比对催化剂催化性能的影响Table 1 Effect of the molar ratio of hydrazine hydrate to copper nitrate on catalytic activity
在催化甲醇气相氧化羰基化合成DMC中,活性较好的催化剂Cu/AC-0.75的稳定性考察结果如图1所示。可以看出,在反应初始阶段,催化剂活性上升,进行到 21 h 时,STYDMC达到最高为 124.3 mg·(g·h)-1。随着反应时间的延长,催化剂活性逐渐降低,当反应进行到93 h时,STYDMC降低至93.1 mg·(g·h)-1,约为活性最高时的75%。在催化反应过程中,SDMC随着反应时间增加而持续增大,由起始的75%增加到80%。

图1 催化性能随反应时间的变化曲线Fig.1 Catalytic performance vs time-on-stream
2.2 催化剂的XRD表征
图2为用不同水合肼/硝酸铜物质的量的比制备催化剂的XRD图。在制备催化剂时,加入过量的NaOH碱液时产生Cu(OH)2,使得催化剂Cu/AC-0上形成CuO,由XRD图(a)可见催化剂只有CuO的特征衍射峰[10],并且CuO衍射峰强度低、峰又宽,表明CuO粒子的相对结晶度低和平均粒径小,表明CuO在载体表面的分散性较好。催化剂制备过程中,一定的NaOH碱液有利于水合肼还原Cu2+[12],但也能形成碱式硝酸铜(Cu2(NO3)(OH)3)[13]。当还原剂水合肼加入量较少时,即水合肼/硝酸铜物质的量的比为0.25时,制备的催化剂Cu/AC-0.25中CuO的特征衍射峰基本消失,但出现了明显的Cu2(NO3)(OH)3[13]和Cu2O的特征衍射峰[11],表明催化剂中有部分Cu2+还原为Cu2O。继续增加水合肼的量,当水合肼/硝酸铜物质的量的比在 0.5~1 区间, 催化剂(Cu/AC-0.5,Cu/AC-0.75,Cu/AC-1)的 XRD 图上以 Cu2O 的特征衍射峰为主,并且随着还原剂量的增加,催化剂上还出现了较弱的单质Cu0的特征衍射峰[11]。随着还原剂量的继续增加,Cu2O的特征衍射峰变弱而单质Cu0的特征衍射峰增强。当水合肼/硝酸铜物质的量的比为2时,催化剂上已经观察不到Cu2O的特征衍射峰,只能看到明显的单质Cu0的特征衍射峰。表明随着水合肼/硝酸铜物质的量的比增加,催化剂中 Cu2+物种被还原成 Cu+和/或Cu0。

图2 不同催化剂的XRD图Fig.2 XRD patterns of catalysts
2.3 催化剂的XPS及AES表征
不同水合肼/硝酸铜物质的量的比制备催化剂的Cu2p XPS谱图(A)及Cu2p3/2高斯拟合图(B)如图3所示,其中结合能位于933.9 eV附近的为Cu2+的结合能,932.4 eV附近的为Cu+或Cu0的结合能。在催化剂的XPS谱图上都有明显的Cu2+物种的卫星伴峰,并且在933.9 eV附近有能谱峰,说明催化剂表面都存在Cu2+物种。由图3(B)可知,催化剂Cu/AC-0只有Cu2+,没有Cu+/Cu0,而水合肼还原制备的催 化 剂 Cu/AC-0.5,Cu/AC-0.75 和 Cu/AC-2 除 Cu2+外,还含有Cu+/Cu0。随着水合肼/硝酸铜物质的量的比的增加,催化剂中Cu2+的Cu2p3/2电子结合能由933.90 eV 逐步变化为 934.49 eV, 并且 Cu2+物种的百分含量逐渐减低, 分别为 63.92%、53.61%和42.79%。催化剂中Cu2+结合能的增大是由于表面CuO的量减少导致的[14]。

图3 催化剂的XPS谱图(A)及其高斯拟合图(B)Fig.3 XPS spectra(A)and Gaussian fitting figures(B)of catalysts
Cu+和Cu0的XPS电子结合能很接近,借助AES谱图可以区分[15],图4为催化剂的Cu LMM AES谱图及高斯拟合图。催化剂Cu/AC-0的Cu LMM俄歇峰只出现在917.37 eV,归属于CuO[16]。当水合肼/硝酸铜物质的量的比为 0.5、0.75 和 2 时,催化剂的AES谱图拟合为位于916.5 eV处Cu+物种和 918.10 eV附近的Cu0物种的 2个峰, 且 916.5 eV处峰面积较大,说明催化剂Cu/AC-0.5、Cu/AC-0.75和Cu/AC-2表面低价铜以Cu2O为主。
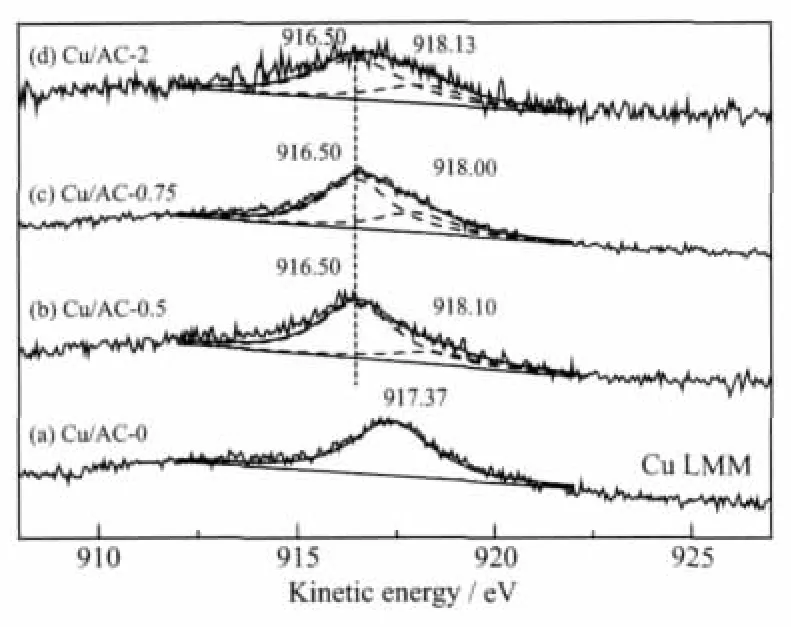
图4 催化剂的Cu LMM AES谱图Fig.4 Cu LMM AES spectra of catalysts
表2为催化剂Cu2p3/2和Cu LMM AES能谱曲线拟合的数据分析结果。由表2中各种价态铜的面积百分含量可知,当水合肼/硝酸铜物质的量的比逐渐增大时,催化剂表面的Cu2+逐渐减少而Cu+和Cu0逐渐增多,且始终是 Cu2+>Cu+>Cu0。XRD 分析得出催化剂 Cu/AC-0.5和 Cu/AC-0.75中晶相铜物种主要以Cu2O和Cu0形式存在,Cu/AC-2中晶相铜物种主要以Cu0形式存在,也可能是由于CuO被还原为单质Cu时,金属-载体间的强相互作用导致部分Cu2O和Cu迁移到载体内部,被AC包围并以体相Cu2O和Cu0形式存在[17-18]。催化剂表面分散态CuO是由催化剂制备过程中产生的Cu(OH)2在催化剂干燥过程中分解形成的。
表3为催化剂铜元素含量分析结果。原子吸收光谱的结果表明催化剂铜元素含量随着水合肼量的增加而增加,而基于XPS的分析结果则表明,催化剂表面Cu含量先增加后降低。表明随着水合肼量的增加,催化剂中表面Cu物种逐渐减少。催化剂Cu/AC-2表面Cu含量仅为催化剂整体Cu含量的48%,表明Cu/AC-2催化剂中单质Cu0主要存在于体相中,被AC载体包围,其表面存在少量高度分散的Cu2+。Cu/AC-0.75表面铜含量较高,这也是其催化活性较高的原因。

表2 催化剂的Cu2p3/2和Cu LMM AES曲线拟合结果分析Table 2 Cu2p3/2XPS and Cu LMM AES curve-fitting analysis of catalysts

表3 催化剂中铜元素含量分析结果Table 3 Copper content analysis of catalysts
2.4 H2-TPR表征
不同水合肼/硝酸铜物质的量的比制备催化剂的H2-TPR图及高斯拟合图如图5所示。表4为催化剂H2-TPR中氢气消耗峰面积的数据分析结果。催化剂中分散态物相较易还原,结晶态物相较难还原[19-20],因此认为Cu/AC-0中158.8℃的低温还原峰为分散态CuO的还原峰,而182.5℃的高温还原峰为结晶态CuO的还原峰。由谱图可见,除了Cu/AC-2,其它催化剂中均有2个氢气消耗峰:α峰 (161~167℃)和 β峰(201~212℃)。 随着水合肼/硝酸铜物质的量的比的增加,α和β 2个峰的耗氢量都逐渐减少,并且α峰向高温方向移动,β峰向低温方向移动。其中,α峰与催化剂Cu/AC-0的分散态CuO还原温度接近,将该峰归属于分散态CuO的还原峰。催化剂 Cu/AC-0.5,Cu/AC-0.75,Cu/AC-1 中均有 Cu2O存在,因此将β峰归属于Cu2O的还原峰。随着水合肼量的增加,2种铜物种的量都逐渐减少,使得分散态CuO与载体之间结合更紧密,而Cu2O之间的相互作用减弱,故还原峰α温度逐渐升高,而还原峰β温度逐渐降低[20]。

图5 催化剂的H2-TPR图Fig.5 H2-TPR profiles of catalysts

表4 催化剂的H2-TPR分析结果Table 4 H2-TPR analysis of catalysts
由表4可以看出,不加还原剂时,由于催化剂中只有CuO物种,催化剂的还原峰强度很大,耗氢量基本等于 CuO 的理论耗氢量(30.02 cm3·g-1)。当水合肼/硝酸铜物质的量的比在0.5~1范围时,单位质量催化剂的耗氢量变化不大,但是比Cu2O的理论耗氢量(15.17 cm3·g-1)要大的多,这说明催化剂 Cu/AC-0.5、Cu/AC-0.75 和 Cu/AC-1 不仅含有 Cu2O,还存在大量分散态CuO,XPS表征证明了这点。
2.5 催化剂的SEM表征
不同水合肼/硝酸铜物质的量的比制备催化剂的SEM图如图6所示。SEM给出了催化剂活性组分的分散性及其在载体表面的形貌。当不加入水合肼时,CuO很好地分散在载体表面,其形貌大小不规则。Cu2O形貌多样,改变制备方法和制备条件可以获得不同形貌的Cu2O颗粒[10,12,21],作者在水合肼/硝酸铜物质的量的比为0.5和0.75时制备的催化剂中Cu2O主要以球形颗粒存在。当水合肼/硝酸铜物质的量的比为0.75时,Cu2O粒径大约为0.3 μm,呈球形颗粒,分布均匀,粒径大小均一,并且很好的分散在载体表面,此时催化剂活性最好。

图6 催化剂的SEM图Fig.6 SEM images of catalysts
由图可见,催化剂Cu/AC-0.75表面铜含量最高,加入过量或少量还原剂制备的催化剂Cu/AC-0.5或Cu/AC-2表面铜含量均较低,尤其是Cu/AC-2表面铜含量很低,这也证实了对催化剂Cu/AC-2中单质Cu迁移到载体内部以体相Cu0形式存在的推测。
2.6 催化剂形成过程分析
在水合肼还原Cu(OH)2的过程中,Cu(OH)2溶解产生Cu2+离子的过程是反应的控制步骤[10]。制备催化剂时,先用等物质的量的Cu(NO3)2和NaOH反应,一部分Cu2+沉淀形成Cu(OH)2分散在载体AC表面,另一部分Cu2+以离子形式存在,如方程(1)所示;当加入水合肼时,溶液中Cu2+离子先被还原为Cu+,Cu+逐渐沉淀聚集形成 Cu2O,如方程(2)和(3)所示;随着水合肼量继续增加,Cu+被进一步还原为单质Cu0,如方程式(4)所示[11]。随着水合肼量的增加,Cu2+被还原,方程式(1)平衡向左移动,Cu(OH)2逐渐水解,然后还原。未被还原的Cu(OH)2通过干燥过程分解成CuO分散在催化剂表面。因此,未加入水合肼制备的催化剂中只有CuO物种。加入水合肼还原后,催化剂中存在CuO、Cu2O和Cu物种,随着水合肼量的增加,催化剂中CuO不断减少,Cu2O和Cu的量有所增加。

还原剂水合肼量对催化剂的活性组分和催化性能影响很大。液相还原法制备的各催化剂表面均有分散态CuO存在。未加水合肼时,催化剂Cu/AC-0中活性物种为CuO,其时空收率仅为68.14 mg·(g·h)-1;随着水合肼/硝酸铜物质的量的比的增加,各催化剂活性逐渐增加,催化剂Cu/AC-0.5、Cu/AC-0.75和Cu/AC-1的时空收率均达到了115 mg·(g·h)-1以上,此时催化剂中铜物种都以Cu2O和分散态CuO为主;水合肼/硝酸铜物质的量的比继续增加,催化剂活性急剧降低,Cu/AC-2的时空收率仅为最高活性时的55%,催化剂中活性组分以单质Cu0为主。Cu2O含量较高的催化剂比纯CuO或单质Cu0较多的催化剂催化活性都高,因此Cu2+经适度还原产生的Cu2O比CuO和单质Cu具有更好的催化性能。
表5给出了各催化剂表面中各种价态Cu的含量 (利用表2中各种价态Cu的百分含量计算),Cu/AC-0.75表面Cu+最高为2.99%。催化剂Cu/AC-0.75的XMeOH、STYDMC和SDMC最大,表面高含量、分散均匀、形貌规则、粒径大小均一的Cu2O是该催化剂活性较高的原因。
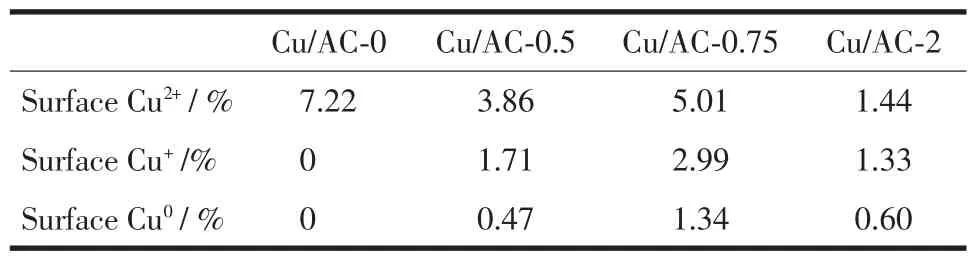
表5 催化剂表面各价态铜含量分析结果Table 5 Surface copper content analysis of catalysts①
3 结 论
以水合肼为还原剂将二价铜(Cu(NO3)2·3H2O/AC)适度还原制备的催化剂具有较好的催化活性,过度还原制备的催化剂活性降低。不加入还原剂时,催化剂中只有CuO物种,随着水合肼/硝酸铜物质的量的比增加,Cu2+被还原为Cu2O和/或单质Cu0,当水合肼/硝酸铜物质的量的比为0.75时,催化剂Cu/AC-0.75活性最高,此时催化剂中铜物种以Cu2O和分散态CuO为主。Cu2O是主要的活性物种,催化剂Cu/AC-0.75中高含量、分散均匀、形貌规则、粒径大小均一的Cu2O是催化剂活性较高的原因。
[1]Han M S,Lee B G,Ahn B S,et al.Appl.Surf.Sci.,2003,211(1/2/3/4):76-81
[2]YANG Ping(杨平).Thesis for the Doctorate of FudanUniversity(复旦大学博士论文).2003.
[3]Li Z,Xie K C,Slade R C T.Appl.Catal.A,2001,205(1/2):85-92
[4]Richter M,Fait M J G,Eckelt R,et al.J.Catal.,2007,245(1):11-24
[5]WANG Rui-Yu(王瑞玉),LI Zhong(李忠),ZHENG Hua-Yan(郑华艳),et al.Chin.J.Catal.(Cuihua Xuebao),2009,30(10):1068-1072
[6]King S T.Catal.Today,1997,33(1/2/3):173-182
[7]King S T.J.Catal.,1996,161:530-538
[8]LI Zhong(李忠),WEN Chun-Mei(文春梅),ZHENG Hua-Yan(郑华艳),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2010,31(1):145-152
[9]LI Zhong(李忠),WEN Chun-Mei(文春梅),WANG Rui-Yu(王瑞玉),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2009,30(10):2024-2031
[10]Muramatsu A,Sugimoto T.J.Colloid Interf.Sci.,1997,189(1):167-173
[11]Xiang J Y,Tu J P,Yuan Y F,et al.Electrochem.Commun.,2009,11(2):262-265
[12]ZHU Jun-Wu(朱俊武),CHEN Hai-Qun(陈海群),XIE Bo(谢波),et al.Chin.J.Catal.(Cuihua Xuebao),2004,25(8):637-640
[13]Henrist C,Traina K,Hubert C,et al.J.Cryst.Growth,2003,254(1/2):176-187
[14]Huang L,Peng F,Yu H,et al.Solid State Sci.,2009,11(1):129-138
[15]SHI Qiu-Jie(石秋杰),LIU Ning(刘宁),LIANG Yi(梁义).Chin.J.Catal.(Cuihua Xuebao),2007,28(1):57-61
[16]Zhang Y,Tang J,Wang G,et al.J.Cryst.Growth,2006,294(2):278-282
[17]Wang L C,He L,Liu Y M,et al.J.Catal.,2009,264(2):145-153
[18]Guczi L,Horvath D,Paszti Z,et al.J.Phys.Chem.B,2000,104(14):3183-3193
[19]Luo M F,Fang P,He M,et al.J.Mol.Catal.A:Chem.,2005,239(1/2):243-248
[20]ZHANG Li-Ping(张丽萍),WAN Hai-Qin(万海勤),ZHU Jie(朱捷),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(3):427-431
[21]Dong Y,Li Y,Wang C,et al.J.Colloid Interf.Sci.,2001,243(1):85-89
Cu Supported on Activated Carbon Catalyst Prepared by Hydrazine Hydrate Reduction for Catalyzing Oxidative Carbonylation of Methanol
LI Zhong*ZHU Qiong-Fang WANG Rui-Yu NIU Yan-Yan ZHENG Hua-Yan
(Key Laboratory of Coal Science and Technology,Education Ministry and Shanxi Province,Taiyuan University of Technology,Taiyuan 030024,China)
The Cu/activated carbon(AC)catalyst was prepared by hydrazine hydrate reduction for catalyzing oxidative carbonylation of methanol to dimethyl carbonate (DMC).The effects of the molar ratio of hydrazine hydrate to copper nitrate on the catalytic properties were investigated,and the catalyst was characterized by X-ray diffraction,scanning electron microscopy,X-ray photoelectron spectroscopy,temperature-programmed reduction.The results show that Cu2+is gradually reduced to Cu2O and/or Cu0with increasing the molar ratio of hydrazine hydrate to copper nitrate.During drying process of the catalyst,the unreduced Cu(OH)2decomposed to CuO and highly dispersed on the surface of AC.When the molar ratio of hydrazine hydrate to copper nitrate was 0.75,the catalytic activity for oxidative carbonylation of methanol was the highest,the space-time yield of DMC,selectivity of DMC and conversion of methanol reached 120.62 mg·g-1·h-1,74.5%and 3.88%,respectively,and the activity and selectivity had maintained during 93 h running time.Cu2O and dispersed CuO were proved as main copper species,and Cu2O as main catalytic active centre.
Cu/activated carbon;hydrazine hydrate;oxidative carbonylation;dimethyl carbonate
O643.36
:A
:1001-4861(2011)04-0718-07
2010-10-25。收修改稿日期:2010-12-08。
国家自然科学基金(No.20976113,20936003)资助项目。
*通讯联系人。 E-mail:lizhong@tyut.edu.cn,Tel:(0351)6018526

