FeCl3-NiCl2石墨层间化合物光催化性能初探
曹 宏,王胜军,黎安金,薛 俊,陈理强
(武汉工程大学材料科学与工程学院,湖北 武汉 430073)
FeCl3-NiCl2石墨层间化合物光催化性能初探
曹 宏,王胜军,黎安金,薛 俊,陈理强
(武汉工程大学材料科学与工程学院,湖北 武汉 430073)
石墨层间化合物是一个近似的二维物理系统,人们对其独特的电学和磁学性质已开展广泛研究,但尚未见到有光催化活性方面报道。本文采用混合加热法制备了多种阶结构的FeCl3-NiCl2石墨层间化合物。将其添加到甲基蓝溶液中,通过紫外光辐照、阳光辐照和暗箱放置等试验发现所合成的石墨层间化合物具有光催化活性,且混合阶结构的样品光催化活性更高。
石墨层间化合物;光催化;甲基蓝;降解
1 引言
1972年日本东京大学Fujishima[1]发现在紫外光照射下TiO2电极能够光催化分解水,开创了光催化研究的新纪元。1976年Carey[2]发现水中的有机污染物--联苯和氧化联苯能够被光催化氧化分解,进一步促进了光催化研究的发展。其后,多相光催化的研究出现了空前繁荣[3],每年世界发表的相关论文数以万计。除锐钛矿型纳米TiO2[4-5]及其掺杂化合物[6]一直是最为炙手可热的光触媒之外,又发展了许多其他类型半导体光催化剂,主要有硫化物[7]、复合氧化物[8]、钙钛矿型化合物[9]和层状结构铌酸盐[10]等。
石墨层间化合物(Graphite Intercalation Compounds简称GICs)是将异类分子、原子、离子、粒子插入到石墨结构层间形成的纳米尺度复合材料[11]。过渡金属氯化物石墨层间化合物是其中重要的一类,具有受主型电子结构[12]。由于石墨层间化合物中插入物受到上下石墨结构层的控制,是一种比较典型的二维物理系统。因此,人们对氯化物石墨层间化合
物的各种性能,特别是电学性能[13-14]和磁学性能[15-16]开展了广泛研究。但在众多石墨层间化合物的研究文献中,没有发现其具有光催化活性的报道。本文以所合成的FeCl3-NiCl2石墨层间化合物(简称FeCl3-NiCl2GICs)为触媒,通过降解甲基蓝溶液试验发现该石墨层间化合物具有光催化性能,且初步探讨了阶结构对光催化性能的影响。
2 试验
FeCl3-NiCl2GICs合成与表征:将NiCl2·6H2O(天津市福晨化学试剂厂,AR级)在150℃烘干10h除去结晶水,得到粉状NiCl2备用;按照表1配比称量鳞片石墨(内蒙兴和县信义石墨有限责任公司,碳含量≥99%,100目)、FeCl3(上海精化科技研究所,AR级)和前述除掉结晶水的NiCl2装入陶瓷反应罐,混匀、抽真空、充氮气,如此反复5次以上,保证反应罐内为N2气氛,密封;置于马弗炉中,按表1中的试验条件升温至给定温度,保温、停火,自然冷却至室温;取出反应物用去离子水清洗3次以上,直至洗液无色;80℃烘干就得到了FeCl3-NiCl2石墨层间化合物样品。用X-射线衍射(XRD,日本岛津XD-5A,CuKα辐射,30kV×20mA)测定了所制备样品的阶结构;在扫描电镜(SEM,日本电子JSM-5510LV)下观察了所制备样品的形貌,并用附带的能谱仪(EDS,美国EDAX,FALCON)分析了样品的化学组成。进行EDS分析时,每一样品至少测试了5个以上点位,最后以各点的平均值结合插入率数据计算所合成产物的化学式。
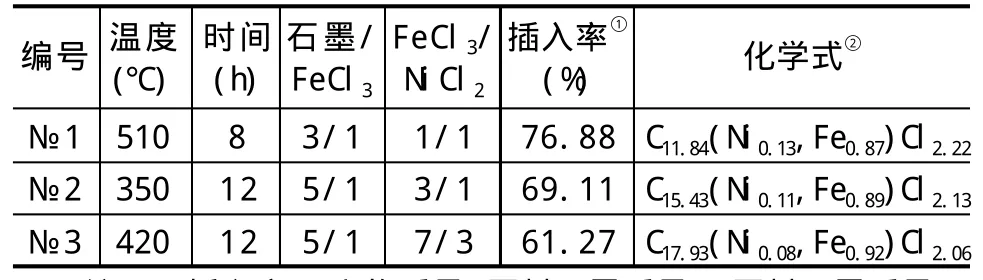
表1 NiCl2-FeCl3GICs制备条件及表征
甲基蓝降解试验:准备5只50mL烧杯,在每只烧杯中装入20mL初始浓度为8mg/L的甲基蓝溶液,放入所合成的FeCl3-NiCl2GICs样品0.05g。将所有烧杯置于一个只有紫外灯照射的通风黑箱中辐照,每间隔一定时间取样,离心后测试上层清液浓度,从而判断甲基蓝的降解情况。紫外光照射条件为:波长254nm,辐照强度约2W/m2(TN-UV254型数字式紫外辐射照度计测试,金坛市泰纳仪器厂)。甲基蓝浓度测试方法为分光光度法,测试仪器为UV755B型紫外可见分光光度计,特征吸收波长为605nm,空白参比为去离子水。试验测得的标准曲线为:

式中:A为特征吸收波长下的吸光度;C为甲基蓝溶液浓度,mg/L;拟合直线的相关度R=0.998 4。在测得各时刻甲基蓝浓度后,按下式计算降解率:

式中:α为降解率,%;C0为初始浓度,mg/L;Ct为t 时刻浓度,mg/L。
3 结果与讨论
3.1 FeCl3-NiCl2GICs表征
石墨层间化合物最典型的结构特征是具有阶结构(stage structure)。在GICs中若每间隔1层六角形石墨碳网有1层插入物时为1阶,若每隔2层碳网有1层插入物时为2阶,依次类推。因此GICs沿c 轴方向的面网间距dGIC为基本厚度di和间隔的碳网厚度之和,即:


式中:di为插入物厚度与单层石墨碳网的厚度之和;n为GICs的阶数;dG为石墨结构层的厚度,理论值为利用(3)式分析所合成样品的XRD图谱(图1)可知,所制备的样品均为石墨层间化合物,基本没有石墨残留,且样品№1为纯2阶(stage 2),№2为纯3阶(stage 3),№3为2阶和3阶的混合物(stage 3+stage 2),以3阶为主。从表1中的插入率数据看,№1插入率最高,№2次之,№3最少,这与样品的阶数排列不完全一致。实际上GICs的阶本质上是一种畴[17],因此插入率与阶数之间并没有完全对应的关系。所合成样品的SEM观察表明(图2b),GICs保持了原料石墨的鳞片形态,但部分有些卷曲。图2a和表1给出了样品的EDS成分分析结果,从计算得到的化学式看,所制备GICs为非化学计量比化合物。插入物中若Fe为+3价,Ni为+2价,则表现为缺少Cl-,即存在Cl-离子空位。实际情况应该是即存在阴离子空位,也存在阳离子空位。

3.2 甲基蓝在紫外光照射下的降解
表2给出了紫外光照射下不同时间甲基蓝溶液的浓度测试结果。所有添加了GICs的溶液在紫外光辐照150min后,浓度均由初始8mg/L降到了2mg/L以下,说明甲基蓝发生了明显的分解。表2中的空白是没有添加GICs的对照溶液,在紫外线照射下浓度也有所下降,但下降幅度远低于试验组。
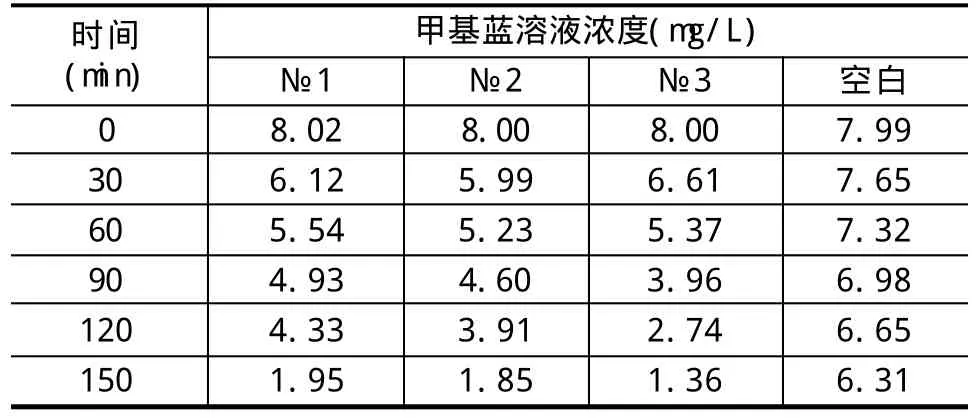
表2 紫外光照射下不同时间的甲基蓝溶液浓度

图3是紫外光照射下甲基蓝降解率随时间的变化曲线,图中的降解率是扣除了空白之后的净值。随着时间延长降解率提高,60min以前№1、№2降解率较高,60min以后为№3最高。在150min时,№1、№2、№3的净降解率分别为54.33%、55.75%和61.87%,与合成GICs时的插入率排序正好相反(表1)。从阶结构看,混合阶GICs样品(№3)的降解率最高。此时,未添加GICs的溶液其降解率为21.03%,而添加了№3样品的总降解率为83.04%,即绝大多数甲基蓝都发生了分解。降解率的这一数据与TiO2光触媒的典型降解效果相比仍然略低[18]。
3.3 甲基蓝在阳光下和暗室中的降解
为了探讨添加GICs的甲基蓝溶液是否只是在紫外光照射下才发生降解,按照紫外照射相同的试验条件,将添加了GICs样品的甲基蓝溶液放置在阳光下、放置在完全无光的黑箱中定时取样用分光光度法测试浓度。阳光照射试验在武汉七月的晴好天气进行,试验时为了避免室外紫外线影响和防止挥发,先用塑料薄膜把烧杯包裹,再用玻璃片盖住烧杯口,然后才进行阳光照射。暗室试验时,也用塑料薄膜包裹烧杯,然后放入用两层遮光布覆盖了的聚氨酯泡沫箱,试验时间也是七月。

从阳光照射下甲基蓝溶液降解率随时间变化的曲线(图4)可以看到,随着时间延长甲基蓝溶液浓度不断降低。其中,添加了№1,№2的溶液其降解过程基本相同,降解率均低于添加了№3的溶液。在150min时,添加了№1、№2和№3的降解率分别为6.34%、6.56%、10.73%,均低于紫外光照射下同一时刻添加了同种GICs的降解率,也低于没有添加GICs但经紫外线照射的溶液。由此说明两点:①在紫外线照射下GICs确实起到了光触媒的作用,提高了甲基蓝溶液的降解率;②尽管在可见光照射下甲基蓝的降解率远低于紫外光照射时,但降解仍是存在的。
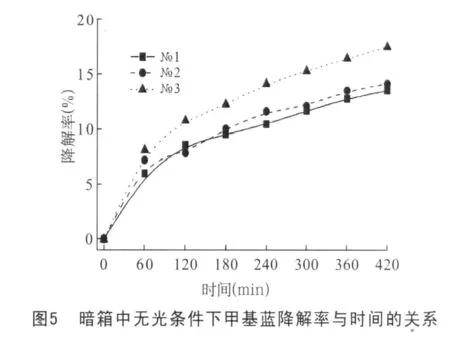
图5是暗箱中无光条件下添加GICs后甲基蓝溶液浓度变化率与时间的关系曲线。从图5可以看到,在无光条件下甲基蓝的降解与可见光照射下基本一致,也是添加了№1,№2的降解率基本相同,添加了№3的降解率较高,且降解率随时间变化的趋势也基本一致。在420min时,№1、№2和№3在阳光照射下的降解率为15.01%、15.21%和17.62%,在暗箱中的降解率为13.48%、14.09%和17.43%,两者十分接近。由此可见光照射不是导致甲基蓝降解的主要因素,而化学反应导致了甲基蓝分解。其可能的机理是:FeCl3-NiCl2-GICs在水中部分分解,鳞片边沿的少量插入物会溶解到了水中,于是溶液中出现了铁离子、镍离子和氯离子。FeCl3本身就可以作为水澄清剂,通过离子反应,甲基蓝产生了褪色降解。由于分解是一个缓慢的过程,因此表现为随时间延长降解率增大。但随着分解过程继续,鳞片边沿塌陷,分解趋于结束,于是降解率也渐渐趋于不变。
综合上述3个试验得到的分解率数据,添加石墨层间化合物的甲基蓝溶液,在紫外光照射下分解率远高于其他两种情形,这说明FeCl3-NiCl2石墨层间化合物具有光触媒的特征。其可能机理是,所合成的石墨层间化合物为非化学计量比的化合物,除了插入物与石墨结构层之间存在电子交换,插入物中也存在各种离子空位。在紫外线激发下,其中的某些缺陷产生能级跃迁,生成光生电子。这些光生电子沿着石墨结构层迅速迁移到鳞片边沿,于是就产生了光催化效果。基于这种考虑,单一阶结构GICs的缺陷比混合阶GICs相对较少,混合阶本身就是一种典型的缺陷结构,具有更高的缺陷浓度。在紫外线激发下产生的电子浓度也就相对较高,因此光催化性能相对较高。
4 结论
(1) FeCl3-NiCl2-GICs存在光催化活性,混合阶GICs的催化效率较单一阶的高。这一结论拓展了石墨层间化合物的应用领域。
(2) 石墨层间化合物的部分分解也会使甲基蓝溶液产生分解,但与其光催化效果比,降解率要小得多,且随时间延长逐渐趋于稳定。
[1]FUJISHIMA A. Photolysis decomposition of water at the surface of an irradiated semiconductor[J]. Nature,1972,238:37-38.
[2]CAREY J H, LAWRENCE J, TOSINE H M. Photodechlorination of PCB's in the presence of titanium dioxide in aqueous suspensions[J]. Bulletin of Environmental Contamination and Toxicology, 1976,16(6):697-701.
[3]HOFFMANN M R, MARTIN S T, CHOI W, et al. Environmental applications of semiconductor photocatalysis[J]. Chemical Reviews, 1995,95(1):69-96.
[4]LINSEBIGLER A L, LU G Q, YATES J T. Photocatalysis on TiO2surfaces: principles, mechanisms, and selected results[J].Chemical Reviews, 1995,95(3):735-758.
[5]FUJISHIMA A, RAO T N, TRYK D A. Titanium dioxide photocatalysis[J]. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2000,(1):1-21.
[6]ASAHI R, MORIKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001,293:269-271.
[7]LICHT S, GHOSH S, TRIBUTSCH H, et al. High efficiency solar energy water splitting to generate hydrogen fuel: probing RuS2enhancement of multiple band electrolysis[J]. Solar Energy Materials and Solar Cells, 2002,70(4):471-480.
[8]ZENG Y, LIU J T, WU W, et al. Photocatalytic performance of plasma sprayed TiO2-ZnFe2O4coatings[J]. Surface and Coatings Technology, 2005,200:2398-2402.
[9]SUN W, ZHANG S Q, WANG C, et al. Effects of cocatalyst and calcination temperature on photocatalytic hydrogen evolution over BaTi4O9powder synthesized by the polymerized complex method[J]. Catalysis Letters, 2008,123:282-288.
[10]SAYAMA K, TANAKA A, DOMEN K, et al. Photocatalytic decomposition of water over a Ni-loaded Rb4Nb6O17catalyst[J]. Journal of Catalysis, 1990,124:541-547.
[11]BEI X D, CAI J, BEI X G. et al. Study of electrochemical synthetic research of graphite intercalation compounds (GICs)-a nanometer-grade composite[J]. J. Composite Materials, 1996,(13):5359.
[12]ENOKI T, SUZUKI M, ENDO M. Graphite intercalation compounds and applications[M]. 1sted. New York: Oxford University Press, 2003:212-214.
[13]张宝庆,刘洪波,李德意,等.碳纤维作宿主的FeCl3-AlCl3-GIC的制备及其电学性质[J].碳素,2000,(4):1-5.
[14]CHUAN X Y, CHEN D Z, ZHOU X R. Electric properties of expanded graphite intercalation compounds[J]. J. Mater. Sci.Technol. 2001,17(3):371-374.
[15]曹宏,李儒,蔡细荣,等.CoCl2-FeCl3-膨胀石墨层间化合物电学和磁学性能表征[J].碳素技术,2008,(2):15-18.
[16]传秀云.膨胀石墨CuCl2-NiCl2-层间化合物磁性研究[J].无机材料学报,2000,16(6):1077-1082.
[17]CAO H, BIN X B. Structure characterization of the nanometer domain in FeCl3-GICs[C]. Proceedings of the Sixth International Conference on Measurement & Control of Granular Materials, China Electronic Acad., Beijing, 2003:560-562.
[18]关鲁雄,秦旭阳,丁萍,等.光催化降解甲基蓝溶液[J].中南大学学报(自然科学版),2004,35(6):970-973.
Preliminary Study on the Photocatalysis of FeCl3-NiCl2Graphite Intercalation Compounds
CAO Hong, WANG Sheng-jun, LI An-jin, XUE Jun, CHEN Li-qiang
(School of Materials Science and Engineering, Wuhan Institute of Technology, Wuhan 430073, China)
Graphite intercalation compounds is a quasi 2-dimension physical system. The unique electrical and magnetic properties of graphite intercalation compounds have been extensively studied. However, catalytic activity of these compounds has still not been reported. In the present work, FeCl3-NiCl2graphite intercalation compounds with various stage-structures have been prepared by heating the starting materials. For first time, we found that these compounds are photocatalytically active for degradation of methylene blue under ultraviolet illumination. Furthermore, the compounds with mixed stage structures possess higher catalytic activity, compared with that of one with pure stage structures.
graphite intercalation compounds; photocatalysis; methylene blue; degradation
TQ426.6;P619.253
A
1007-9386(2011)02-0035-04
2011-03-07

