关于中心原子杂化轨道数的计算方法
苏金昌
(大庆教育中心 黑龙江大庆 163001)
杂化轨道理论是大学化学的重要基础理论之一,主要用来讨论共价分子(或离子)的成键情况以及预测其几何构型或阐述其物理化学性质。对于如何判定给定的分子(或离子)的中心原子轨道杂化方式,在杂化轨道理论里并没有系统论述,导致在应用杂化轨道理论教与学时遇到困难。为了有利于应用杂化轨道理论阐述相关问题,本文给出一个有关中心原子杂化轨道数的计算公式,并根据计算得出的杂化轨道数确定对应的杂化轨道类型。
1 中心原子杂化轨道数的计算公式
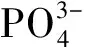
根据价键理论,在共价分子(或离子)中,氢原子(H)的价层一般满足2 电子的稳定结构,而非氢原子(B)的价层一般满足8电子的稳定结构。当每个H、B都通过一个双电子的σ键与A共享2个电子时,满足2电子稳定结构的每个H的价电子就都参与了双电子σ键的形成,并没有剩余未成键的价电子;而每个B的价层8个电子中除了有2个是与中心原子A共用的σ键电子外,还有6个是未参与双电子σ键的电子,n个B共有6n个电子未参与σ键形成。那么,对于HmABn的V个价电子中余下的(V-6n)个价电子,如果假定它们都有在A与B、A与H之间形成双电子σ键的倾向,则中心原子A倾向参与形成双电子σ键的最大数为:(V-6n)/2,即V/2-3n。
假定在共价分子(或离子)中,中心原子键合时之所以进行轨道杂化,其主要目的是最大限度地促进中心原子与配位体之间形成更多牢固的σ键,即尽可能地促使σ键的数目倾向于最大。因为“头碰头” 式重叠的σ键越多、越牢固,构成的分子(或离子)就越稳定。可见,中心原子倾向参与形成σ键的最大数与其杂化轨道数之间存在着对应关系。若令G表示中心原子A的杂化轨道数,则计算中心原子杂化轨道数的公式可写为:
G=V/2-3n
(1)
由式(1)可知,G的大小与V、n有关。即对于HmABn型分子(或离子),其中心原子(A)的杂化轨道数(G),由分子(或离子)的价电子总数(V)和非氢配位体数目(n) 决定。
用式(1)计算得出的中心原子的杂化轨道数及其杂化轨道类型、杂化轨道空间取向的对应关系归纳在表1中。

表1 中心原子杂化轨道数与杂化轨道类型及空间取向的对应关系
2 应用示例
例:次磷酸分子H2(HO)PO中P的杂化轨道数为:
G=V/2-3n=20/2-3(1+1)=4
其对应的杂化轨道类型是sp3。
应用式(1)计算了一些有代表性的分子(或离子)的杂化轨道数及对应的杂化轨道类型,其结果见表2,与有关文献报告相符。
根据式(1)计算得出的杂化轨道数判定对应的杂化轨道类型后,再进一步结合配位数讨论价键结构或判定共价分子(或离子)的几何构型,可以按常规方法处理,本文不再赘述。
表2 代表性分子(或离子)的中心原子杂化轨道数及对应的杂化轨道类型
3 讨论
1) 当m=0、n≠0时,即对于ABn型分子(或离子),式(1)的形式仍为:
G=V/2-3n
所不同的是这时的价电子总数V是1个A与n个B的价电子数之代数和。
2) 当n=0时,式(1)可简化为:
G=V/2
3) 对于V相同的不同分子(或离子),当n相同时,由式(1)可得出G是相同的。说明这类分子(或离子)的中心原子的杂化轨道类型是相同的,也说明“等电子分子族”结构相似性的理论依据是其中心原子轨道杂化方式的一致性。例如,表2中所列的各组实例。
4) 在分子(或离子)中,多数价电子总数V是偶数。对于少数V为奇数的分子(或离子),用(V+1)代替式(1)中的V,同样可以得出合理的结果。
例:在价电子总数为17的NO2中,N的杂化轨道数为:
G=(V+1)/2-3n=(17+1)/2-3×2=3
其对应的杂化轨道类型是sp2。
5) 由式(1)可知,求G值并不需要先确认中心原子价层里的孤电子对,就能直接得出合理结果。这是本方法的独特创新之处,也是诸多其他方法[1-3]所不能的。实际上,当确认了中心原子杂化轨道数及对应的杂化轨道类型,再结合配位数,其杂化轨道中有无未成键电子(或未成键电子分组情况)便一目了然。也可以用式(2)计算未成键的杂化轨道数,即价层中未成键的电子组数(L)。
L=G-(n+m)
(2)
综上所述,应用本文提出的式(1),仅选择2个参数(V、n)就能直接得出中心原子的杂化轨道数并确定相应的杂化轨道类型,说明该方法是一种简单、直接、有效的方法。但需要指出的是:这种计算方法对主族元素及主族元素与零族元素形成的单中心共价分子(或离子)是有效的,而对于含有过渡金属元素或含有多个中心原子的分子(或离子),则还有待进一步探讨。
参 考 文 献
[1] 张文广,韦斯林,王祖浩.化学教育,2008,29(6):3
[2] 吴集贵,曾正志,姚卡玲.大学化学,1991,6(6):9
[3] 李小平.大学化学,1987,2(6):39

