酿酒酵母胞内代谢关键酶对乙醇的耐受性
聂 妤, 董 亮, 侯 德 文, 李 明 达, 王 晓 丹, 赵 长 新
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034; 2.华润雪花啤酒(盘锦)有限公司, 辽宁 盘锦 124010 )
0 引 言
酵母菌株对浓度较大的乙醇的耐受性存在明显的差异[1],而其耐酒精的生化机理对于提高工业发酵生产酒精和研究酵母抵抗不良环境生命机制有着重要的理论和实际意义,近几年来科研工作者从自然界中分离得到或通过遗传工程手段构建了一些能在短时间内产生高浓度酒精(发酵液中的乙醇体积分数达到17.5%以上,而普通酵母菌只能产生9%~11%乙醇)的酵母菌,同时开展了大量的酵母菌耐酒精的生化机制的研究工作,发现酵母菌耐酒精的生理机理是十分复杂的[2-4]。细胞中的许多组分与酵母菌耐酒精能力有密切的关系,并且细胞的许多基因控制着酵母菌耐酒精的特性,而且这些具体生化机理还有待于进一步研究[5-6]。
本文以酶学研究为切入点,通过对不同酒精体积分数下的酵母细胞糖酵解途径和三羧酸循环中关键代谢节点处的关键酶进行分析,关键酶活力的变化一定程度上反映了其对酒精的耐受能力,为酵母对酒精耐受的生化机理研究提供了一定的理论依据。
1 材料与方法
1.1 材 料
1.1.1 菌 种
酿酒酵母SaccharomycescerevisiaeFCC 2146,由大连工业大学生物与食品学院保藏所提供。
1.1.2 培养基
YPD培养基(100 mL):蛋白胨2 g,葡萄糖2 g,酵母提取粉1 g,pH 6.0,0.1 MPa,115 ℃,灭菌20 min。
供试培养基是在此培养基中添加一定量的乙醇。
①YPD对照;②YPD+2 mL乙醇;③YPD+4 mL乙醇;④YPD+6 mL乙醇;⑤YPD+8 mL乙醇。
1.1.3 仪 器
TGL-16G台式离心机,上海安亭科学仪器厂;B-22M超高速冷冻离心机,Thermo IEC公司;全温落地式摇床,上海精宏仪器设备有限公司;JY99-2D超声波细胞粉碎机,宁波新芝科器研究所。
1.2 方 法
1.2.1 酵母培养
发酵培养:按体积分数2%的接种量接种于上述①、②、③号培养基中,在500 mL锥形瓶装液150 mL,30 ℃、230 r/min下在往复式振荡摇床培养24 h。定时无菌操作取10 mL发酵液维素酯滤膜进行真空超滤用于分析。
种子培养:菌种复壮后,挑取1菌环酵母置于含有50 mL无菌YNB液体培养基的250 mL锥形瓶中,在30 ℃、160 r/min下振荡培养24 h,制备正处于指数生长期的细胞悬浊液。
1.2.2 酶活力检测
在YPD培养基中添加乙醇体积分数分别为2%、4%、6%、8%。接入S.cerevisiae连续培养,在它们各自的对数期取样,测定中间代谢途径中的一些关键酶活性随乙醇的变化,并绘制变化曲线。包括磷酸戊糖途径(6-磷酸葡萄糖脱氢酶,G6PDH),糖酵解途径(丙酮酸激酶,PYK),柠檬酸循环(苹果酸脱氢酶,MDH;异柠檬酸脱氢酶,ICDH;异柠檬酸裂解酶,ICL)以及乙醇脱氢酶YADH活性。丙酮酸激酶按参考文献[7]的方法测定,异柠檬酸脱氢酶按参考文献[8]的方法测定,葡萄糖-6-磷酸脱氢酶按参考文献[9]的方法测定,苹果酸脱氢酶按参考文献[10]的方法测定,乙醇脱氢按酶参考文献[11]的方法测定。酶活力单位的定义为每分钟每毫克蛋白质转化1 μmol底物所需要的酶量为1个活力单位(U)。
2 结果与讨论
2.1 丙酮酸激酶对乙醇的耐受性分析
由图1可以看出,丙酮酸激酶活力随着乙醇体积分数的增加而减小。在不添加乙醇条件下,酵母细胞内丙酮酸激酶活力最高为0.682 U;在乙醇体积分数8%时,酵母细胞内丙酮酸激酶活力最低为0.022 U。而在乙醇体积分数2%时,酵母细胞内丙酮酸激酶活力为0.152 U,较无乙醇的酶活力降低了77.7%。说明丙酮酸激酶活力对乙醇体积分数变化较为敏感,耐受性比较差。PYK活性提高有利于糖酵解途径进行的顺利,反之该酶活性降低会导致细胞能量的供应受到影响。它在细胞内含量的多少反映了细胞内流经糖酵解途径的通量大小。

图1 丙酮酸激酶活力随乙醇体积分数变化曲线
2.2 葡萄糖-6-磷酸脱氢酶对乙醇的耐受性分析
由图2可见,葡萄糖-6-磷酸脱氢酶活力随着乙醇体积分数的增加而略有增加。在无乙醇添加的培养条件下,酵母细胞内丙酮酸激酶活力最低为0.148 U;在乙醇体积分数8%时,酵母细胞内丙酮酸激酶活力最高,为0.183 U,较无乙醇条件下酶活力提高了23.65%,由此可知,乙醇体积分数的增加对葡萄糖-6-磷酸脱氢酶活力的影响较小,耐受性较强。综上说明,随着乙醇体积分数的增加,酵母细胞内的PP途径也相应地增大,以提供大量的NADPH还原力以减轻乙醇对细胞的毒害作用。

图2 葡萄糖-6-磷酸脱氢酶活力随乙醇体积分数变化曲线
2.3 苹果酸脱氢酶对乙醇的耐受性分析
由图3可见,苹果酸脱氢酶活力随着乙醇体积分数的增加而增加。在无乙醇添加的培养条件下,酵母细胞内苹果酸脱氢酶活力最低为0.032 U;在乙醇体积分数8%时,酵母细胞内苹果酸脱氢酶活力最高为0.114 U,较无乙醇条件下酶活力提高了256.25%。从图3中可以看出,当乙醇体积分数高于4%时,苹果酸脱氢酶活力升高较为显著,由0.045 U升高至0.106 U。由此可知,乙醇体积分数的增加能够增加苹果酸脱氢酶的活力,苹果酸脱氢酶对乙醇的耐受性较强,当胞外乙醇体积分数超过4%时,苹果酸脱氢酶活力较高,TCA循环中该酶所催化的代谢反应较为活跃。

图3 苹果酸脱氢酶活力随乙醇体积分数变化曲线
2.4 异柠檬酸脱氢酶对乙醇的耐受性分析
由图4可见,异柠檬酸脱氢酶活力随着乙醇体积分数的增加而减小。在无乙醇添加的培养条件下,酵母细胞内异柠檬酸脱氢酶活力最高,为0.201 U;在乙醇体积分数8%时,酵母细胞内异柠檬酸脱氢酶活力最低,为0.003 U。说明异柠檬酸脱氢酶活力对于乙醇体积分数较为敏感,耐受性比较差。由此可知,在外源乙醇体积分数较高的情况下,异柠檬酸脱氢酶活力很低,说明异柠檬酸并不是由异柠檬酸脱氢酶催化生成α-酮戊二酸,而很可能是由异柠檬酸裂解酶将其催化生成琥珀酸和乙醛酸。
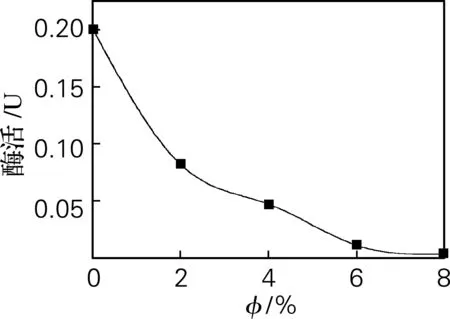
图4 异柠檬酸脱氢酶活力随乙醇体积分数变化曲线
2.5 异柠檬酸裂解酶对乙醇的耐受性分析
由图5可见,异柠檬酸裂解酶活力随乙醇体积分数的增加而增大。在无乙醇添加的培养条件下,酵母细胞内的异柠檬酸裂解酶活力最低,为0.302 U;在乙醇体积分数8%时,酵母细胞内异柠檬酸裂解酶活力最高,为1.136 U,较无乙醇条件下酶活力提高了276.16%。由图5可知,乙醇体积分数的增大能够使异柠檬酸裂解酶活力增大,外源乙醇的添加对异柠檬酸裂解酶活力有一定的促进作用。这与“2.4”所做出的推断相符。

图5 异柠檬酸裂解酶活力随乙醇体积分数变化曲线
说明异柠檬酸在TCA循环中的去路主要是通过异柠檬酸裂解酶转化而成乙醛酸和琥珀酸,这种转变是由外源乙醇体积分数的增大所引起的。
2.6 乙醇脱氢酶对乙醇的耐受性分析
由图6可见,乙醇脱氢酶活力随着乙醇体积分数的增加而减小。在无乙醇添加的培养条件下,酵母细胞内乙醇脱氢酶活力最高,为3.779 U;在乙醇体积分数8%时,酵母细胞内乙醇脱氢酶活力最低为0.467 U。而在乙醇体积分数2%时,酵母细胞内乙醇脱氢酶活力为1.409 U,较无乙醇添加条件下的酶活力降低了62.72%。说明乙醇脱氢酶活力对于乙醇较为敏感,耐受性比较差,较低体积分数的乙醇对其活性产生较大的抑制作用。乙醇脱氢酶的酶活高,可以快速地将碳源转化为乙醇,减少代谢中间产物丙酮酸在其他代谢途径上的代谢通量。而过量乙醇的反馈抑制使乙醇脱氢酶的酶活降低,不能及时地将丙酮酸转化为乙醇,导致代谢中间产物丙酮酸积累,使丙酮酸流向乙醛途径和乳酸途径等。

图6 乙醇脱氢酶活力随乙醇体积分数变化曲线
3 结 论
分别考查了乙醇体积分数2%、4%、6%、8%时的酵母细胞糖酵解途径和三羧酸循环中葡萄糖-6-磷酸脱氢酶、丙酮酸激酶、异柠檬酸脱氢酶、苹果酸脱氢酶、乙醇脱氢酶、异柠檬酸裂解酶活力等关键代谢节点处的酶活力,实验发现葡萄糖-6-磷酸脱氢酶酒精的耐受能力较强,酶活力随乙醇体积分数的升高变化不大;丙酮酸激酶、异柠檬酸脱氢酶和乙醇脱氢酶表现出对酒精的耐受力较差,其酶活力随乙醇体积分数的升高而降低;苹果酸脱氢酶和异柠檬酸裂解酶表现出对酒精良好的耐受性,其酶活力变化随乙醇体积分数的升高而增大。研究同时发现,由于在乙醇体积分数较高时,异柠檬酸脱氢酶活力的降低及异柠檬酸裂解酶活力的大幅度提高,导致酵母细胞的能量代谢途径发生变化,TCA循环被抑制,异柠檬酸在TCA循环中主要是通过异柠檬酸裂解酶转化而成乙醛酸和琥珀酸,后通过乙醛酸循环的回补途径。
[1] 赵华,赵树欣,才向东,等. 玉米原料酒精浓醪发酵技术的研究[J]. 酿酒科技, 1998(5):38-40.
[2] JONES A M, INGLEDEW W M. Fuel alcoholproduction:optimization of temperature for efficient very high gravity fermentation[J]. Applied and Environmental Microbiology, 1994, 60(3):1048-1051.
[3] THOMAS K C, INGLEDEW W M. Production of 21%(v/v) ethanol by fermentation of very high gravity wheat masher[J]. Journal of Industrial Microbiology and Biotechnology, 1992, 10(1):61-68.
[4] ABEDEL-FATTAH W R, FADIL M, NIGAM P, et al. Isolation of thermotolerant ethanologenic yeasts and use of selected strains in industrial scale fermentation in an egyptian distillery[J]. Biotechnology and Bioengineering, 2000, 68(5):531-535.
[5] BANAT I M, MERCHANT R. Characterization and potential industrial applications of five novel, thermotolerant, fermentative yeasts strains[J]. World Journal of Microbiology and Biotechnology, 1995, 11(3):304-306.
[6] 池振明,高峻. 酵母菌耐酒精机制的研究进展[J]. 微生物学通报, 1999, 26(5):373-376.
[7] MALCOVATI M, VALENTINI G. AMP-and fructose 1, 6-bisphosphate-activated pyruvate kinases from Escherichia coli[J]. Methods in Enzymology, 1982, 90:170-179.
[8] MESFIN T, STEPHEN J T, DEBORAH L A, et al. Overexpression of malate dehydrogenase in transgenic alfalfa enhances organic acid synthesis and confers tolerance to aluminum[J]. Plant Physiology, 2001, 127(12):1836-1844.
[9] FERNANDA G F G, RIBEIRO M Z, CONVERTI A. Kinetic and thermodynamic aspects of glucose-6-phosphate dehydro-genase activity and synthesis[J]. Enzyme and Microbial Technology, 2003, 32(1):107-113.
[10] 胡光星,郭美锦,储炬,等. 重组Pichia酵母(Muts)发酵过渡阶段关键酶活分析[J]. 华东理工大学学报, 2004, 30(4):392-396.
[11] ANDERSSON L, JOINVALL H, AKESON A K. Separation of isozymes of horse liver alcohol dehydrogenase and purification of the enzyme by affinity chromatography on an immobilized AMP-analogue[J]. Biochimica et Biophysica Acta, 2001, 364:1-8.

