关于化学发光演示实验的探讨*
胡玉斐 赖瑢 李攻科
(中山大学化学与化学工程学院 广东广州 510275)
化学发光分析法是近30年来发展起来的一种高灵敏的微量及痕量分析法,具有仪器设备简单、操作方便,灵敏度高,线性响应范围宽和易于实现自动化等 优点[1]。近年来,在完善常见化学发光试剂和拓宽体系应用的基础上,与其他技术的联用已成为化学发光分析法的发展方向。如与流动注射技术、成像技术、免疫技术、色谱技术等的联用,现已广泛应用于生命科学、临床医学、矿物岩石分析、材料分析、环境保护监测、药物分析等方面[2]。
在高校的仪器分析课程中[3],化学发光分析法属于分子光谱部分,理论部分的学习只有短短几页,往往在理论课程和实验课程中都被忽略。中山大学在现代化学实验与技术(仪器分析实验部分)课程中首次开设了化学发光实验——流动注射-化学发光联用技术用于眼药水中盐酸环丙沙星含量的研究。在指导学生开始实验前,需要帮助学生加深对理论课程中知识点的理解,包括化学发光现象,分析方法应用的原理,常见的化学发光体系等。若在课程中以直观、具体的发光演示实验为示例,可以给学生留下深刻的印象,激发学生的实验兴趣。通过演示明显的发光现象,帮助学生理解理论课程学习中的基本原理;通过演示实验的设计、演示及分析讲解将实验现象与理论融为一体,有助于启发学生的学习兴趣,训练学生的思维,培养其独立思考问题的能力。
1 实验原理
化学发光现象是化学反应的反应物或生成物吸收了反应释放的化学能后所产生的光辐射现象。其发光机理是反应体系中的某些物质分子(如反应物、中间体或荧光物质)吸收了反应释放的能量而由基态跃迁至激发态,然后再从激发态返回基态,同时将能量以光辐射的形式释放出来,产生化学发光。化学发光分析法是根据化学发光反应在某一时刻的发光强度或发光总量来确定反应中相应组分含量的分析方法。化学发光分析法可以测定化学发光反应的反应物、化学发光反应中的催化剂、增敏剂或者抑制剂以及偶合反应中的反应物、催化剂或者增敏剂等。常见的应用于液相化学发光的物质有鲁米诺、光泽精和洛粉碱。其中研究较多、在分析中应用最广的是鲁米诺。鲁米诺(3-氨基苯二甲酰肼)的化学发光反应效率为0.05~0.15。鲁米诺在碱性溶液中与双氧水的反应速度慢,而某些金属离子可催化该反应;故可利用这一现象间接测定这些金属离子。该方法可应用于痕量Cu2+、Mn2+、Co2+、V4+、Fe2+、Fe3+、Ni2+、Ag+、Au3+、Hg2+等的测定。
2 实验方法
2.1 仪器与试剂
BPCL微弱发光测量仪(中国科学院生物物理研究所研制)。
试剂Ⅰ:1×10-3mol/L鲁米诺的水溶液;试剂Ⅱ:1×10-2mol/L的H2O2溶液;试剂Ⅲ:1×10-3mol/L铁氰化钾水溶液;试剂Ⅳ:1×10-2mol/L Co(Ⅱ)溶液;试剂Ⅴ:1×10-2mol/L Cu(Ⅱ)溶液;试剂Ⅵ:1×10-2mol/L Cr(Ⅲ)溶液。
2.2 实验方法
演示鲁米诺-过氧化氢-催化剂体系化学发光现象的实验在暗室中进行,分别在4个测量杯中加入1mL试剂Ⅰ和1mL试剂Ⅱ,然后同时向4个测量杯中平行加入0.2mL试剂Ⅲ、Ⅳ、Ⅴ、Ⅵ,观测杯中的实时的发光现象。
利用BPCL微弱发光测量仪对实验效果最佳的催化剂采用分立取样法研究其动力学曲线及分析应用。
3 结果与讨论
3.1 演示实验效果
向鲁米诺和过氧化氢的混合溶液中平行加入不同催化剂的演示实验效果如图1所示。由图1可以看出加入催化剂能产生明显的化学发光,以Cu(Ⅱ)为催化剂,溶液呈蓝色,加入后产生的发光最为微弱;以Cr(Ⅲ)为催化剂,溶液呈绿色,加入后产生发光强度最大,溶液呈现均匀的蓝色很适合观察;以铁氰化钾为催化剂,溶液呈黄色,加入后产生的发光比较持久; 而以Co(Ⅱ)为催化剂,溶液呈粉红色,加入即可产生的强烈的发光信号,信号对比最为明显,发光信号随着Co(Ⅱ)在鲁米诺-过氧化氢混合溶液中的扩散呈现梯度变化。
在理论课程讲授中,化学发光分析法定量的依据是在化学发光分析中,被分析物相对于发光试剂小得多。对于一级动力学反应,发光强度与被分析物浓度呈线性关系。催化剂Co2+溶液为粉红色,产生的蓝色发光信号对比明显,蓝色信号随催化剂与发光试剂的混合程度加大而呈现明显的梯度。因此,我们选择鲁米诺-过氧化氢-Co(Ⅱ) 体系进行演示实验。

图1 不同催化剂作用下的化学发光现象
3.2 鲁米诺型发光体系的动力学曲线
在碱性介质条件下,过渡金属离子能增强鲁米诺与过氧化氢的化学发光反应。常用典型的响应曲线(强度对时间的曲线)描绘该化学发光反应的特征。响应曲线不仅与实验条件(包括pH和试剂浓度)有关,还与催化剂的使用有关。我们采用分立取样法研究了鲁米诺-过氧化氢-Co(Ⅱ)体系的动力学曲线,保持其他实验参数不变,记录Co(Ⅱ)溶液(1×10-4g/mL)催化鲁米诺(1×10-5mol/L,pH=11)-H2O2(1×10-4mol/L)化学发光反应的响应曲线(图2),其相对发光强度在催化剂Co(Ⅱ)溶液注射后1s内达到最大。
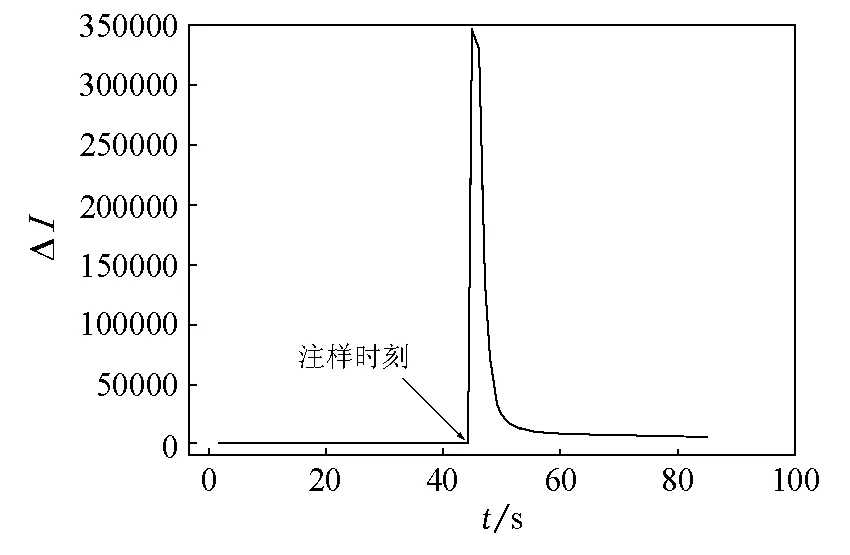
图2 鲁米诺-H2O2-Co(Ⅱ)化学发光反应的动力学曲线鲁米诺:1×10-5mol/L(pH=11);H2O2:1×10-4mol/L;注射的Co(Ⅱ):1×10-4g/mL
3.3 鲁米诺化学发光体系的分析应用
在化学发光分析中,被分析物相对于发光试剂小得多。对于一级动力学反应,dc/dt=Kc(K为反应速率常数;c为被分析物的浓度),在一定条件下,峰值光强度与被测物浓度呈线性。固定鲁米诺与过氧化氢的浓度,改变注射的Co2+溶液的浓度,实验结果如图3所示。从图3可看出,相对发光强度随Co2+溶液浓度的增大而显著增大。据此可利用该化学发光体系对Co2+进行测定。在固定鲁米诺和过氧化氢浓度条件下,相对发光强度(ΔI)与Co2+溶液浓度呈良好的线性关系,ΔI=128.44c+22075(c为Co2+溶液浓度,单位为mol/L),R2=0.9942。
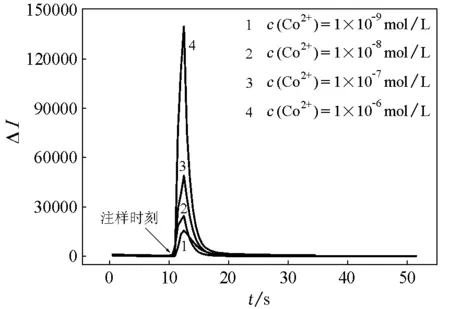
图3 相对发光强度随Co(Ⅱ)浓度变化关系鲁米诺: 1×10-6mol/L(pH=11);H2O2:1×10-5mol/L;注射的Co(Ⅱ):1×10-9mol/L~1×10-6mol/L
3.4 鲁米诺型发光体系的发光机理
由文献[4]可知,过渡金属离子(Co2+,Cu2+,Fe3+,Ni2+,Cr3+)对鲁米诺-过氧化氢化学发光体系有明显的催化作用。最先被报道的是Cu(Ⅱ),而应用最广泛的是Co(Ⅱ),原因在于Co(Ⅱ) 对鲁米诺-过氧化氢有很好的催化作用以及其在自然水体系中的低浓度。鲁米诺-过氧化氢-Co(Ⅱ)体系已被用于测定过氧化氢,检出限达纳摩尔和亚纳摩尔级,可向学生讲授鲁米诺型化学发光的可能机理如下:
以Me(Ⅱ)表示的这类催化剂通常在反应中具有可变化合价。在溶液中溶解氧作用下,生成超氧阴离子自由基、羟基自由基以及过氧化氢。


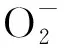

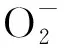
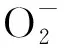
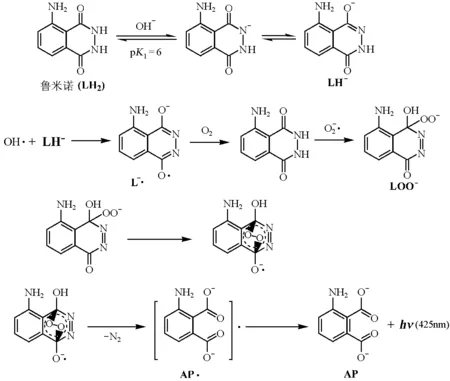
图4 鲁米诺与活性氧物质作用机理
4 结论
演示实验选用的鲁米诺-H2O2-Co2+体系在暗室中发光信号对比明显。由于人们对基于鲁米诺氧化反应而产生的发光反应机理的研究相对比较深入,体系的实际应用广泛,很适合作为本科生的化学发光法演示实验。通过该实验的演示,明显的蓝色发光信号能给学生留下了深刻的印象;同时,结合详细的机理讲解,能帮助学生加深对理论课讲授知识点的理解。该演示实验已经连续2年在我校化学院本科三年级中开设,授课效果良好。
[1] Su Y Y,Chen H,Wang Z M,etal.AppliedSpectroscopyReviews,2007,42:139
[2] Gracia L G,GarcíaCampana A M,Huertas Pérez J F,etal.AnalyChimActa,2009,640(1-2):7
[3] 于化江,袁华,杨凤珍,等.沧州师范专科学校学报,2009,25(1):94
[4] Lv C,Song G Q,Lin J M.TrendsAnalChem,2006,25(10):985
[5] Bustos C,Salgado G,LoUez C.ChemEducator,2001,6(1):97

