新型抗结核分枝杆菌药物筛选模型的建立
张磊磊,由鹏飞,2,姚广新,侯爵,张怡轩,2*
(1.沈阳药科大学生物制药教研室,辽宁沈阳110016;2.沈阳药科大学生物学教学实验中心,辽宁沈阳110016)
新型抗结核分枝杆菌药物筛选模型的建立
张磊磊1,由鹏飞1,2,姚广新1,侯爵1,张怡轩1,2*
(1.沈阳药科大学生物制药教研室,辽宁沈阳110016;2.沈阳药科大学生物学教学实验中心,辽宁沈阳110016)
为建立基于酶水平和细胞水平的新型抗结核分枝杆菌(Mycobacterium tuberculosis)药物的筛选模型,以M.tuberculosis H37Rv基因组DNA为模板,PCR特异性扩增异柠檬酸裂解酶(ICL)基因,构建表达载体,在E.coli BL21(DE3)中高效表达,使用Ni2+亲和层析柱纯化重组ICL,检测其活性。优化ICL酶反应条件,考察待筛选样品溶剂对酶活性的影响,建立ICL抑制剂酶水平筛选模型;考察与优化耻垢分枝杆菌(Mycobacterium smegma)在以乙酸盐为唯一碳源的培养基中的生长状况,建立基于M.smegma的乙醛酸代谢途径抑制剂的细胞水平筛选模型;利用上述2种筛选模型对1060种可能具有拮抗活性的微生物代谢样品进行初筛和复筛,两者筛选结果正相关性较好。
结核分枝杆菌;异柠檬酸裂解酶;耻垢分枝杆菌;乙醛酸途径;筛选模型
结核病是由结核分枝杆菌(Mycobacterium tuberculosis)引起的传染性疾病。WHO报告显示,全球有超过20亿人感染M.tuberculosis,其中约有1/10的人会发展为结核病。2008年全球新增940万结核病病例,同年180万人死于结核病。目前多重耐药结核分枝杆菌(MDR-TB)的出现及M.tuberculosis在患者体内的持留状态,已经成为结核病预防和治疗过程中的重大障碍,因此针对M.tuberculosis在患者体内的持留状态,寻找新的药物作用靶点,建立新的药物筛选模型是开发新型抗结核药物的关键。致病性菌株M.tuberculosis H37Rv全基因组测序工作的完成,为研究提供了大量的药物靶点[1]。异柠檬酸裂解酶(ICL)作为乙醛酸途径的关键酶,当培养基的碳源受到限制或缺氧时,菌体内糖酵解途径减弱,乙醛酸循环加强,酶活性上调[2]。Mckinney等[3]的研究表明ICL对M.tuberculosis在巨噬细胞内的持续存活至关重要。乙醛酸途径存在于原核生物、低等真核生物和植物中,在哺乳动物体内不存在[4],故可将ICL作为特异性极强的药物靶点,建立新型抗结核分枝杆菌药物的筛选模型[5]。但是以往的研究仅仅针对体外ICL酶活性进行抑制剂的筛选,对于活性化合物是否具有抑制菌体内ICL酶活性并没有进一步的筛选方法。由于M.tuberculosis具有极强的传染性和致病性,故培养M.tuberculosis需要在P2或者P3实验室进行,实验危险性大、成本高。本实验利用无毒的耻垢分枝杆菌(Mycobacterium smegma)替代M.tuberculosis进行研究,考察以乙酸盐为唯一碳源的M.smegma生长状况以及乙醛酸途径的启动,建立乙醛酸途径抑制剂细胞水平的筛选模型。本文针对ICL分别建立酶水平和细胞水平的筛选模型,即首先克隆表达M.tuberculosis H37Rv的ICL,建立酶水平抑制剂筛选模型;又以乙酸盐为唯一碳源,建立M.smegma乙醛酸代谢途径抑制剂的细胞水平筛选模型。利用上述2种模型对本实验室的微生物发酵样品进行筛选,正相关性达到90%以上。
1 材料与方法
1.1 材料
1.1.1 实验材料M.tuberculosis H37Rv icl基因由复旦大学赵国屏教授惠赠;E.coli BL21(DE3) plysS、E.coli DH-5α、M.smegma(ATCC607)由本实验室保藏;质粒pET-28b(+)由本实验室保藏;微生物发酵样品1060种(本室分离并保存)。
1.1.2 试剂T4 DNA-ligase、限制性内切酶NdeⅠ、HindⅢ,pMD18-T Vector,Ex Taq Polymerase均购自TAKARA公司;3S柱离心式DNA小量快速纯化试剂盒、3S柱离心式质粒小量快速抽提试剂盒、BBST NTA-Ni Resin购自上海申能博彩生物科技有限公司;考马斯亮兰蛋白测定试剂盒购自南京建成生物工程研究所;MarkerⅣ、Protein Molecular Weight Marker购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 M.tuberculosis H37Rv ICL基因的克隆
以M.tuberculosis H37Rv icl基因为模版,使用Primer(S):5'-GGGTTT CATATG TCTGTCGTCGGCAC-3'(下划线部分为NdeⅠ酶切位点)、Primer (A):5'-CCC AAGCTT CTAGTGGAACTGGCCC-3' (下划线为部分为HindⅢ酶切位点)为模板进行聚合酶链反应(PCR),扩增目的基因。PCR反应条件为95℃变性10 min、95℃变性30 s、55℃退火30 s、72℃延伸90 s、72℃延伸10 min,共进行30个循环。扩增产物经琼脂糖凝胶电泳检测无误后回收纯化。将纯化的PCR产物与pMD18-T Vector进行连接,转化入E.coli DH-5α中。重组克隆载体命名pMD18-ICL。抽取克隆载体经NdeⅠ、HindⅢ双酶切后纯化ICL片段并与pET-28b(+)经NdeⅠ、HindⅢ酶切后的纯化产物进行连接,转化入E.coli DH-5α中。挑取阳性克隆,提取质粒,命名为pET-28b-ICL。
1.2.2 重组ICL的表达与纯化将重组质粒pET-28b-ICL转化入表达菌株E.coli BL21 (DE3)plysS,LB/Kan平板筛选阳性克隆,挑取单菌落于5 mL LB培养基(Kan 50 g/mL)中,37℃220 r/min培养16 h,取3 mL菌液转种至50 mL LB培养液(Kan 50 μg/mL)中,37℃220 r/ min培养2~3 h,加入IPTG(终浓度0.25 mmol/ L)25℃,220 r/min培养6 h,离心收集,加入1/ 20菌体培养液体积的NTA-0 Buffer(20 mmol/L Tris-HCl pH 7.9、0.5 mmol/L NaCl、10%Glycerol)和PMSF(终浓度为1 mmol/L)悬浮菌体,置于冰上超声破碎(40%功率,超声1 s,间隔1 s,超声总时间为5 min),分别收集沉淀和上清,并设立E.coli BL21(DE3)plysS与含有pET-28b的E.coli BL21(DE3)plysS为对照,采用十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳检验重组ICL的表达状况。用4倍柱体积的超声上清液上样NTA-Ni Resin,以含20、40、60、80、200 mmol/L咪唑的NTA buffer对目的蛋白进行洗脱,使用SDS-PAGE来判断目的蛋白在洗脱液中的分布状况。使用考马斯亮兰染色法测定ICL蛋白浓度。
1.2.3 重组ICL活性检测及动力学参数测定
ICL能催化异柠檬酸分解为乙醛酸和琥珀酸,乙醛酸与苯肼反应,生成物苯腙在324 nm处有紫外吸收,以此测定重组ICL的活性。参照文献[6]建立ICL活性检测的基础体系:MgCl2·6H2O 7.5 mmol/L,盐酸苯肼5 mmol/L,DL-半胱氨酸3 mmol/L,Tris-HCl 50 mmol/L,DL-异柠檬酸三钠盐2.5 mmol/L。分别考察pH、Mg2+浓度和DL-半胱氨酸浓度对酶活性的影响,以确定最佳酶活检测体系,并测定重组ICL比活力。在此条件下,以0.03~1 mmol/L的异柠檬酸为底物,测定ICL的反应速度。根据酶催化底物的[S]-1-υ-1关系绘制曲线。通过Lineweave-Bure方程计算重组ICL米氏常数(Km)。
1.2.4 ICL抑制剂酶水平筛选模型的建立由于所筛选样品为微生物发酵液乙酸乙酯萃取物,在酶促反应体系中溶解度较差,严重干扰筛选结果。因此实验过程中选用DMSO和其他表面活性剂共同溶解样品。实验中考察了终浓度(体积比)为1%、2%、4%、6%、8%、10%和20%的DMSO;终浓度(体积比)为0.1%、0.25%、0.5%、1%、2%的Tween-20;终浓度(质量与体积比)为0.1%、0.25%、0.5%、1%的SDS对ICL活性的影响。由此确定筛选体系中样品溶剂的最佳加入量,结合ICL最适反应条件建立ICL抑制剂筛选模型。
1.2.5 乙醛酸途径抑制剂细胞水平筛选模型的建立采用改良的Dubos培养基(Apsaragine 2 g/ L,Na2HPO42.5 g/L,KH2PO41g/L,MgSO4·7H2O 10 mg/L,枸橼酸铁氨50 mg/L,CaCl20.5 mg/L,ZnSO40.1 mg/L,CuSO40.1 mg/L,Tween-800.05%,NaAc 10 mmol/L,)培养M.smegma,使之利用乙酸盐作为唯一碳源[2],启动菌体内乙醛酸循环。考察在这种培养基中M.smegma的生长状态以及菌体内ICL活性,以确定筛选样品最佳加入时间。由于使用DMSO溶解待筛选样品,实验中考察了终浓度(体积比)为1%、2%、3%、4%的DMSO对菌体生长的影响。
2 结果与分析
2.1 ICL基因的克隆与表达
以M.tuberculosis H37Rv基因组DNA为模版进行PCR扩增,以0.7%琼脂糖凝胶电泳检测,扩增产物约为1300 bp大小的特异性条带,与预期结果一致(图略)。将PCR产物连接入载体pMD18-T Vector,通过蓝白斑筛选挑取阳性克隆,经双酶切获得2个大小分别为1300 bp和2700 bp的片段,与预期结果一致(图略)。鉴定后将目的基因片段克隆入表达载体pET-28b(+),重组质粒经双酶切验证、PCR验证、测序验证正确后命名为pET-28b-ICL。
2.2 重组ICL的表达与纯化
将重组质粒pET-28b-ICL转化E.coli BL21 (DE3)plysS中,诱导表达后超声破碎菌体,经SDS-PAGE检测后发现在50 ku处有重组蛋白条带,并且超声上清液中的目的蛋白含量远大于沉淀中的目的蛋白含量(图1),说明目的蛋白大部分可溶性表达,因此选用超声上清液进一步纯化目的蛋白。
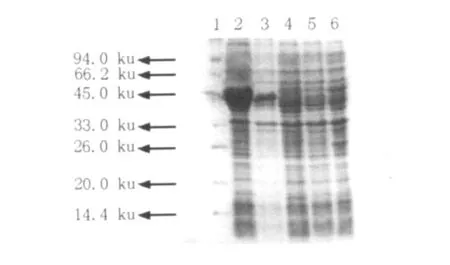
图1 SDS-PAGE检测重组ICL表达情况Fig.1Detection of the expression of recombinant ICL by SDS-PAGE 1:Protein Molecular Weight Marker;2:E.coli BL21(pET-28b-ICL)ultrasonic supernatant after induction;3:E.coli BL21(pET-28b-ICL)ultrasonic precipitation after induction;4:E.coli BL21(pET-28b-ICL)non-induced;5:E.coli BL21(pET-28b)after IPTG induction;6:E.coli BL21 afer IPTG induction
洗脱液经SDS-PAGE检测,结果显示目的蛋白主要存在于含200 mmol/L咪唑的洗脱缓冲液中(图2),且达到电泳纯。透析除去洗脱液中的咪唑,并经适当浓缩,测得纯化后ICL浓度为0.36 mg/mL。

图2 SDS-PAGE检测重组ICL纯化情况Fig.2Detection of the purification of recombinant ICL by SDS-PAGE 1:Protein Molecular Weight Marker;2:E.coli BL(pET-28b-ICL)ultrasonic supernatant after induction;3~8:Eluent with imidazole(0、20、40、60、80、200 mmol/L)
2.3 重组ICL活性检测及动力学参数测定

图3 pH对ICL活力的影响Fig.3The effect of pH on the activity of the recombinant ICL

图4 Mg2+浓度对ICL活性的影响Fig.4The effect of different concentrations Mg2+ on the activity of the recombinant ICL
于37℃,在不同pH值(分别为7.21、7.29、7.42、7.50、7.60、7.70、7.78、7.89、8.00)的100 mmol/L Tris-HCl缓冲液中测定重组ICL的活性,实验结果显示ICL最适pH为7.42(图3);在最适pH条件下调整反应体系中Mg2+浓度(分别为2.5、3.75、5、6.25、7.5 mmol/L),最终确定Mg2+最佳浓度为5 mmol/L(图4);调整反应体系中DL-半胱氨酸终浓度(分别为3.5、5.0、7.0 mmol/L),最终确定DL-半胱氨酸最适终浓度为5.0 mmol/L (图5)。因此,最适酶促反应体系:100 mmol/L Tirs-HCl(pH 7.42)50 μL,50 mmol/L MgCl210 μL,5.0 mmol/L DL-半胱氨酸10 μL,0.1 mol/L盐酸苯肼5 μL,10 mmol/L DL-异柠檬酸三钠盐2 μL,0.36 mg/mL ICL 3 μL。在此条件下,对ICL的比活力进行测定,测得纯化后ICL的比活力为1.402 μmol/min/mg,其Km值为0.811 mmol/L。
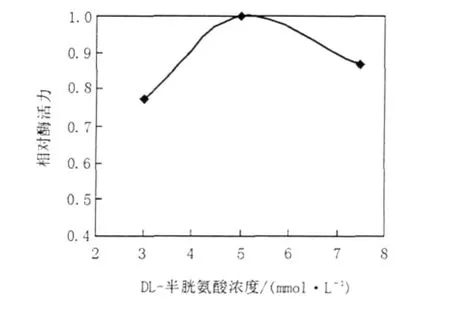
图5 DL-半胱氨酸浓度对重组ICL活性的影响Fig.5The effect of different concentrations of DL-Cys on the activity of the recombinant ICL
2.4 ICL抑制剂酶水平筛选模型的建立
实验证明,终浓度(体积比)为1%~20%的DMSO对ICL的活性并无显著影响,因此可以作为待筛选样品的溶剂。在0.5%~2%Tween-20对ICL活性的影响呈浓度相关性,浓度越高,ICL活性损失越多。但当Tween-20终浓度(体积比)为0.25%时ICL活性几乎没有损失,而且表现出轻微激活作用,因此在筛选体系中加入终浓度为0.25%的Tween-20,使样品增溶。终浓度(质量与体积比)在0.1%~1%范围内,SDS显著抑制ICL活性,损失率达到95%以上,因此不予采用。故最终确定待筛选样品的溶剂系统为100 μL DMSO与100 μL 2.5%Tween-20的混合液。最终确定ICL酶水平抑制剂筛选体系:Tirs-HCl(pH 7.42)50 mmol/L, MgCl25 mmol/L,DL-半胱氨酸0.5 mmol/L,盐酸苯肼5 mmol/L,DL-异柠檬酸三钠盐0.2 mmol/L,待筛选样品溶液20 μL,ICL 10.8 μg/mL。
2.5 ICL抑制剂酶水平筛选步骤
取96孔板,每孔加入100 mmol/L Tirs-HCl (pH 7.42)50 μL,50 mmol/L MgCl210 μL,5.0 mmol/L DL-半胱氨酸10 μL,0.1 mol/L盐酸苯肼5 μL,待筛选样品溶液20 μL,ICL(0.36 mg/mL) 3 μL。将96孔板置于振荡器震荡5min,再置于37℃温浴15 min,324 nm处检测,吸光度值记录为OD1,每孔加入10 mmol/L DL-异柠檬酸三钠盐2 μL,振荡器震荡5 min,37℃温浴15 min,振荡器震荡5 min,324 nm检测,吸光度值记录为OD2,同时设立样品的溶剂为阴性对照,其吸光度变化值记做Δ空白。样品抑制率计算公式如下。

2.6 乙醛酸途径抑制剂细胞水平筛选模型
实验结果表明,M.smegma在以乙酸盐为唯一碳源的培养基中培养13 h后,菌种进入对数生长期,菌液呈均匀浑浊状,其浊度在OD600显著增长(图6),并一直持续到22 h,22 h后菌体结团、有颗粒,不利于菌体浓度的检测;检测了对数生长期内15 h和20 h对应的培养液中菌体超声上清液ICL酶活性,发现其显著提高(图7),说明菌体确实处于乙醛酸代谢途径中,而且ICL酶活性增强,因此选取培养15~20 h进行ICL抑制剂的细胞水平筛选。
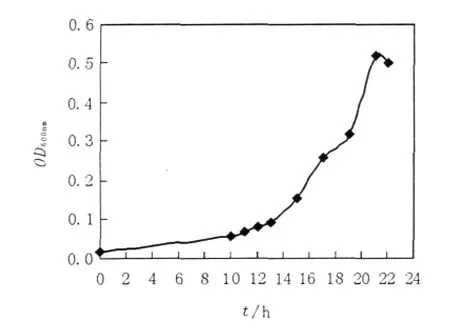
图6 乙酸盐为唯一碳源条件下M.smegma菌生长曲线Fig.6The growth curve of M.smegmatis when acetate as the sole carbon resource
同样,考察DMSO浓度对M.smegma生长的影响,发现当DMSO终浓度(体积比)为1%时对菌体无明显的抑制作用,但随DMSO浓度的增加,其抑制作用逐渐增加,特别是当DMSO终浓度达到4%时,菌体生长抑制率约为20%,故确定筛选体系中DMSO终浓度不超过1%。最终确定乙醛酸代谢途径抑制剂的细胞水平筛选体系:在198 μL M.smegma 15 h培养物中加入2 μL待筛选样品溶液。
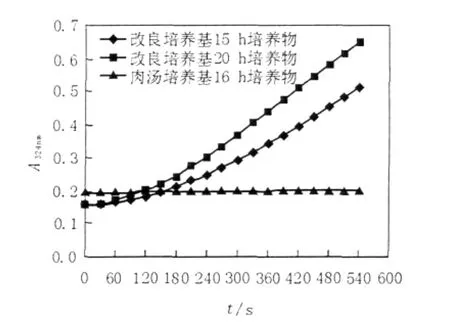
图7 乙酸盐为唯一碳源条件下M.smegma内ICL活性Fig.7The intracellular activity of ICL of M.smegmatis
2.7 乙醛酸途径抑制剂细胞水平筛选步骤
于96孔板中,每孔加入2 μL待筛选样品溶液,198 μL M.smegma在改良Dubos培养基中15 h培养物,在37℃温箱内震荡3 min后于600 nm测定OD值,计为OD1,继续在37℃温箱内震荡培养5 h,于600 nm测定OD值,计为OD2。同时以2 μL DMSO代替待筛选样品作为阴性对照,检测其培养过程中吸光度变化值(OD2-OD1)记做Δ对照(OD2-OD1)。
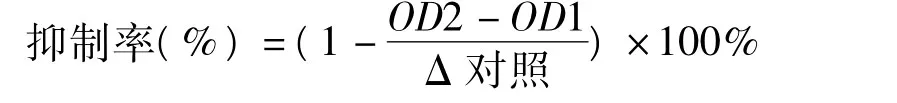
2.8 样品的筛选
取微生物发酵次级代谢产物样品1060个,利用ICL酶水平抑制剂筛选模型进行初筛,获得10个阳性样品,再利用乙醛酸途径抑制剂细胞水平筛选模型进行复筛,复筛的阳性率(抑制率达到50%以上)可达到90%(表1),说明2种模型的相关性较好。
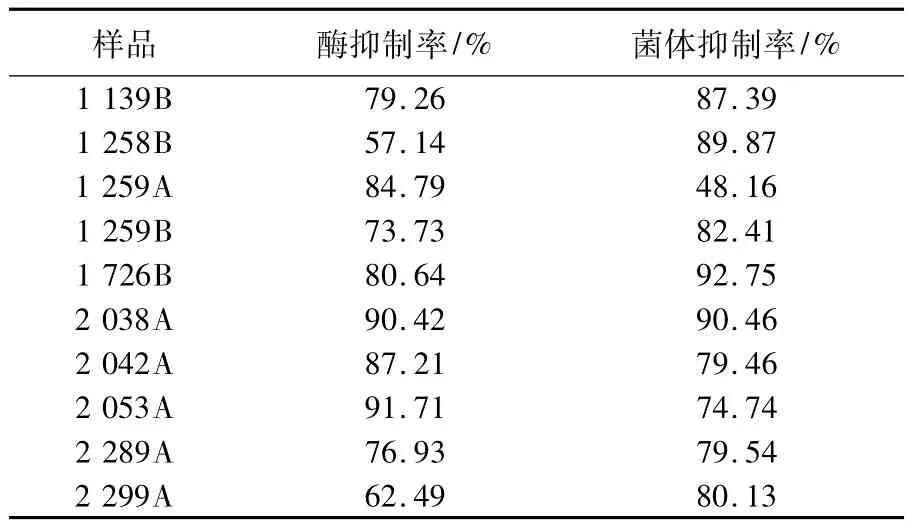
表1 不同样品对ICL和乙醛酸代谢途径的抑制率Table 1The inhibition ratio to ICL and glyoxalic acid pathway of differentive samples
3 讨论
异柠檬酸裂解酶(ICL)是乙醛酸循环的关键酶,对M.tuberculosis在巨噬细胞内的持留状态起关键作用[3]。以异柠檬酸裂解酶作为靶点筛选得到的抗结核药物不仅可以有效杀灭处于持留状态的M.tuberculosis,缩短结核病治疗疗程,同时由于哺乳动物体内不存在乙醛酸循环,因此以ICL为靶点开发的新药毒副作用较小。实验中针对ICL为靶点,先在酶(分子)水平后又在菌体(细胞)水平建立筛选模型,不仅是对样品活性的验证,还使筛选模型更接近于持留状态的M.tuberculosis,筛选结果更具有真实性、可靠性。
为了使ICL抑制剂筛选模型有较高的灵敏性,本实验中采用最适的酶促条件进行筛选反应,使反应体系敏感度高。在满足筛选要求的前提下,使用最少的酶量,以增加低浓度抑制剂的检出率。由于样品为微生物发酵液乙酸乙酯萃取物,成分复杂,在水相中溶解效果较差,会影响ICL抑制剂筛选模型的稳定性和可靠性。通过对多种溶剂的考察和对难溶样品的处理,模型的稳定性和可靠性明显增强。
Kerstin Höner Zu Bentrup等研究表明,使用改良的Dubos培养基可使M.tuberculosis利用乙酸盐作为唯一碳源,ICL表达水平上调,为在细胞水平上ICL抑制剂的筛选奠定基础。由于M.tuberculosis具有高致病性、高传染性,实验条件苛刻且生长速度缓慢等缺点,不利于大规模高通量筛选的实现,而同为分枝杆菌属的M.smegma为非致病性菌株,且生长周期较短,仅为3~4 h[7];另一方面,Vinita Chaturvedi等[8]评价了以M.smegma作为M.tuberculosis替代菌株的可行性,认为可以使用M.smegma进行MDR-TB药物的筛选。2001年开始的M.smegma基因组测序,发现M.smegma基因组中也存在异柠檬酸裂解酶基因,比较M.tuberculosis ICL序列和M.smegma ICL序列,可发现二者有很高的相似性。本实验表明,M.smegma在改良的Dubos培养基上也可使用乙酸盐为唯一碳源生长,因此本实验中使用M.smegma作为替代菌株,进行乙醛酸代谢途径抑制剂的筛选。
Sharma V等[9]发现ICL抑制剂3-硝基丙酸盐在以乙酸盐为唯一碳源的培养基上对野生型M.smegma以及基因重组的M.smegma(使用M.tuberculosis ICL基因替换野生型M.smegma基因组中的ICL基因)均有较强的抑制作用,而这一现象并未在以葡萄糖为唯一碳源的培养条件下观测到,证明了乙醛酸途径抑制剂细胞水平筛选模型的可行性,并在一定程度说明了酶水平筛选与菌体水平筛选的相关性。
[1]Cole ST,Brosch R,Parkhill J,et al.Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence[J].Nature,1998,393(6685):537-544.
[2]Kerstin Höner Zu Bentrup,Andras Miczak,Dana L.Swenson,et al.Characterization of Activity and Expression of Isocitrate Lyase in Mycobacterium avium and Mycobacterium tuberculosis[J].Bacteriol,1999,181(23):7161-7167.
[3]McKinney J D,Bentrup K H Z,Munoz-Elias E J,et al.Persistence of Mycobacterium tuberculosias in macropha ge and mice requires the glyoxylate shunt enzyme isocitrate lyase[J].Nature,2000,406(6797):735-738.
[4]王旸,肖春玲.以异柠檬酸裂解酶为靶点筛选抗持留结核分枝杆菌药物[J].中国抗生素杂志,2007,32(7):391-395.
[5]赖煦卉,王洪海,张雪莲.异柠檬酸裂解酶—新型抗结核药物靶标[J].中国感染控制杂志,2008,7(5):359-362.
[6]Ranaldi F,Vanni P,Giachetti E.Enzyme catalysis in microgravity:steady-state kinetic analysis of the isocitrate lyase reaction[J].Biophys Chem,2003,103(2):169-77.
[7]Reyrat JM,Kahn D Mycobacterium smegmatis:an absurd model for tuberculosis[J].Trends Microbiol,2001,9(10):472-473.
[8]Chaturvedi V,Dwivedi N,Tripathi RP,et al.Evaluation of Mycobacterium smegmatis as a possible surrogate screen for selecting molecules active against multi-drug resistant Mycobacterium tuberculosis[J].J Gen Appl Microbiol,2007,53(6):333-337.
[9]Sharma V,Sharma S,Hoener zu Bentrup K,et al.Structure of isocitrate lyase,a persistence factor of Mycobacterium tuberculosis[J].Nat Struct Biol,2000,7(8):663-668.
Establishment of New Screening Models for Anti-Mycobacterium tuberculosis Medicines
ZHANG Lei-lei1,YOU Peng-fei1,2,YAO Guang-xin1,HOU Jue1,ZHANG Yi-xuan1,2
(1.Teach.&Res.Div.of Bio-Pharm.,2.Biol.&Exp Teach.Ctr.,Shenyang Pharm.Uni.,Shenyang 110016)
Mycobacterium tuberculosis strain H37Rv genomic DNA was adopted as a template to establish a screening model targeting to isocitrate lyase(ICL)and glyoxylate pathway for anti-TB drugs at enzymatic and cellular levels.ICL gene was amplified by polymerase chain reaction(PCR)and constructed an expression vector and highly expressed in E.coli BL21(DE3).The recombinant ICL was purified with Ni2+-NTA resin affinity chromatography and detected for its activity.The ICL enzymatic reaction conditions were optimized,and observed the effects of solvents on the enzymatic activity of the samples of going to screen to establish a screening model at the level of inhibition enzyme; observed and optimized the growth conditions of M.smegmatis(Ms)in medium with acetate as a sole carbon source,to establish a screening model at cellular level based on inhibitor of glyoxylate pathway of Ms.The results showed that using the two screening models above-mentioned 1060 kinds of microbial metabolite samples in the lab possibly possessing antagonistic activity were screened initially and rescreened,and both the screened results had fairly good positive reciprocity.
Mycobacterium tuberculosis;isocitrate lyase;Mycobacterium smegmatis;glyoxylate pathway;screening model
Q939-92
A
1005-7021(2011)01-0057-06
国家重大新药创制专项(2009ZX09301-012)资助
张磊磊男,硕士。研究方向为微生物活性代谢产物的筛选。E-mail:zhll1986211@163.com
*通讯作者。Tel:024-23984102,E-mail:zhangyxzsh@163.com
2010-12-25;
2011-01-21

