取代基酞菁铜的合成与表征
夏道成,姚纪欢,韩 双,马会宣,刘慧景
(1.运城学院化学系,山西运城 044000; 2.东北师范大学化学学院,吉林长春 130012)
XIA Dao-cheng1,2,YAO Ji-huan1,HAN Shuang1,MA Hui-xuan1,LIU Hui-jing1
(1.Department of Chemistry,Yuncheng University,Yuncheng Shanxi,044000;2.School of Chemistry,Northeast Normal University,Jilin Changchun,130021)
取代基酞菁铜的合成与表征
夏道成1,2,姚纪欢1,韩 双1,马会宣1,刘慧景1
(1.运城学院化学系,山西运城 044000; 2.东北师范大学化学学院,吉林长春 130012)
首先以3,6-二羟基邻苯二甲腈和氯代正丁烷为起始反应物,在无水碳酸钾的催化作用下,经亲核取代反应,在DMF(N,N-二甲基甲酰胺)溶剂中合成了中间配体3,6-二丁氧基邻苯二腈,再以此配体和氯化亚铜为前体,采用DBU液相催化法合成了周边烷氧基取代的1,4,8,11,15,18,22,25-八丁氧基酞菁铜,经过元素分析、红外、荧光、紫外可见光谱和原子吸收表征证明,产物就是目标化合物取代基酞菁铜。
邻苯二甲腈;酞菁;合成;红外光谱;表征
酞菁(Phthalocyanine)被发现距今已有百年历史,而赋予它酞菁之名是在1933年。随着研究的不断深入,该领域在数十年间得到了迅速发展,迄今已有5 000多种酞菁类化合物被合成,其用途也由最初的有机颜料和染料扩展到更多的领域。酞菁或金属酞菁特有的分子结构决定了它们可以被多种基团以不同方式取代,因而制备出了大量的取代衍生物。基团取代改变了分子的结构,结构的不同引起性质和功能的变化。通常,酞菁的共轭体系指的是由18-π电子芳香云离域体系组成的,是由9个C=N共轭双键组成的体系,这9个碳氮或C=C共轭双键“围成”酞菁分子中心空穴。酞菁各种优异的光电性质都来源于其共轭体系的电子离域效应,酞菁类配合物的各种改性拓宽了其研究领域和应用范围,目前关于酞菁类配合物的应用大部分集中在光电性能研究,诸如光记录介质、电子照相、液晶性能、光动力医疗等方面[1-17]。我们首次利用液相催化法合成新型八取代基的酞菁。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
TENSOR27傅立叶红外光谱仪,德国布鲁克公司;UV-7504C紫外可见分光光度计,上海欣茂仪器有限公司;F-4600型荧光分光光度计,日本日立公司;TAS-990 Super AFG原子吸收分光光度计,北京普析通用仪器有限责任公司;QUSTARTOF质谱仪,美国应用生物系统公司;AVANCE500型核磁共振仪,瑞士BRUKER公司;Flash EA1112元素分析仪,意大利卡拉尔巴公司;DS-3微量元素分析仪,山东济宁东盛电子仪器有限公司;CE440型有机元素分析仪,美国EAI公司。
1.1.2 试剂
3,6-二羟基邻苯二甲腈、DMF(N,N-二甲基甲酰胺)、氯代正丁烷、正戊醇、DBU、无水碳酸钾为天津市大茂化学试剂厂产品;甲醇为天津市瑞金特化学品有限公司产品;氯化亚铜为北京化工厂产品。试剂均为分析纯。
1.2 实验过程
1.2.1 配体3,6-二丁氧基邻苯二腈的合成
在100mL三颈瓶中依次加入1.3g(8mmol)3,6-二羟基邻苯二甲腈,4.5g(32mmol)无水碳酸钾,46mL DMF,3.1mL氯代正丁烷,通入氮气,控制温度在95℃左右搅拌8h。冷却后,将反应混合物倒入盛有冰水的烧杯中,立即出现浅褐色沉淀,经抽滤,水洗至中性,干燥,乙醇重结晶得白色固体3,6-二丁氧基邻苯二腈,见图1。

图1 3,6-二丁氧基邻苯二腈的合成路线
1.2.2 八丁氧基酞菁铜的合成
在装有冷凝管和导气管的100mL三颈瓶中,依次加入0.97g(3.68mmol)3,6-二丁氧基邻苯二甲腈、0.092g(0.92mmol)氯化亚铜、1.5mL(10.0mmol)DBU(1,8-二氮杂-双环(5,4,O)-7-十一碳烯)和10mL正戊醇,通入氮气,加热回流12h。反应结束后,蒸除大部分溶剂,冷却后加入100mL甲醇,放置过夜,用玻璃砂芯漏斗抽滤,用甲醇反复洗涤沉淀至洗出液为淡蓝色,得蓝色固体,见图2。

图2 酞菁铜的合成路线
2 结果与讨论
2.1 合成
本文采用3,6-二羟基邻苯二甲腈与氯代正丁烷在碱性条件下发生亲核取代反应合成分子碎片3,6-二丁氧基邻苯二腈,然后以该分子碎片为原料,采用DBU液相催化法,利用正戊醇作反应溶剂,在135℃条件下制得蓝色固体。所得到的固体用无水甲醇在索氏提取器中提取12h,从而合成了比较纯的周边烷氧基取代的1,4,8,11,15,18,22,25-八丁氧基酞菁铜。
2.2 元素分析
元素分析,C64H80CuN8O8:理论值(%)C,66.67;H,6.99;Cu,5.51;N,9.72;O,11.10;实验值(%)C,66.00;H,6.54;Cu,5.91;N,9.44;O,11.45。测定值与理论值相吻合。
2.3 红外光谱表征
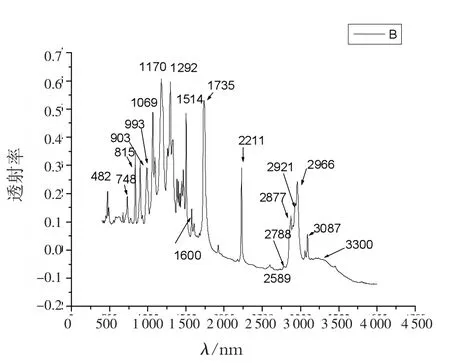
图3 酞菁铜的红外光谱图
从红外光谱图中可以看出,νO—H的伸缩振动吸收峰在3 400~3 200cm-1出现一个宽的吸收峰。νN—H伸缩振动出现在3 087cm-1,νCH3的伸缩吸收出现在2 966cm-1和2 877cm-1附近;ν-CH2基的吸收在2 921cm-1和2 789cm-1附近,但强度很弱。νC=N的伸缩振动在共轭的情况下出现在2 211cm-1附近,若分子中含有C,H,N原子,νC=N吸收比较强而尖锐。苯衍生物的泛频谱带,出现在1 735cm-1范围,是C—H面外和C =C面内变形振动的泛频吸收的;在1 600cm-1,1 514cm-1处的特征吸收峰归属于苯环的骨架变形振动;1 292cm-1处的强吸收峰归属于芳基醚的伸缩振动吸收;1 170,1 069cm-1是C—O、C—N单键的伸缩振动。
2.4 紫外光谱表征
从表1紫外测试数据和图4紫外可见吸收光谱图,可以清晰地看到取代基酞菁铜的特征吸收峰,即Q带是在740nm处,B带是在340nm处,并且在670nm左右出现一个小峰为取代基酞菁铜的二聚体吸收峰。

表1 紫外数据

图4 酞菁铜的紫外可见光谱图
2.5 荧光光谱表征
从图5可以看出,取代基酞菁铜的荧光发射光谱图中有一个特征吸收峰,在560nm处。由于酞菁类化合物是高度P-π共轭的大环化合物,很容易产生电子跃迁至激发态,金属酞菁一般在500~750nm之间有很强的荧光发射峰,所以可知图中这个峰为取代基酞菁铜的荧光发射光谱峰。

图5 酞菁铜的荧光光谱图
2.6 原子吸收表征
经原子吸收定性分析可知,在所合成的酞菁环的空腔中含有铜。通过原子吸收测试得出,在最大吸收峰处测得铜的含量为5%。
2.7 结构分析
酞菁的结构式经Chem 3D Ultra 8.0软件进行分子势能最小化计算,得出了如图6所示的结构图,这将有助我们更清楚地了解它们的结构。

图6 酞菁铜的结构图
3 结论
我们先采用3,6-二羟基邻苯二甲腈与氯代正丁烷在碱性条件下发生亲核取代反应合成分子碎片3,6-二丁氧基邻苯二腈,然后以该分子碎片为原料,采用DBU液相催化法,利用正戊醇作反应溶剂合成了比较纯的周边烷氧基取代的1,4,8,11,15,18,22,25-八丁氧基酞菁铜。通过元素分析、红外光谱、紫外-可见光谱、荧光光谱和原子吸收对其结构进行了表征,证明所合成的产物为目标产物。
[1]干福熹.数字光盘和存储技术[M].上海:上海科技出版社,1992.
[2]唐福龙,沈淑引.旋涂法制备可溶性酞菁薄膜的光存储性能研究[J].中国激光,1995(11):853-856.
[3]孙强,邓桂胜,姚小华.双核磺化酞菁酮(Ⅱ)催化氧化α-萘酚[J].有机化学,1996,16(1):83-87.
[4]Parton R F,Vankelecomlvo F J,Casselman M J A,et al.An efficient mimic of cytochrome P-450 from a Zeolite-Enegaged Fe complex in a polymer membrance[J].Nature,1994(370):541-544.
[5]袁渭清.从绿叶到激光光盘:颜色与化学[M].北京:清华大学出版社,2000.
[6]夏道成,马春雨,程传辉,等.新型四取代酞菁及金属酞菁的合成与表征[J].山西大学学报:自然科学版,2007,30(4):493-497.
[7]Xia D,Yu S K,Shen R S,et al.A novel method for the direct synthesis of crystals ofcopper phthalocyanine[J].Dyes and Pigments,2008(78):84-88.
[8]夏道成,程传辉,夏到鹏,等.铒酞菁的合成及光学性质研究[J].山西大学学报:自然科学版,2009,32(1):91-95.
[9]James S,Shirk J R,Lindle F J,et al.Third-order optical nonlin-earities of bis-(phthalocyanines)[J].Phys Chem,1992:96(14):5847-5852.
[10]陈鹏磊,王东军,王小兵,等.一个对称萘酞菁的LB膜及其二阶非线性光学性质的研究[J].无机化学学报,2001,17(2):269-274.
[11]刘颖,左霞.四溴-2,3-萘酞菁锌(Ⅱ)的合成及非线性光限幅特性[J].应用化学,2000,17(5):569-571.
[12]谢丹,蒋亚东.一种新型气敏传感器的研究[J].电子学报,2001,29(8):1083-1085.
[13]施国跃,陆华.电化学聚合四氨基钴酞菁修饰一氧化氮超微传感器的研究[J].云南大学学报,2000,22(6):449-452.
[14]金尚德,关景文.新型可溶性酞菁铜(Ⅱ)衍生物的合成.结构及其成膜性[J].应用化学,1992,9(3):20-25.
[15]Van Slyke S A,Chen C H,Tang C W.Organic electroluminescent devices with improved stability[J].Appl Phys Lett,1996,69(15):2160-2162.
[16]Zhang Z,Jiang X,Xu S,et al.Stability enhancement of organic electroluminescent diode through buffer layer or rubrene doping in hole-transporting layer[J].Synth Met,1997(81):131.
[17]姜建壮,刘伟,林吉茂,等.不对称二层及三层三明治金属卟啉,酞菁配合物的研究进展[J].化学通报,1997(7):14-20.
XIA Dao-cheng1,2,YAO Ji-huan1,HAN Shuang1,MA Hui-xuan1,LIU Hui-jing1
(1.Department of Chemistry,Yuncheng University,Yuncheng Shanxi,044000;2.School of Chemistry,Northeast Normal University,Jilin Changchun,130021)
〔编辑 杨德兵〕
Synthesis and Characterization for Substituents Copper(Ⅱ)Phthalocyanine
In this article,we first take 3,6-dihydroxy-phthalonitrile and chlorinated n-butane as the starting reactants to prepare 1,4,8,11,15,18,22,25-octa-butoxy copper phthalocyanine,3,6-dibutoxy phthalonitrile were prepared through nucleophilic substitution reaction in the solvent of DMF under the catalysis of anhydrous potassium carbonate.The mixture of 3,6-dibutoxy phthalonitrile and CuCl were used as precursors to synthesis 1,4,8,11,15,18,22,25-octa-butoxy copper phthalocyanine which was generated by cyclotetramerisation in the presence of 1,8-diazabicyclo[5.4.0]undec-7-ene(DBU).At last,the compound was characterized by elemental analysis,infrared,fluorescence and UV-visible spectrum and atomic absorption,which were proving its structure.Thus confirmed that the product was the target compound.
phthalonitrile;phthalocyanine;synthesis;infrared spectrum;characterization
O613.2
A
1674-0874(2011)02-0030-04
2010-09-23
国家自然科学基金资助项目[61006034];山西省青年基金资助项目[2010021010-3];运城学院院级重点项目[975175];东北师范大学校内博士后项目[111900026]
夏道成(1976-),男,山东潍坊人,博士,副教授,研究方向:酞菁合成。
book=33,ebook=38

