肉桂水提液对大鼠全脑缺血再灌注损伤的保护作用
黄宏妙, 郭占京, 罗佩卓, 梁晓艳, 周丽霞
(广西中医学院药学院,广西南宁530001)
脑缺血再灌注损伤是一个复杂的病理过程,其中自由基连锁反应是脑缺血再灌注损伤的核心环节[1]。通过增强机体内抗氧化物酶活性、清除氧自由基来减轻缺血再灌注造成的损伤已成为治疗缺血性脑血管病的主要途径。肉桂为樟科植物肉桂Cinnamomum cassia Presl的干燥树皮,是我国传统中药,具有补火助阳、引火归元、散寒止痛、温通经脉的功能[2]。大量研究表明肉桂具有很强的抗氧化作用,且毒副作用低,但是从目前文献来看肉桂在抗氧化作用方面的研究只是体外实验[3-6],对于其体内实验研究尚很少报道。本研究考察了肉桂水提液对全脑缺血再灌注损伤后大鼠脑水肿的影响,并测定了脑组织中丙二醛(MDA)水平、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)活性的变化,初步确定了肉桂对急性脑损伤的保护作用。
1 材料与方法
1.1 药物与试剂 双缩尿试剂、丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)活力测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)活力测定试剂盒均为南京建成生物工程研究所产品(批号20090416);肉桂药材(板桂)购于广西万寿堂药业有限公司(生产日期200812011,产地 广西平南县),经广西中医学院刘寿养教授鉴定为樟科植物肉桂Cinnamomum cassia Presl的干燥树皮。
1.2 动物 健康SD大白鼠,雌性,体质量(200±10)g,由广西医科大学实验动物中心提供,合格证号:SCXK(桂)2009-0002。
1.3 主要仪器 紫外可见分光光度计UV-160(日本shimadzu公司);江弯-Ⅰ型C通用立体定向器(第二军医大学)。
1.4 肉桂水提液的制备 将干燥肉桂捶碎,分别称取干燥碎块150、300、600 g,用8 倍量纯净水浸泡 3 h,文火加热煮沸30 min,滤出水煎液,继续分别加6倍量纯净水再煮1次,合并2次水煎液,浓缩至150 mL(相当于生药1、2、4 g/mL),给药量为10 m L/kg(各剂量相当于肉桂质量/大鼠质量:10、20、40 g/kg)。
1.5 动物分组与全脑缺血再灌注模型的建立 取健康SD雌性大白鼠50只,随机平均分5组:正常组、模型组和低剂量给药组(10 g/kg)、中剂量给药组(20 g/kg)和高剂量给药组(40 g/kg)。给药组按低、中、高各剂量肉桂水提液灌胃给药;正常组和模型组按等量生理盐水(水量/大鼠质量:10 mL/kg)灌胃。灌胃1周后模型组和给药组采用改良的Pulsineli4-血管阻断(4-VO)方法[7]建立全脑缺血模型,正常组不做手术。动物模型具体操作及组织匀浆制备按文献[8]方法进行。
1.6 干湿重法测定大鼠脑水肿[9]大鼠再灌注24 h后,将大鼠断头取出全脑,左右脑分开,取缺血侧大脑,去除小脑、低位脑干和嗅球,立即称湿质量。然后将脑组织烘干(105℃,24 h),再称干质量。按干湿重法求出脑组织含水量,脑组织含水量计算公式:脑组织含水量(%)=(脑湿质量-脑干质量)/脑湿质量×100% 。
1.7 蛋白质、MDA、SOD、GSH-PX的测定 分别参照蛋白定量(考马斯亮兰法)测试盒、MDA测试盒、SOD测试盒、GSHPX测试盒说明书进行测定。
2 结果
2.1 肉桂水提液对大鼠脑水肿的影响 大鼠脑缺血再灌注后,缺血侧脑组织中的含水量明显增加(P<0.01),各剂量给药组大鼠脑组织中的含水量与模型组比较显著降低(P<0.05或 P <0.01)。结果见表1。
表1 肉桂水提液对大鼠脑水肿的影响 ( ± s)

表1 肉桂水提液对大鼠脑水肿的影响 ( ± s)
注:与正常组比较,#P <0.05或##P <0.01;与模型组比较,*P <0.05或**P <0.01(下表同)。
组别 正常组 模型组 给药组剂量/(g/kg)10 20 40脑组织含水量/% 78.59 ±0.65 81.32 ±0.60## 80.45 ±0.55* 79.51 ±0.38** 78.99 ±0.41**
2.2 肉桂水提液对大鼠脑组织中MDA、SOD和GSH-PX的影响 MDA是氧自由基引起脂质过氧化的终产物,是反映氧自由基损害程度的重要指标;SOD和GSH-PX是机体中重要的抗氧化酶,是自由基清除系统的重要组成成分。从表2可知,大鼠全脑缺血再灌注手术后,脑组织中MDA水平均明显增大(P<0.01),提示脑缺血再灌注后使自由基增加而导致机体过氧化脂质增高;而各剂量给药组的MDA水平均显著低于模型组(P<0.01),说明肉桂水提液对机体脂质过氧化物的产生有一定抑制作用。与正常组比较,模型组的SOD和GSH-PX活性明显降低(P<0.05或 P<0.01),表明脑缺血再灌注损伤后大鼠脑组织中的SOD和GSH-PX活性显著降低;而肉桂水提液各剂量给药组的SOD活性比模型组明显升高(P<0.05或 P<0.01),其中以低剂量组的效果最好;中剂量和高剂量给药组GSH-PX活性比模型组升高具有一定的显著性差异(P<0.05)。
表2 肉桂水提液对大鼠脑组织匀浆MDA、SOD和GSHPX的影响 ( ± s)
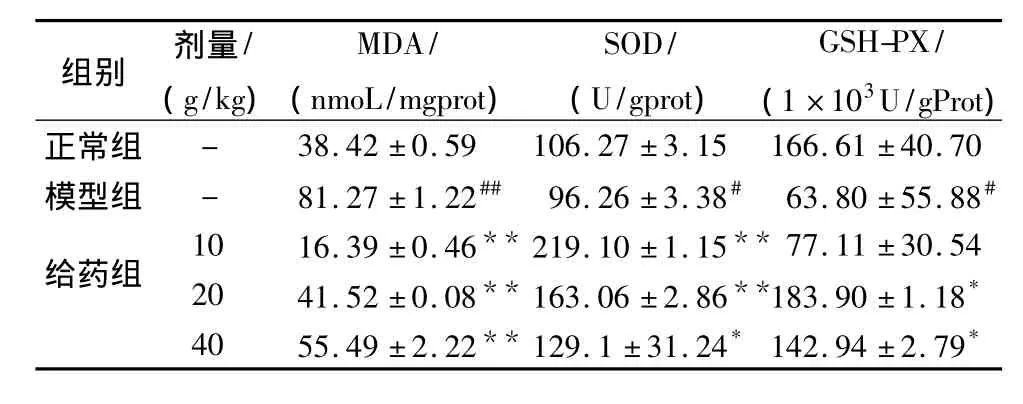
表2 肉桂水提液对大鼠脑组织匀浆MDA、SOD和GSHPX的影响 ( ± s)
组别 剂量/(g/kg)MDA/(nmoL/mgprot)SOD/(U/gprot)GSH-PX/(1×103U/gProt )正常组 - 38.42 ±0.59 106.27 ±3.15 166.61 ±40.70模型组 - 81.27 ±1.22## 96.26 ±3.38# 63.80 ±55.88#给药组10 16.39 ±0.46** 219.10 ±1.15** 77.11 ±30.54 20 41.52 ±0.08** 163.06 ±2.86**183.90 ±1.18*40 55.49 ±2.22** 129.1 ±31.24*142.94 ±2.79*
3 讨论
脑水肿是缺血性损伤的主要病理变化之一,因而减轻脑水肿是改善缺血性脑损伤的重要标志之一[10]。研究证实,肉桂水提液通过减轻缺血区脑组织水肿而明显降低脑含水量,与模型组比较有显著性差异(P<0.05或P<0.01),从而对缺血性脑损伤具有一定的保护作用。
缺血再灌注损伤的机制,与氧自由基关系密切。大量研究已证实脑缺血再灌注后产生大量自由基,大量自由基氧化细胞内的脂质、蛋白质和核酸,可引起细胞的损伤和死亡,所以自由基的作用是缺血再灌注损伤的重要发病学环节[11-12]。本研究发现,肉桂水提液能显著减低大鼠脑组织中MDA的水平(P<0.01),并同时显著提高 SOD(P<0.05或 P<0.01)和GSH-PX(P<0.05)的活性,对缺血性脑损伤具有一定的保护作用。
[1]Sugawara T,Chan P H.Reactive oxygen radicals and pathogenesis of neuronal death after cerebral ischemia[J].Antioxid Redox Signal,2003,5(5):597.
[2]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:127-128.
[3]吴雪辉,黄永芳,高 强,等.肉桂精油的抗氧化作用研究[J].食品科技,2007(4):88.
[4]谢学明,钟远声,李熙灿,等.22种华南地产药材的抗氧化活性研究「J].中药药理与临床,2006,22(1):48-50.
[5]顾仁勇,傅伟昌,李佑稷,等.肉桂精油抑菌及抗氧化作用的研究[J].食品研究与开发,2008,29(10):29-31.
[6]潘海燕,钟碧琳,洪英贤.花椒、肉桂对食用菜油的抗氧化作用[J].山地农业生物学报,2003,22(1):40.
[7]PulsineliW A,Brieley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267.
[8]黄宏妙,李 灵,郭占京,等.板栗毛壳水提液对大鼠脑缺血再灌注损伤后羟自由基、NO和GSH-Px的影响[J].时珍国医国药,2010,21(11):2917-2918.
[9]何 蔚,刘建新,周钰梅,等.蛇床子素对大鼠脑缺血/再灌注损伤的保护作用及其机制[J].中国药理学杂志,2008,24(11):1528-1530.
[10]Lo A C,Chen A Y,Hung V K,et al.Endothelin-1 over expression leads to further water accumulation and brain edema after middle cerebral artery occlusion via aquaporin expression in astrocytic end-feet[J].JCereb Blood Flow Metab,2005,25:998.
[11]Young C,Tenkova T,Dikranian k,etal.Excitotoxic versus apoptotic mechanisms of neuronal cell death in perinatal hypoxia/ischemia[J].Curr Mol Med,2004,4(2):77-85.
[12]陈 瑗,周 玫.自由基医学基础与病理生理[M].北京:人民卫生出版社,2002:14-70.

