卡泊芬净、米卡芬净对念珠菌体外药物敏感性的动态研究
曾荣 李岷 陈青 王乐 吕桂霞 沈永年 蔡晴 李彩霞 唐荣才 刘维达
(1.中国医学科学院北京协和医学院皮肤病研究所,南京 210042;2.江苏省血液中心,南京 210042)
近年来,各种因素造成深部真菌感染发病率逐年上升。据报道在美国超过72%的院内真菌感染为念珠菌所致,且在引起院内血液播散感染的病原体中念珠菌排第4位[1]。新型抗真菌药物棘白菌素类药物 (Echinocandins)作为真菌细胞壁结构β-(1→3)-葡聚糖合成酶抑制剂,它能够通过破坏真菌细胞壁结构而杀伤真菌细胞。念珠菌在此类药物长时间作用下能否出现耐药情况尚无报道。本研究旨在初步探索和评价卡泊芬净(caspofungin,CAS)、米卡芬净 (micafungin,MICA)长时间作用念珠菌时的抗菌作用情况,国内外相关研究尚少见报道。
1 材料和方法
1.1 菌株来源
85株念珠菌均来自于中国微生物菌种保藏管理委员会医学真菌中心,其中白念珠菌20株 (23.5%),光滑念珠菌25株 (29.4%),近平滑念珠菌12 株 (14.1%),热带念珠菌8 株 (9.4%),都柏林念珠菌6株 (7.1%),乳酒念珠菌3株 (3.5%),季也蒙念珠菌3株 (3.5%),克柔念珠菌3株 (3.5%),皱落念珠菌、维斯旺念珠菌、葡萄牙念珠菌、星形念珠菌、C.chiropterorum各1株 (1.2%)。以上包含2株药物敏感质控菌株,分别为克柔念珠菌ATCC6258和近平滑念珠菌ATCC22019。
1.2 药物和培养基
卡泊芬净 (Merck,本文缩写为CAS),米卡芬净 (Fujisawa,缩写为 MICA),氟康唑 (Ffizer,缩写为FLZ),药物均由药厂惠赠。RPMI 1640培养基(Gibco,批号867884)。
1.3 方法
参照CLSI(Clinical and Laboratory Standards Institute,原NCCLS)推荐的微量液基稀释法M27-A2 方案实施[2]。CAS、MICA 稀释终浓度为0.03 ~32 μg/mL,FLZ 稀释终浓度为 0.125 ~128 μg/mL,置于药物敏感测试96孔板中,每孔100 μL。
真菌悬液的制备和接种 受试菌株先转种至沙堡弱斜面培养基,35℃培养24 h。活化后,取菌落于无菌生理盐水中研磨,血球计数板计数,调整菌悬液浓度至 (1~5)×106CFU/mL。用 RPMI 1640液体培养基将上述菌液稀释1 000倍后加入药物敏感测试板中,每孔100 μL。实验重复3次,每次实验均检测质控株的MIC值范围,若在质控范围内,方可认为本次实验结果可靠。
终点判定 接种后的药物敏感测试板置于35℃恒温培养箱中培养。CAS、MICA组于24 h、48 h、72 h、96 h、120 h、144 h 和 168 h,FLZ 组于 48 h观察结果,均采用倒置镜下肉眼判读MIC值。药物敏感终点判读参照M27-A2中微量液体培养基稀释法的标准,FLZ MICs按照唑类药物以80%抑制和100%抑制为观察终点;CAS、MICA MICs结果为便于与国内外同行所得结果进行比较,故以50%、90%抑制为观察终点。
1.4 统计学处理
采用SPSS 18.0分析处理数据。MICs值采取取中位数的方法计算。
2 结 果
2.1 48 h卡泊芬净、米卡芬净、氟康唑体外对念珠菌的作用
CAS、MICA对85株念珠菌的作用结果见表1~2。48 h CAS对白念珠菌、光滑念珠菌及其他念珠菌 MIC50、MIC90分别为 0.03 μg/mL、0.03 μg/mL,0.06 μg/mL、0.125 μg/mL,0.125 μg/mL、0.5 μg/mL。48 h MICA对白念珠菌、光滑念珠菌及其他念珠菌 MIC50、MIC90分别为 0.03 μg/mL、0.03 μg/mL,0.06 μg/mL、0.06 μg/mL,0.25 μg/mL、0.5 μg/mL。48 h FLZ对白念珠菌、光滑念珠菌及其他念珠菌 MIC80、MIC100分别为 2 μg/mL、128 μg/mL,64 μg/mL、128 μg/mL,2 μg/mL、32 μg/mL。
2.2 动态观测卡泊芬净、米卡芬净体外对念珠菌的作用
多个时间点动态观测得出图1~3所示现象。卡泊芬净组白念珠菌MIC50、MIC9024 h后不再升高。光滑念珠菌24 h和48 h MIC50均为0.06 μg/mL,而 72 h 升高至 0.125 μg/mL,之后不再升高;MIC90在24 h 和48 h 均为0.125 μg/mL,72 h 和96 h 均为0.25 μg/mL,至120 h 升高为0.5 μg/mL 后不再升高。其他念珠菌组24 h和48 h MIC50中位数均为 0.125 μg/mL,72 h 为 0.25 μg/mL,96 h、120 h、144 h 均为 0.5 μg/mL,168 h 升高为 1 μg/mL。MIC9024 h 为0.25 μg/mL,48 h、72 h 均为 0.5 μg/mL,96 h 为1 μg/mL,之后不再升高。米卡芬净组白念珠菌、光滑念珠菌MIC50、MIC9024 h后不再升高。其他念珠菌组 MIC5024 h为0.125 μg/mL,48h为0.25μg/mL,72h为1μg/mL,之后不再升高。MIC90在24 h 为 0.125 μg/mL,48 h 为 0.5 μg/mL,72 h 为 1 μg/mL,之后不再升高。
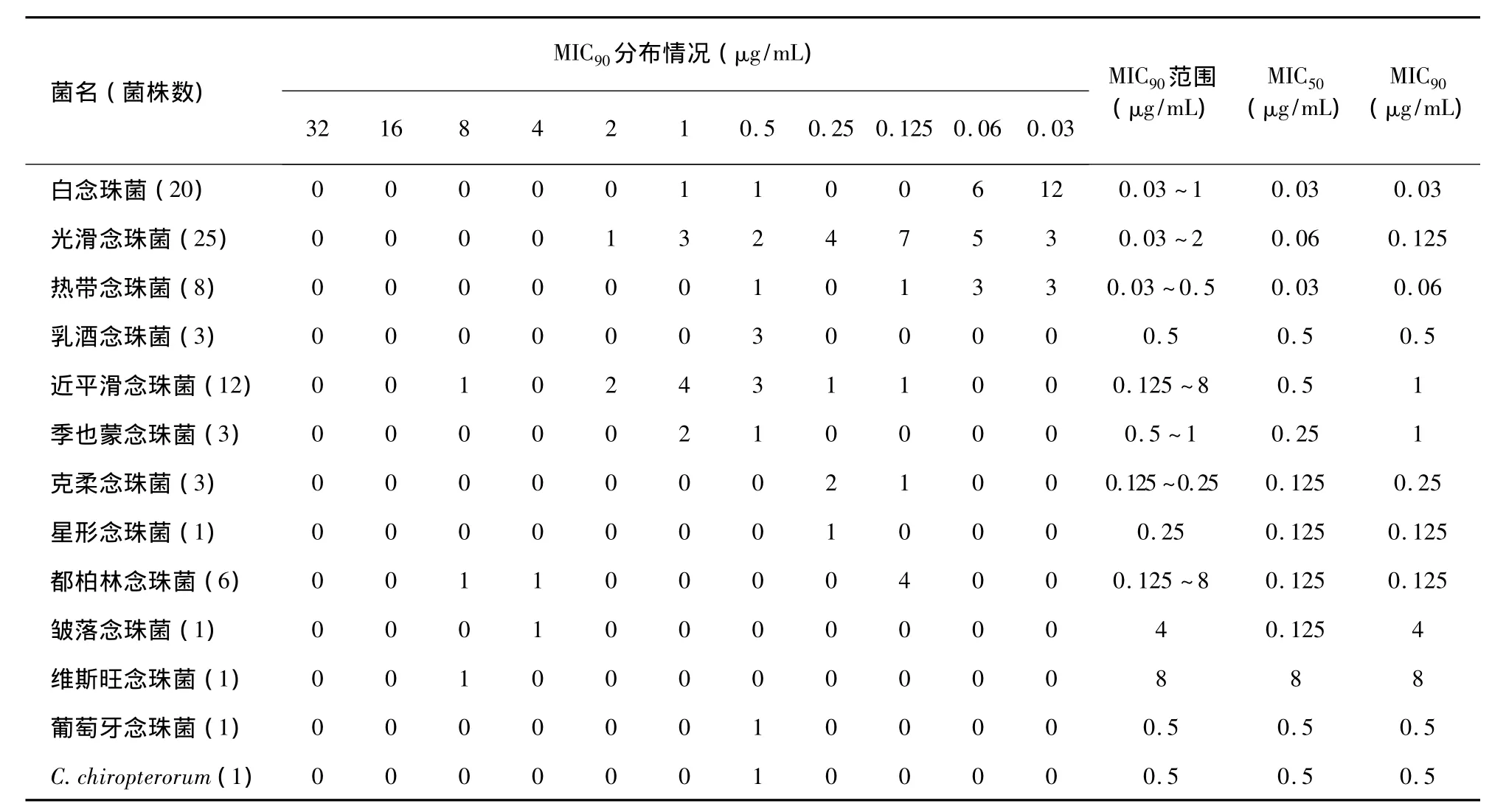
表1 48 h CAS体外抗85株念珠菌MICs测定结果Tab.1 MICs of 85 isolates of Candida to CAS in vitro after 48 hours

表2 48 h MICA体外抗85株念珠菌MICs测定结果Tab.2 MICs of 85 isolates of Candida to MICA in vitro after 48 hours
2.3 耐药情况分析
参考 CLSI M27-A2方案判定标准,氟康唑MIC80≤8 μg/mL 为敏感 (S),MIC80介于 16 ~ 32 μg/mL之间为剂量依赖敏感 (S-DD),MIC80≥64 μg/mL为耐药 (R)。参考相关研究我们设定CAS、MICA MIC90≤2 μg/mL 为敏感 (S),MIC90>2 μg/mL 为耐药 (R)[3]。
FLZ组有19株耐药菌株,其中光滑念珠菌14株,白念珠菌3株,克柔念珠菌2株。CAS组共有5株耐药菌株,分别为都柏林念珠菌2株,近平滑念珠菌、皱落念珠菌、维斯旺念珠菌各1株。12株近平滑念珠菌有7株MIC90≥1 μg/mL。MICA组有1株耐药菌,为白念珠菌。12株近平滑念珠菌有9株MIC90≥1 μg/mL,明显高于其他类型念珠菌。85株念珠菌体外药敏实验中对FLZ耐药的菌株对CAS、MICA均较敏感。未见同时对 CAS、MICA、FLZ耐药的菌株。各菌株对CAS、MICA的敏感性较一致。
3 讨 论
棘白菌素类抗真菌药是一种新型抗真菌药物,能够特异性结合念珠菌细胞壁结构β-(1→3)-葡聚糖合成酶,引起细胞壁结构破坏,最终导致菌体破坏、死亡。由于其抗真菌作用较强、对人体的毒性低,故此类药物如CAS、MICA已逐步应用于临床治疗侵袭性念珠菌病[4-5]。
Macro等[6]利用CAS对400株念珠菌临床分离株进行体外药敏实验得出MIC50、MIC90分别为0.06 μg/mL、0.25 μg/mL。本研究 48 h MICs 结果与其结果基本一致。Pfaller[3]利用 MICA对5 346株念珠菌进行体外药敏实验得出 MIC50、MIC90分别为 0.015 μg/mL、1 μg/mL。国内乔建军等[7]利用米卡芬净对86株念珠菌体外药敏实验得出 MIC50、MIC90分别为 0.125 μg/mL、4 μg/mL。本研究48 h结果 MIC50、MIC90值分别为0.06 μg/mL、0.06 μg/mL,MIC50与上述结果相近,而 MIC90结果相对较低。Pfaller[3]等发现 99%以上念珠菌菌株在CAS、MICA药物浓度≤2 μg/mL内被抑制;而近平滑念珠菌、季也蒙念珠菌在CAS作用时仅分别有92.5%、95.1%被抑制;而在MICA作用时分别有100%、100%被抑制。本研究中也发现了近平滑念珠菌和季也蒙念珠菌比其他类型念珠菌MICs值高,耐药情况多,结果与Pfaller基本一致。但是同时还发现在待检的6株都柏林念珠菌中有2株CAS MIC90>2 μg/mL,耐药比例达33%,这与Pfaller[3]的研究都柏林念珠菌对卡泊芬净的敏感株>99%不相符合。出现这种原因可能与本研究样本量较少,念珠菌种类分布不同,结果判读不同,或是存在地域差异有关。未出现同时对CAS、MICA、FLZ耐药的菌株,对FLZ耐药的念珠菌对CAS、MICA均较敏感,这与我们之前的研究一致[8]。
本研究根据微量液体稀释法(M27-A2)方案,48 h为结果观测点。为探索和评价卡泊芬净、米卡芬净长时间作用念珠菌时的抗菌作用情况,故将观察结果时间做了适当延长。结果发现MICs有不同程度的升高,CAS组较MICA明显,其他念珠菌组较白念珠菌、光滑念珠菌明显。体外CAS、MICA作用于白念珠菌48 h后MIC50、MIC90无明显变化。而其他念珠菌组在体外CAS处理后MICs 72 h后趋于稳定,在体外MICA处理后MICs在96 h后趋于稳定。Barry[9]等将卡泊芬净体外作用于近平滑念珠菌和克柔念珠菌,分别于24 h和48 h观察结果,发现后一时间观测点的MICs较前者升高了一个浓度梯度。这与本研究的结果相一致。至于48 h后结果,目前尚无相关研究报道,其准确性有待于更大样本量的检验。出现48 h后菌落继续生长的原因可能是菌落并未完全杀伤,残存菌落继续生长所致。
本研究结果表明棘白菌素类药物卡泊芬净、米卡芬净对念珠菌有均有较好的抗菌作用,其中对白念珠菌、光滑念珠菌作用更强。动态观察所得药敏结果可为棘白菌素类药物的体外药敏实验提供参考,也有可能有利于治疗方案的改进。今后的研究中,还将收集更多种类、数量及不同来源的临床菌株进行深入研究。
[1]Pfaller MA,Diekema DJ.Epidemiology of invasive candidiasis:a persistent public health problem[J].Clin Microbiol Rev,2007,20(1):133-163.
[2]National committee for Clinical laborataory Standards.Reference method for broth dilution antifungal susceptibility testing of yeasts[S].Approved standard M27-a.1997.
[3]Pfaller MA,Boyken L,Hollis RJ,et al.In vitrosusceptibility of invasive isolates ofCandidaspp.to anidulafungin,caspofungin,and micafungin:six years of global surveillance[J].J Clin Microbiol,2008,46(9):3184-3185.
[4]Mora-Duarte J,Betts R,Rotstein C,et al.Comparison of caspofungin and amphotericin B for invasive candidiasis[J].N Engl J Med,2002,347(25):2020-2029.
[5]Pappas PG,Rotstein CM,Betts RF,et al.Micafungin versus caspofungin for treatment of candidemia and other forms of invasive candidiasis[J].Clin Infect Dis,2007,45(7):883-893.
[6]Marco F,Pfaller MA,Messer SA,et al.Activity of MK-0991(L-743,872),a new echinocandin,compared with those of LY303366 and four other antifungal agents tested against blood stream isolates ofCandidaspp.[J].Diagn Microbiol Infect Dis,1998,32(1):33-37.
[7]乔建军,刘伟,万喆,等.米卡芬净对分离自中国的念珠菌和曲霉临床株体外抑菌活性的研究[J].中国真菌学杂志,2007,2(1):5-9.
[8]李岷,沈永年,吕桂霞,等.棘白菌素对氟康唑耐药的念珠菌体外药物敏感性的研究[J].中国真菌学杂志,2009,4(2):78-81.
[9]Barry AL,Pfaller MA,Brown SD,et al.Quality control limits for broth icrodilution susceptibility tests of ten antifungal agents[J].J Clin Microbiol,2000,38(9):3457-3459.

