二碳酸二甲酯的分解动力学研究
章亚东,蒋自伟
(郑州大学化工与能源学院,河南郑州450001)
0 引言
二碳酸二甲酯(Dimethyl Dicarbonate)即DMDC,是近年来取得我国卫生部使用许可,并获得世界卫生组织和美国FDA认可使用的一种新型防腐剂,其分子式为.二碳酸二甲酯广泛适用于各种碳酸饮料、果汁饮料及茶饮料、含乳固体等非酒精饮料当中[1],并适用于pH值低于4.6的较大酸度饮料[2],对酵母菌、霉菌等各类微生物有较好的杀灭及抑制作用[3].由于其遇水迅速分解生成CO2和CH3OH,且CH3OH的含量低于食品安全标准[4],并且这也是许多果蔬汁饮料当中的天然组分,故最终无任何防腐剂残留.此外,二碳酸二甲酯也可施予食品表面可以形成一层杀菌保护膜[5],令食品持久保鲜并易于水洗去除.与目前常用的化学防腐剂相比,二碳酸二甲酯具有效果好、毒性低、不影响食品风味等优点,尤其是具有无残留的突出优点,在食品安全日益受到重视的今天,二碳酸二甲酯具有广阔的应用前景.目前,国内外对于二碳酸二甲酯在常温下储存的稳定性及分解动力学研究鲜有报道,而其常温下的储存稳定性,对其生产、储运及使用有着重要影响.为此,笔者开展了二碳酸二甲酯在常温下密闭及敞口放置的分解动力学研究,得出了二碳酸二甲酯在不同温度下敞口放置的分解速率常数,并推导出其常温下的分解动力学方程及其活化能,对于该新型防腐剂的使用、储藏以及进一步研究其分解性质具有一定的指导意义.
1 实验部分
1.1 仪器与试剂
主要仪器:GC 9800 TFP型气相色谱仪,上海科创色谱仪器有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;601型超级恒温水浴箱,江苏省金坛市医疗仪器厂;分析天平,移液枪等.
主要试剂:碳酸二甲酯,AR,上海晶纯试剂有限公司;甲苯,AR,天津科密欧试剂有限公司;乙醇,AR,天津科密欧试剂有限公司;二碳酸二甲酯,按文献[6-8]方法自制.
1.2 实验方法
将一定量的二碳酸二甲酯分两组注入试管中,一组试管口密闭置于水浴恒温箱,另一组试管敞口置于水浴恒温箱里,调至不同的实验温度,每隔一定时间对二碳酸二甲酯取样,以甲苯为溶剂进入气相色谱检测二碳酸二甲酯的质量分数,并绘制浓度—时间(cA—t)曲线.对实验数据进行回归处理,求出回归方程,然后根据回归方程求出不同温度下的分解反应速率常数.根据式(1)计算二碳酸二甲酯的摩尔浓度:
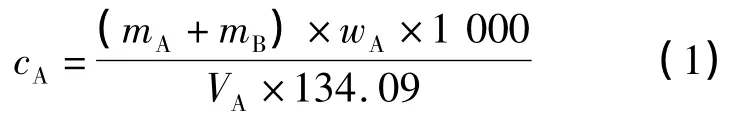
式中:cA为放置一段时间后二碳酸二甲酯的摩尔浓度,mol·L-1;mA为二碳酸二甲酯的取样质量,g;mB为溶剂甲苯的质量,g;wA为二碳酸二甲酯在气相色谱检测中的质量分数;VA为二碳酸二甲酯的取样体积,mL;134.09为二碳酸二甲酯的摩尔质量,g·mol-1.
1.3 分析方法及其可靠性验证
本实验中二碳酸二甲酯的含量采用气相色谱检测分析.气相色谱常用的定量检测方法有面积归一化法、内标法及外标法.归一化法具有简便、准确的优点,并且进样量的变化对分析结果影响很小,柱温、流速等其他操作条件对定量结果的影响也很小[9].由于二碳酸二甲酯及其分解产物与溶剂全部出峰,本实验中采用带校正因子的面积归一化法测定二碳酸二甲酯的含量.首先以苯为基准物,分别以甲苯、甲醇、碳酸二甲酯、二碳酸二甲酯的纯品测得其各自的相对质量校正因子.得到上述相各物质的对质量校正因子,即可得二碳酸二甲酯在气相色谱分析中的质量分数,计算公式如式(2)所示:

式中:wA为二碳酸二甲酯溶液的质量分数;f1、f2、f3、f4依次为二碳酸二甲酯、碳酸二甲酯、甲醇与甲苯的相对质量校正因子;A1、A2、A3、A4依次为二碳酸二甲酯、碳酸二甲酯、甲醇与甲苯的出峰面积.所用气相色谱分析条件如下:色谱柱:SE-54 30 m×0.32 mmi.d.;柱箱温度50℃;汽化温度200℃;采用FID检测器,检测温度230℃;进样量0.01 μL;N2流速 40 mL/min;H2流速 20 mL/min.采用一阶程序升温,50℃保温5 min,20℃/min升温至150℃,保温5 min,最后降温至50℃.
为验证上述分析方法的可靠性,测定了已知质量分数的二碳酸二甲酯溶液.称取二碳酸二甲酯样品1.064 7 g,以甲苯为溶剂稀释上述质量的二碳酸二甲酯至10.346 1 g,样品质量分数为10.29%.再以上述分析方法测定该二碳酸二甲酯溶液的质量分数wA,重复平行测定5次,测得DMDC质量分数依次为 10.21%、10.27%、10.33%、10.19%、10.36%,5次测定的平均质量分数¯wA为10.27%.可见,对二碳酸二甲酯的同一样品,采用气相色谱法测得的质量分数与样品的实际含量进行比较,实验测定值与实际值符合良好,二者相对误差为0.19%,所以,以气相色谱法作为二碳酸二甲酯的分析方法是准确可行的.
2 结果与讨论
2.1 密闭条件下二碳酸二甲酯的分解情况
二碳酸二甲酯在密闭条件下放置,其分解主要表现为对热不稳定,在一定温度下会受热分解,其分解方程式如式(3)所示:

将装有二碳酸二甲酯的试管密封好后置于各温度环境中,每隔一定时间对二碳酸二甲酯取样进行含量测定,考察20,30,40,50,60 ℃下的分解情况,以二碳酸二甲酯的浓度cA对时间t作图,结果如图2所示.由图2可知,在密闭体系下二碳酸二甲酯的分解并不显著,尤其在20~40℃温度下,在实验时间内几乎无明显分解.但随着温度升高,二碳酸二甲酯的分解稍显加快.60℃下密闭恒温放置36 h,二碳酸二甲酯的浓度变化为0.72 mol·L-1.可见在低温密闭条件下,二碳酸二甲酯较为稳定,有较好的储存稳定性.
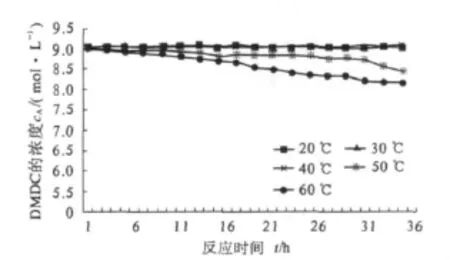
图1 密闭体系不同温度下二碳酸二甲酯浓度cA与时间t的关系曲线Fig.1 The cA -t curves of dimethyl dicarbonate at different temperature in inclosed system
2.2 敞口体系下二碳酸二甲酯的分解情况
2.2.1 反应级数与反应速率常数的确定
二碳酸二甲酯在敞口条件下放置,会缓慢分解生成碳酸二甲酯和二氧化碳.当其与空气中少量的水蒸气作用,也会发生分解反应.上述分解反应方程式如下:
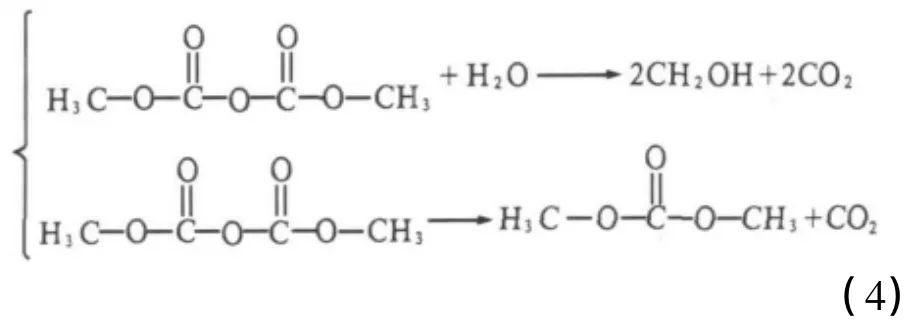
二碳酸二甲酯的分解在常温、敞口体系下是由两个反应组成.这些反应都会直接消耗二碳酸二甲酯,使其含量降低.考察 20,30,40,50,60 ℃下的分解情况,每隔一定时间对二碳酸二甲酯进行含量测定,以二碳酸二甲酯的浓度cA对时间t作图,结果如图3所示.
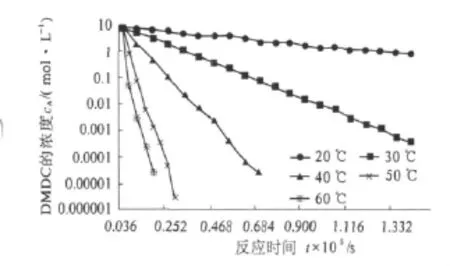
图2 敞口体系不同温度下二碳酸二甲酯浓度cA与时间t的关系曲线Fig.2 The cA - t curves of dimethyl dicarbonate at different temperature in opening system
由于实验在敞口体系下进行,可以认为二碳酸二甲酯分解释放的CO2气体浓度不会对其分解反应产生影响;同时在敞口状态下,空气中的湿度相对恒定,因分解只发生在二碳酸二甲酯表面,故相对于广大的水汽来源,样品的分解速率主要与水汽相接触的二碳酸二甲酯浓度(亦可说接触面)有关,在实验条件下按此分解反应式,表观分解速率应正比于二碳酸二甲酯的浓度.此假定,与测得的表观分解数据基本一致,故可以从宏观上假设二碳酸二甲酯的分解反应为准一级反应,反应动力学方程如式(5)所示,对其积分得式(6):

按式(6)用最小二乘法将上图中的数据进行回归处理,以不同温度下二碳酸二甲酯摩尔浓度的对数lncA对反应时间t作线性回归,如图4所示,由其斜率依次得到不同温度下的反应速率常数k,线性回归的相关系数均在0.98以上,这表明将二碳酸二甲酯的复杂分解反应在宏观上作为准一级反应处理是合理的.
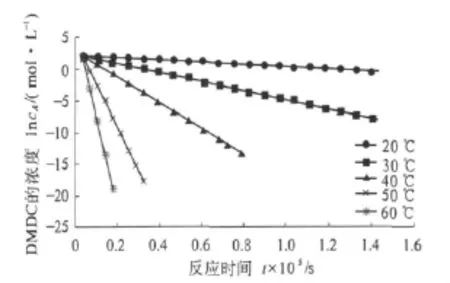
图3 各温度下二碳酸二甲酯浓度对时间的拟合曲线Fig.3 The cA - t fitted curves of dimethyl dicarbonate at different temperature
图4中各回归曲线的斜率k即二碳酸二甲酯在各温度下的分解反应速率常数,可见反应速率常数随温度的升高而增大.将不同实验温度下二碳酸二甲酯的分解速率常数列于表2.
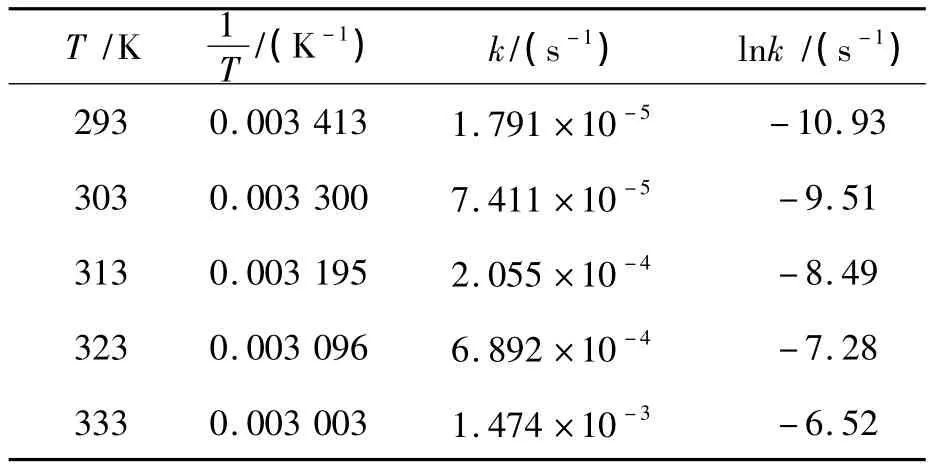
表1 不同温度下二碳酸二甲酯的分解速率常数Tab.1 The decomposition reaction rate constants at different temperature
2.2.2 表观活化能的计算
图4中的反应速率常数(即斜率k)随温度的升高而增大.根据表2的数据,将不同温度下得出的反应速率常数k代入Arrhenius方程:

式中:Ea为分解反应的表观活化能,kJ·mol-1;R为理想气体常数,J·mol-1·K-1;A为指前因子,s-1.由上式求出活化能Ea和指前因子A,可得出二碳酸二甲酯的分解速率与温度的关系.式(7)也可改写为:
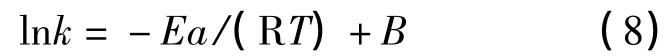
按照式(8),用最小二乘法将不同温度下的lnk对1/T作线性回归,如图4所示,所得直线方程如式(9)所示,复相关系数R2=0.995 9.
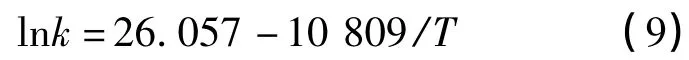
由上式可得在实验温度范围内的表观活化能Ea,即为该直线的斜率(-Ea/R)=-10 809,则Ea=89.866 kJ·mol-1.由此确定温度对二碳酸二甲酯分解速率的影响公式如式(10)所示:
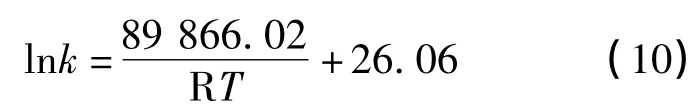

图4 二碳酸二甲酯分解反应速率常数k与温度T的关系曲线Fig.4 The curve of decomposition reaction rate constant(k)&temperature(T)of dimethyl dicarbonate
3 结论
(1)在常温密闭条件下放置,温度在20~40℃之间二碳酸二甲酯几乎不发生分解,稳定性较好,有着良好的存储性.随着温度升高,其分解略显加快.
(2)在常温敞口体系下放置,二碳酸二甲酯的分解速率明显高于密闭存储状态.其分解是由一组分解反应组成,该分解反应动力学从宏观角度可以用准一级反应加以处理.
(3)在常温敞口体系下 20,30,40,50,60 ℃的实验温度下,其分解反应速率常数分别为:1.791×10-5,7.411×10-5,2.055×10-4,6.892×10-4,1.474×10-3s-1.结果表明,随温度的升高其分解速率常数变大,分解速率加快,因此二碳酸二甲酯应尽量在低温下使用及储存.
(4)在敞口体系下,二碳酸二甲酯的分解反应在常温下分解动力学方程为K=1.96×1011其表观活化能为89.866 kJ·mol-1.
[1]LOGICA INTERNATIONAL CORP.Method of cold sterilization using frozen dimethyl dicarbonate:US,3936269(A)[P].1976-02-03.
[2]PEPSICO INC.Preservative system for beverages based on combinations of trans-cinnamic acid,lauric arginate,and dimethyl: World patent,2010062548=(A1)[P].2010-06-03.
[3]尹卓荣.DMDC在葡萄酒及饮料中的应用[J].食品科学,1992,92(8):26-28.
[4]尹卓荣.二碳酸二甲酯在葡萄酒及饮料中的应用[J].酿酒科技,1992,92(5):39-40.
[5]LOGICA INTERNATIONAL CORP.Method of cold sterilization and preservation of food products using dimethyl dicarbonate:US,3979524=(A)[P].1976-09-07.
[6]PRINZ T,ECKERT M.Catalytic condensation method for producing dialkyl dicarbonates from alkyl haloformates:World patent,2005110964[P].2005-11-24.
[7]PRINZ T,ECKERT M,BUSCHHAUS H.Process for preparing dicarbonates:US,0213552 A1[P].2007-12-13.
[8]MUELLER P,DOERFELT S,SCHMIDT S.Production of dialkyl dicarbonate using dialkyl carbonate as both solvent and reactant:Germany,102007042699[P].2007-09-07.
[9]吴谋成.仪器分析[M].北京:科学出版社,2003:25-228.

