松花江水内分泌干扰物及雌激素活性调查
张照韩,冯玉杰,高 鹏,孙清芳,任南琪
(哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨,yujief@hit.edu.cn)
环境中的内分泌干扰物能通过模拟或阻断内生激素,刺激或者抑制激素的生物效应,干扰激素的合成、转运及清除等生物过程,或者能干扰人类或野生动物内分泌系统诸环节的正常调控功能,从而对机体生长造成危害[1].大量的研究表明,世界各大水体均受到了不同程度的EDCs(Endocrine Disrupting Compounds)污染,而且导致了水体中野生生物尤其是鱼类的调节机制紊乱,出现畸形化、雌性化的趋势[2-4].
近年来,松花江鱼类数量锐减,种类变少,鱼病盛行,畸形鱼数量增加,生态系统遭到破坏,水生生物的生存受到严重威胁[5].本文采用固相萃取(SPE)富集、气质联机(GC-MS)和重组基因酵母(YES)技术检测了松花江水中典型EDCs的质量浓度及雌激素活性,为了解松花江水体EDCs的污染状况,控制EDCs污染的对策,以及保护和恢复松花江水体的鱼类资源提供了科学依据.
1 实验
1.1 采样点及样品采集
沿松花江全江进行了11个站位的样品采集,S1~S2(梢口和松花江村)位于上游吉林省,S3~S8(肇源、哈上、哈下、达连河上、达连河排污口和达连河下)位于中游哈尔滨江段,S9~S11(佳上、佳下和同江)处于下游江段.采样时间为2009年3月份松花江冰封期内.在冰下水深0.5 m处,采集水样4 L于密闭的铁桶中,取回实验室后立即用0.7 μm的玻璃纤维滤膜过滤,再用硫酸酸化至pH<2以避免微生物降解,4℃下保存,所有水样均在样品采集后3 d完成前处理.
1.2 样品前处理
采用Oasis HLB(200 mg,6 mL)固相萃取柱富集水样内分泌干扰物[6].柱子调节:用5 mL乙酸乙酯过柱以去除残留的键和剂,5 mL甲醇浸泡5 min,再用10 mL盐酸溶液(pH=3)以1 mL/min流速过柱.水样富集:取调节 pH为3的水样2 000 mL,通过控制固相萃取系统的真空度,使水样以8 mL/min的流速过柱,随后用10 mL超纯水-甲醇(9∶1)洗柱,继续真空干燥1 h.洗脱:干燥后的SPE柱,用10 mL乙酸乙酯以1 mL/min流速洗脱到15 mL的玻璃管中,经无水硫酸钠脱水后,于45℃用微氮气流缓慢浓缩至1 mL.其中,0.5 mL置于色谱瓶中,用氮气吹干后加入50 ng的BPA-d16作为内标,同时加入100 μL的衍生剂于70℃水浴中反应60 min,稀释到0.5 mL待测;另外0.5 mL于微氮气流下吹干后,溶解到0.5 mL的DMSO中用于测定水样的雌激素活性.
1.3 EDCs化学分析
采用气相色谱-质谱法分析内分泌干扰物的质量浓度[7].仪器型号:HP6890 -5973,HP -5MS毛细管柱(30 m ×0.25 μm ×0.25 μm).以氦气为载气,流速1 mL/min,进样口温度250℃.升温程序:初始炉温 100℃,保持 1 min,随后以10℃/min到200℃,再以3℃/min到280℃,保持2 min.不分流进样,进样量2.0 μL.质谱接口温度280℃,离子源温度250℃,EI源电离,以全扫描模式定性,选择离子模式进行定量.
固定内标量为100 μg/L,一系列质量浓度的EDCs混标(2、5、10、50、100、500 μg/L)用于确定线性质量浓度范围,并获得了很好的相关性(R2>0.995).用校准曲线计算未知样品的质量浓度.3个100 ng/L标准平行水样用于测定方法的回收率及标准偏差.水样中除EE2外其他物质的平均回收率均大于70%,相对标准偏差为5% ~17%.
1.4 雌激素活性测定
雌激素活性采用中科院生态环境中心建立的酵母双杂交雌激素活性评价方法[8],试验用的酵母菌由王子健教授惠赠.试验方法详见文献[8].简述如下:将酵母菌置于 SD培养基中,在30℃、130 r/min条件下培养36 h.并用SD培养液稀释至OD600值为0.75左右,吸取菌液0.995 mL于1.5 mL灭菌离心管中,加入5 μL待分析的样品,混匀.每个样品设8个梯度(浓缩液稀释倍数:1、1/2、1/10、1/20、1/100、1/200、1/1 000、1/10 000),每个梯度做3个平行测试.随后由离心管吸取200 μL菌液至96孔板中,在30℃、800 r/min条件下暴露2 h.测定菌悬液的OD600值,随后每孔弃去150 μL,加入120 μL 测试缓冲液和20 μL 氯仿,于1 200 r/min震荡破壁 15 min,加入 40 μL ONPG,于 30 ℃、800 r/min下培养显色60 min.显色结束后,每孔加入100 μL碳酸钠溶液(1 mol/L),终止反应.吸取上清液200 μL至新96孔板中,测定420 nm处吸光度.同时,以DMSO做阴性对照,以E2为阳性对照.β-乳糖苷酶活性按下式计算:
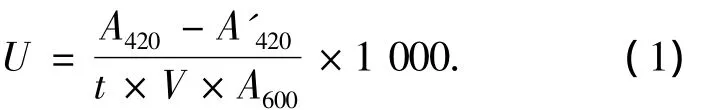
式中:t为加入ONPG到溶液显色时的反应时间,min;V为菌液体积,mL;A600、A420分别为菌液在600、420 nm处的光密度值;A'420为空白对照在420 nm处的光密度值.
对于处理的样品,由剂量效应曲线可计算出样品的EC50值.样品的雌激素活性可用雌二醇当量(ρEEQ)来表达,可用下式计算:
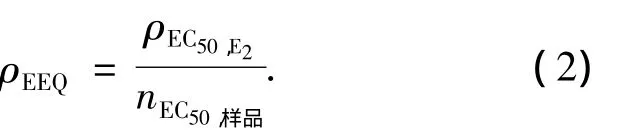
式中:ρEC50,E2为雌二醇的 EC50值(ng/L),本实验室所测得的值为18.22 ng/L;nEC50,样品为实际样品的EC50值(稀释倍数).
2 结果与讨论
2.1 江水中雌激素质量浓度分析
松花江各采样点水样中5种雌激素的总质量浓度(∑5ES)水平如表1所示.可以看出,松花江水中∑5ES质量浓度在6.59~30.97 ng/L,其中达连河排污口处最高,而松花江村质量浓度最低.全江∑5ES平均值为17.23 ng/L,表明松花江水体已经遭受到了一定水平的雌激素污染.文献[9]发现,北塘河、大沽河和永定新河的雌激素总质量浓度均值分别为54.9、55.3和25.6 ng/L,均大于松花江水体中雌激素的总质量浓度.水体中雌激素的来源主要有两个途径[10],一是生活污水排放进入水体的,主要含有人类代谢产生排放进入水体的天然雌激素(如E1和E2)以及由人体摄入体内后残留在代谢物中人工合成的雌激素(如EE2、E3和DES);二是由工业废水排放所带入的雌激素.由表1可知,在哈尔滨下游∑5ES质量浓度是上游的3.47倍,表明城市污水的排放对松花江水体雌激素有很大的贡献;而梢口和达连河排污口较高的∑5ES表明工业废水对水体雌激素质量浓度也有明显的贡献.
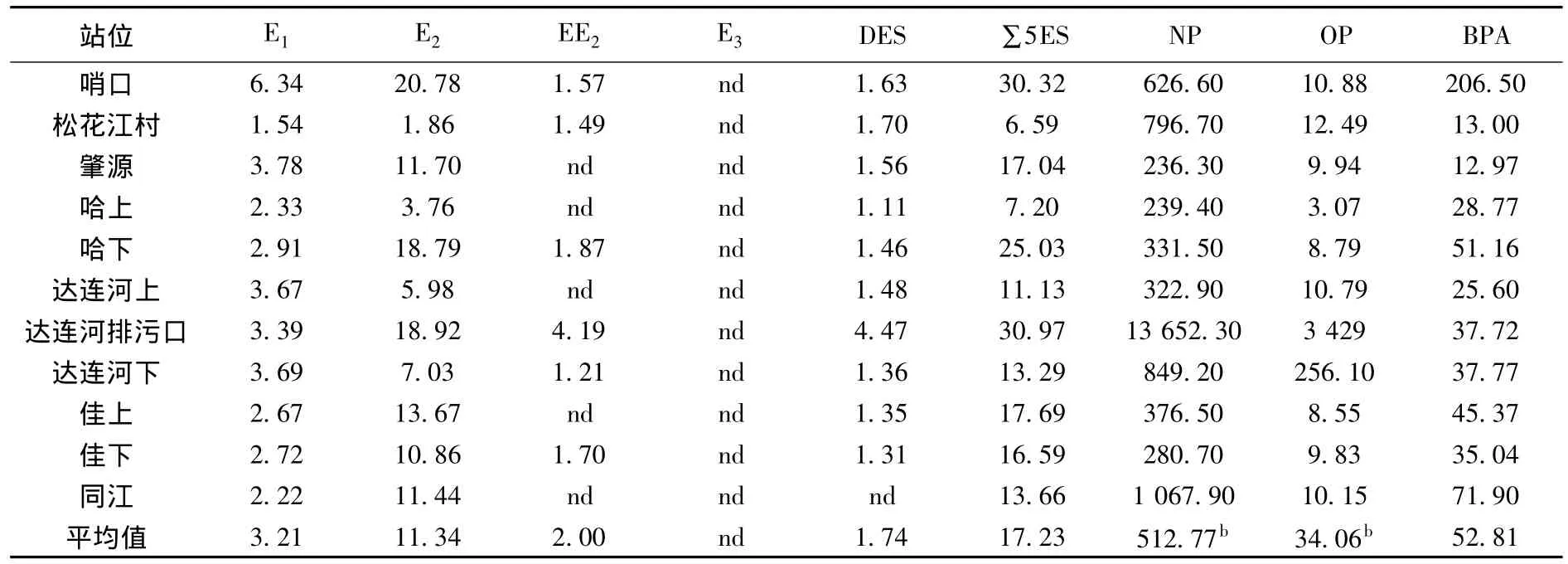
表1 松花江水中8种内分泌干扰物质量浓度 ng·L-1
在5种雌激素中,所有样品均检测到E1和E2,而DES和EE2部分检出,所有样品中均未检出 E3.全江中 E1、E2、DES和 EE2的质量浓度范围分别为1.54~6.34、1.86~20.78、nd~4.47和 nd~4.19 ng/L,均值分别为 3.21、11.34、1.74 和2.00 ng/L.在5种雌激素中,天然雌激素(E1和E2)的质量浓度最高,表明生活污水是松花江水体雌激素的一个重要来源.国内外对河流中雌激素的研究已有很多报道.Tabata等[11]对日本109条河流的雌激素水平进行了调查,发现夏季E2的平均质量浓度为2.1 ng/L,而秋季的平均质量浓度为1.8 ng/L,都比本研究松花江中E2的质量浓度低5倍左右.7条法国河流中E1、E2、E3和EE2质量浓度分别为0.8~3.9、0.8~3.6、0.6~3.1和0.6~3.5 ng/L,其雌激素的污染水平和松花江相当[12].邵晓玲等[13]对松花江哈尔滨段的雌激素进行了调查,发现 E1,E2,E3,DES 和 EE2的质量浓度均值分别为 39.25、20.75、36.25、3.25 和11.25 ng/L,均高于本研究的值,这跟采样的季节、时间、采样点位置以及所采用的分析方法都有很大的关系,但都表明松花江水体已经受到雌激素的污染,并存在潜在的生态安全效应.
2.2 江水中酚类污染物质量浓度
OP和NP是烷基酚乙氧基表面活性剂的代谢产物,而BPA是环氧树脂和聚钛酸酯塑料的增塑剂,在工业生产和日常生活中都有广泛的应用.因此,考察了松花江中这3种具有雌激素效应酚的质量浓度水平.由表1可以看出,NP、OP和BPA3种酚在水样中的检出率为100%.其质量浓度范围分别为236.3~1067.9、3.07~256.1和13.0~206.5 ng/L,均值为 512.8、34.1 和 52.8 ng/L,其质量浓度水平明显高于雌激素的质量浓度,且其质量浓度水平为NP>BPA>OP.江水经过哈尔滨市后,NP、OP和BPA质量浓度分别增加了1.38、2.86和1.79倍,表明生活污水对水体的质量浓度也有明显贡献.lgρNP和lgρOP之间有明显的相关性(lgρNP=1.52lgρOP-2.91,R2=0.776 7),表明 NP和OP是同时排放进入松花江水体的,且沿河流可能进行着相似的迁移转化过程[14].
国内外有很多关于3种酚在河流中污染水平的报道.Sharma等[15]调查了世界不同区域河流中NP、OP和BPA的质量浓度,发现其质量浓度范围分别为6~32 800,<1~1 440和0.5~4 000 ng/L,而松花江质量浓度在其范围之内.邵晓玲等[13]对松花江哈尔滨段NP、OP和BPA质量浓度进行了调查,发现其范围分别为6~1 261,33~175和22~49 ng/L,NP和OP比本研究的值高,而BPA水平则相当.
2.3 水样的雌激素活性分析
图1给出的是松花江各采样点水样用重组基因酵母评价雌激素活性时的剂量效应关系曲线.可以看出,各水样都能诱导重组基因酵母产生的β-半乳糖苷酶活性,表明所考察水样均具有一定的雌激素活性.其产生的剂量-效应曲线呈现S形,可由最小二乘法进行拟合,由方程可以计算出水样的EC50值:
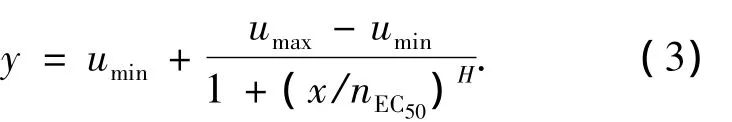
式中:y为β半乳糖苷酶活性;x为水样的富集倍数;H为回归曲线中点斜率;nEC50为半数最大β半乳糖苷酶活性时样品的稀释倍数;umax为最大β半乳糖苷酶酶活;umin为本底β半乳糖苷酶酶活.
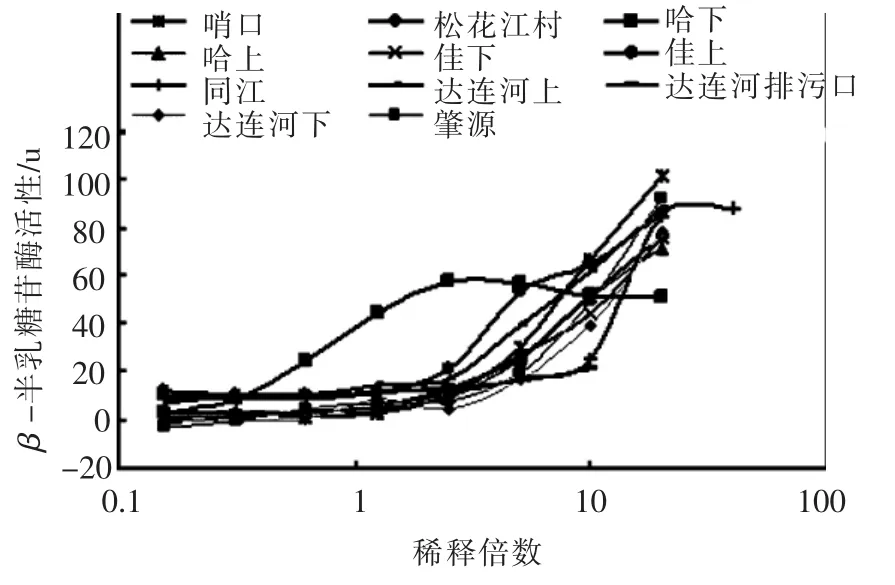
图1 松花江水样的剂量-效应关系
运用Sigmaplot软件以方程(3)对图1中的数据进行拟合,可以求得水样的EC50值,见表2.可以看出,所有样品的EC50值介于0.70~36.48,其中哈下采样点最小,而达连河下水样的最大.同时由式(2)可以计算出各采样点水样的ρEEQ值.由表2知,松花江水样的 ρEEQ值介于 0.50~26.16 ng/L,其中哈下采样点的值最高达26.16 ng/L,而哈上仅有2.14 ng/L,增加了12.2倍,与之前的雌激素质量浓度趋势相似,表明大型城市污水的排放是松花江水体雌激素活性的一个重要来源.除了哈下水样外,其他采样点水样的ρEEQ均未超过 3.60 ng/L.Fawell等[16]用此法研究了英国数条河流的雌激素活性,发现其ρEEQ在nd~2.3 ng/L.而 Shen 等[17]的研究表明,太湖水样的雌激素活性在2.2~12.1 ng/L.这些水体中的ρEEQ均和松花江水体的处于同一污染水平上.
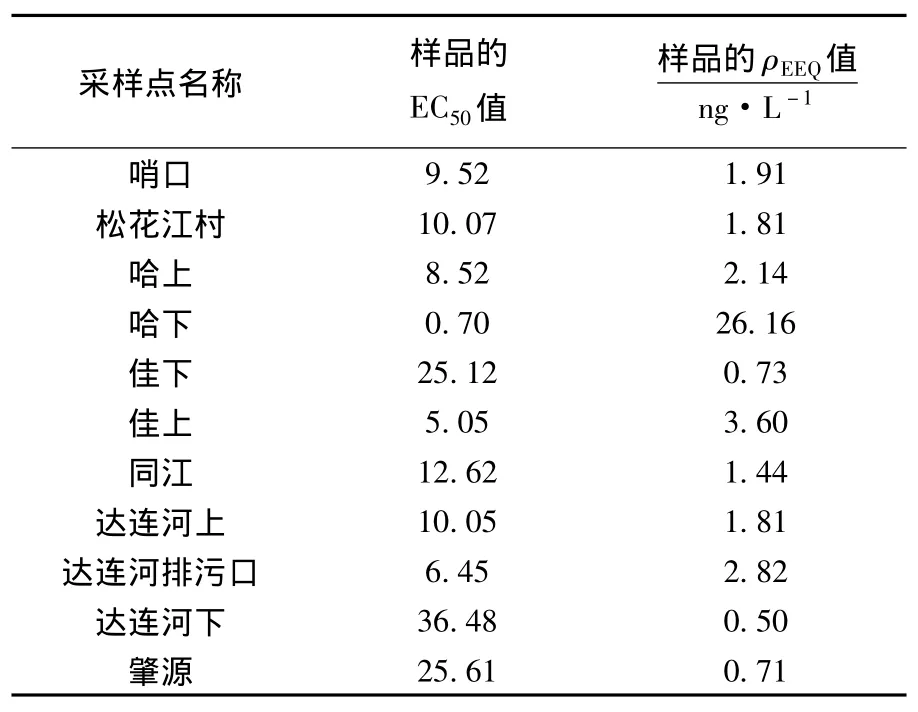
表2 各采样点水样的EC50值和ρEEQ值
由水样含有的雌激素活性物质质量浓度可计算雌二醇当量(Calculated Estradiol Equivalent Quantity,ρEEQcal),其定义为环境雌激素的质量浓度与该物质的相对雌激素活性的乘积之和[18],即
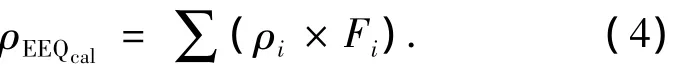
式中:ρi为某一环境雌激素的质量浓度;Fi为该环境雌激素的相对雌激素活性.其中,本实验室所测得的 E1、E2、EE2、E3、DES、NP、OP 和 BPA 的相对雌激素活性分别为 0.06、1、0.77、1.35 × 10-3、0.10、1.11 ×10-4、1.32 ×10-4和4.04 ×10-6.
根据式(4),由实际测得的8种内分泌干扰物的质量浓度,可以计算出各采样点水样的ρEEQcal值.图2给出了ρEEQcal值和ρEEQmeas之间的关系.计算获得的ρEEQ值在3.36~24.76 ng/L,所有样品化学计算的ρEEQcal与生物实测ρEEQmeas的比值为10.71±8.21,表明化学计算所得的ρEEQ要比实际所测得的大,这可能有两方面原因:一是实际水样所测得的各内分泌干扰物的质量浓度可能比真实值大,这种误差在分析超痕量物质质量浓度时不可避免;二是生物法测定含有多种内分泌干扰物的实际样品时,可能产生了拮抗效应,导致实际水样的 ρEEQ比较低.此外,logρEEQcal与 logρEEQmeas之间有一定的相关性,其关系式为log ρEEQcal=-0.342 2log ρEEQmeas+1.058 3,R2=0.288 8.其相关性并不是很好,但是两者之间有相似的变化趋势,至少表明雌激素活性在一定程度上也能反应水体的雌激素污染状况,是水样化学分析的重要补充.
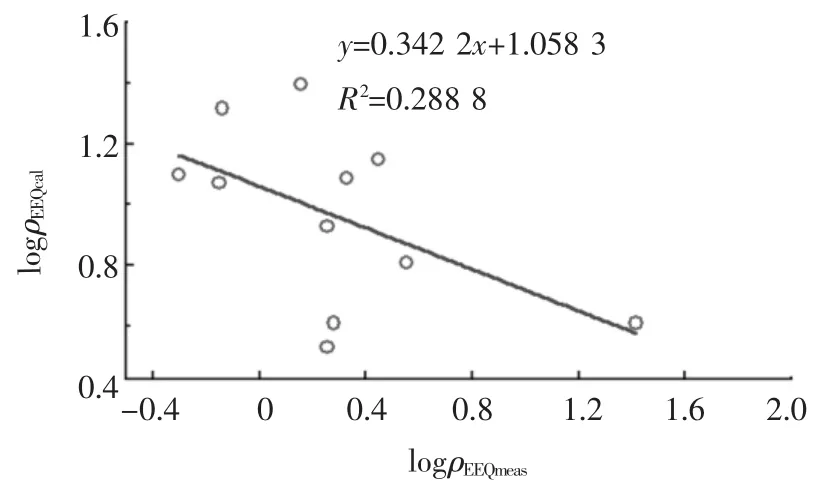
图2 各采样点水样生物实测和计算所得ρEEQ之间的关系
3 结论
1)松花江水中∑5ES质量浓度在6.59~30.97 ng/L,平均值为17.23 ng/L,其中贡献最大的是E2和E1两种天然雌激素,主要来源于生活污水和工业废水.与国内外河流相比,松花江雌激素的污染处于中低水平,但存在潜在的生态安全问题.
2)松花江所有水样均检出了NP、OP和BPA,其质量浓度范围分别为236.3~1067.9,3.07~256.1 和13.0~206.5 ng/L,均值为512.8、34.1和52.8 ng/L.
3)重组基因酵母法测定的松花江水样ρEEQ值为0.50~26.16 ng/L,除哈下采样点外,其他点位均低于3.60 ng/L,其质量浓度与国内外河流的ρEEQ在同一污染水平上.
[1]周庆祥,江桂斌.浅谈环境内分泌干扰物质[J].科技术语研究,2001,3:12-14.
[2]JOBLING S,NOLAN M,TYLER C R,et al.Widespread sexual disruption in wild fish[J].Environmental Science and Technology,1998,32(17):2498 -2506.
[3]SOLE M,RALDUA D,PIFERRER F,et al.Feminization of wild carp,Cyprinus carpio,in a polluted environment:plasma steroid hormones,gonadal morphology and xenobiotic metabolizing system[J].Comparative Biochemistry and Physiology C:Pharmacology Toxicology and Endocrinology,2003,136(2):145-156.
[4]PELLEY J.Estrogen knocks out fish in whole-lake experiment[J].Environmental Science and Technology,2003,37(17):313-314.
[5]侯文礼,金岚,徐锐贤,等.第二松花江渔业资源遭受破坏主要原因的初步探讨[J].东北师大学报:自然科学版,1980,3:66-75.
[6]ARDITSOGLOU A,VOUTSA D.Determination of phenolic and steroid endocrine disrupting compounds in environmental matrices[J].Environmental Science and Pollution Research,2008,15(3):228-236.
[7]金士威,徐盈,惠阳,等.污水中8种雌激素化合物的定量测定[J].中国给水排水,2005,21(12):94-97.
[8]MA Mei,LI Jian,WANG Zijian.Assessing the detoxication efficiencies of wastewater treatment processes using a battery of bioassays/biomarkers[J].Archives of Environment Contamination and Toxicology,2005,49(4):480-487.
[9]LEI Bingli,HUANG Shengbing,ZHOU Yiqi,et al.Levels of six estrogens in water and sediment from three rivers in Tianjin area,China[J].Chemosphere,2009,76(1):36-42.
[10]KHANAL S K,XIE Bin,THOMPSON M L,et al.Fate,transport,and biodegradation of natural estrogens in the environment and engineered systems[J].Environmental Science and Technology,2006,40(21):6537-6546.
[11]TABATA A,KASHIWA S,OHNISHI Y,et al.Estrogenic influence of estradiol-17h,p-nonylphenol and bisphenol A on Japanese Medaka(Oryzias iatipes)at detected environmental concentrations[J].Water Science and Technology,2001,43(2):109-116.
[12]CARGOUET M,PERDIZ D,MOUATASSIM-SOUALI A,et al.Assessment of river contamination by estrogenic compounds in Paris area(France)[J].Science of the Total Environment,2004,324(1/3):55 -66.
[13]邵晓玲,马军.松花江水中13种内分泌干扰物的初步调查[J].环境科学学报,2008,28(9):1910-1915.
[14]ZHANG Yizhang,TANG Changyuan,SONG Xianfang,et al.Behavior and fate of alkylphenols in surface water of the Jialu River,Henan Province,China[J].Chemosphere,2009,77(4):559-565.
[15]SHARMA V K,ANQUANDAH G A K,YNGARD R A,et al.Nonylphenol,octylphenol,and bisphenol- A in the aquatic environment:a review on occurrence,fate,and treatment[J].Journal of Environment Science and Health,Part A Environmental Science,2009,44(5):423-442.
[16]FAWELL J K,SHEAHAN D,JAMES H A,et al.Oestrogens and oestrogenic activity in raw and treated water in Severn Trent Water[J].Water Research,2001,35(5):1240-1244.
[17]SHEN J H,GUTENDORF B,VAHL H H,et al.Toxicological profile of pollutants in surface water from an area in Taihu Lake,Yangtze Delta[J].Toxicology,2001,166(1/2):71-78.
[18]NELSON J,BISHAY F,ROODSELAAR van A,et al.The use of in vitro bioassays to quantify endocrine disrupting chemicals in municipal wastewater treatment plant effluents[J].Science of the Total Environment,2007,374(1):80-90.

