一株光合细菌的鉴定及其处理大豆加工废水试验
卢海凤,张光明,何春华
(哈尔滨工业大学市政环境工程学院,150090哈尔滨,zgm200@126.com)
自20世纪60年代日本科学家M.Kobayashi等发现光合细菌(PSB)具有能够净化水质的作用以来,光合细菌就一直受到关注[1].光合细菌是一大类在厌氧条件下进行不放氧的光合作用细菌的总称,其分布广泛,种类繁多.文献[2-3]将其划分为绿硫细菌、红硫细菌、红螺菌3科.其中红螺菌能在厌氧光照的条件下以低级脂肪酸、多种二羧酸、醇类、糖类、芳香族化合物等低分子有机物及二氧化碳等作为光合作用的电子供体进行光能异养生长,而且能在微氧黑暗条件下,以上述有机物为呼吸基质,进行好氧异养生长.另外,光合细菌还具有繁殖速度快(优于厌氧法)、能耗低(优于好氧法)和无需污泥处置[3]等优点在污水治理领域逐步得到推广应用[4-10].光合细菌菌体无毒、含有多种营养物质,如蛋白质、多种B族维生素、泛酸、辅酶Q等生理活性物质以及菌绿素、类胡萝卜素等天然色素,具有很强的回收价值[11-16].基于光合细菌在水处理和资源回收等方面的优势,对从土壤中富集分离出的一株新型光合细菌进行了生理生化以及菌种鉴定,并初步探讨了其对大豆加工废水的处理效果,发现在自然光微氧条件下,该菌株对大豆加工废水的COD具有较好的降解作用,比传统的光照厌氧及黑暗好氧条件下利用PSB处理高浓度有机废水在工程上的应用更具有现实意义.
1 实验
1.1 实验设备
主要实验设备见表1.
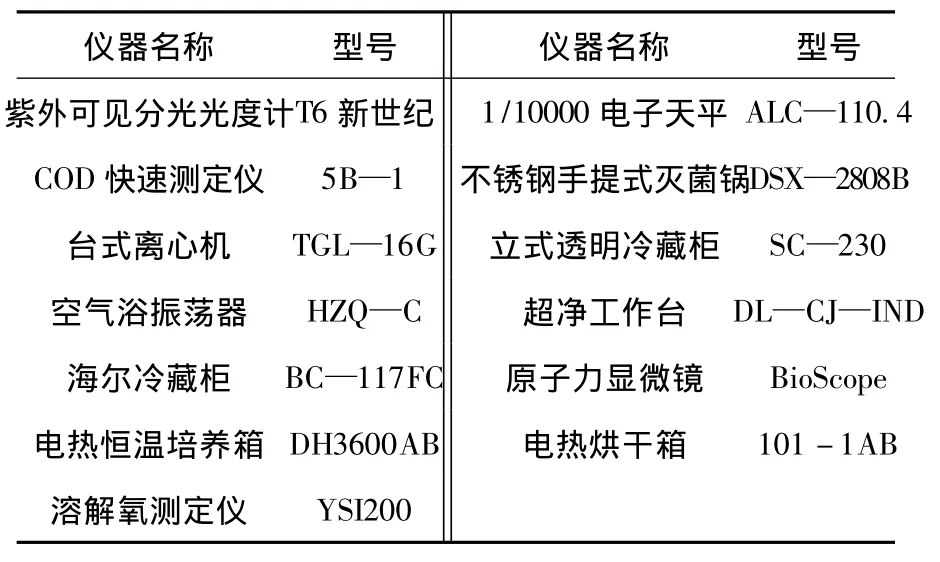
表1 主要实验设备
1.2 实验方法
1.2.1 菌种形态及生理生化性质鉴定实验
1)菌种单、复染色试验:参考文献[17];
2)原子力显微镜扫描:将原始菌液1 000 r/min离心10 min,取上清液3 000 r/min离心10 min,弃上清沉淀部分加入pH为7.2的磷酸盐缓冲液2 mL,洗涤离心10 min,如上洗涤3~5次即可.将洗涤好的菌体加入磷酸盐缓冲液少许并稀释到合适的质量浓度进行原子力显微拍照;
3)菌种的碳源利用试验:参考文献[17];
4)菌种吸收峰点试验:将菌液用无菌水稀释至OD660=1.000左右,将该菌液在紫外分光光度计上100~1 000 nm波长内进行扫描,记录峰点;
5)Sherlock MIS鉴定试验:详见sherlock MIS系统操作说明书;
6)光密度OD660:国标法,详见文献[18].
1.2.2 处理大豆加工废水条件及效果实验
1)废水:采用人工配水方式,用豆浆配制初始COD 为8 000~12 000 mg·L-1的污水;处理温度为26~28℃;
2)投菌量:采用称重法设置投菌量(干质量)为8、40、160、400、960、1 920 mg·L-1的 6 个处理;
3)光照及氧气条件:光照厌氧(光强为1 000 lx)、自然光微氧(保持溶解氧 DO<0.5 mg·L-1)以及黑暗好氧(保持DO介于2.0~4.0 mg·L-1)3个处理,投菌量为120 mg/L;
4)COD:国标法,详见文献[18];
5.统一规范,把好项目资料关。规范基础工作是审计项目顺利开展的前提和保障,审计组长在强化审计项目质量的同时,要摈弃“重成果、轻基础”的错误导向,按照“规范、全面、标准”的要求,实行审计基础工作标准化管理,保证审计资料归档的及时性、准确性、完整性,促进审计质量和工作效率的提高。
5)生物量采用烘干法,即MLSS测定方法,详见文献[18].
2 结果与讨论
2.1 菌种及生理生化性质鉴定
2.1.1 光合细菌Z08单染色试验及原子力扫描镜试验
由图1,2可知,该菌的细菌菌体为球状,单个细菌的直径约为0.3~1.0 μm.光合细菌Z08复染色过程中的颜色变化为:紫色→红色→无色→紫色,故Z08为G-.
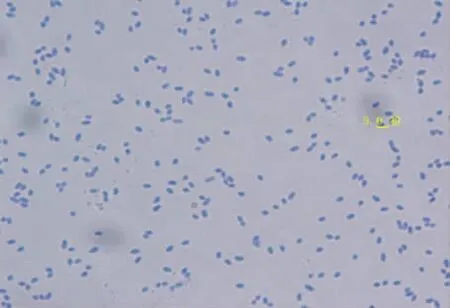
图1 100倍光学显微镜下Z08菌体图像
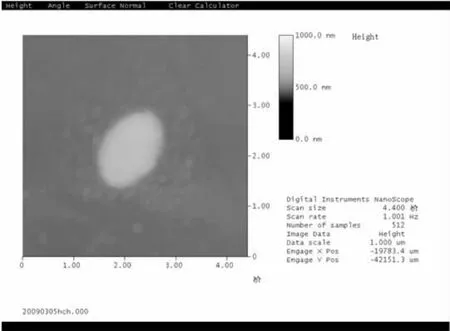
图2 光合细菌Z08的原子力镜扫描照片
2.1.2 光合细菌Z08的碳源利用试验
由表2可知,该菌能够在以乙醇、果糖、葡萄糖、甘油、甘露糖、甘露醇、山梨醇等小分子有机物为碳源的培养基中生长,说明该菌能够利用此类有机物进行新陈代谢;而不能利用丙酸钠、硫代硫酸钠、甲基纤维素、油酸钠及蛋白质作为碳源进行代谢.
2.1.3 光合细菌Z08的菌液特征吸收峰点试验
2.1.4 光合细菌菌种鉴定
经微生物鉴定自动化系统Sherlock MicrobialIdentification System(MIS)鉴定,该菌种为球形红单假单胞菌:Rhodobacter-sphaeroides(Rhodopseudomonas sphaeroides),MIS图谱见图3,对照的标准图谱来源于美国MIDI公司,相似度为0.838(相似度>0.7鉴定可靠).

表2 Z08的碳源利用情况
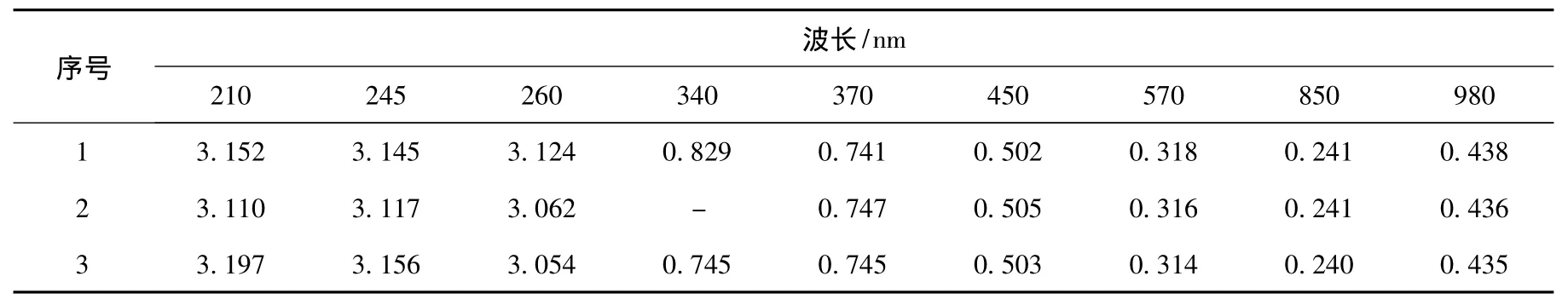
表3 菌液特征吸收峰点
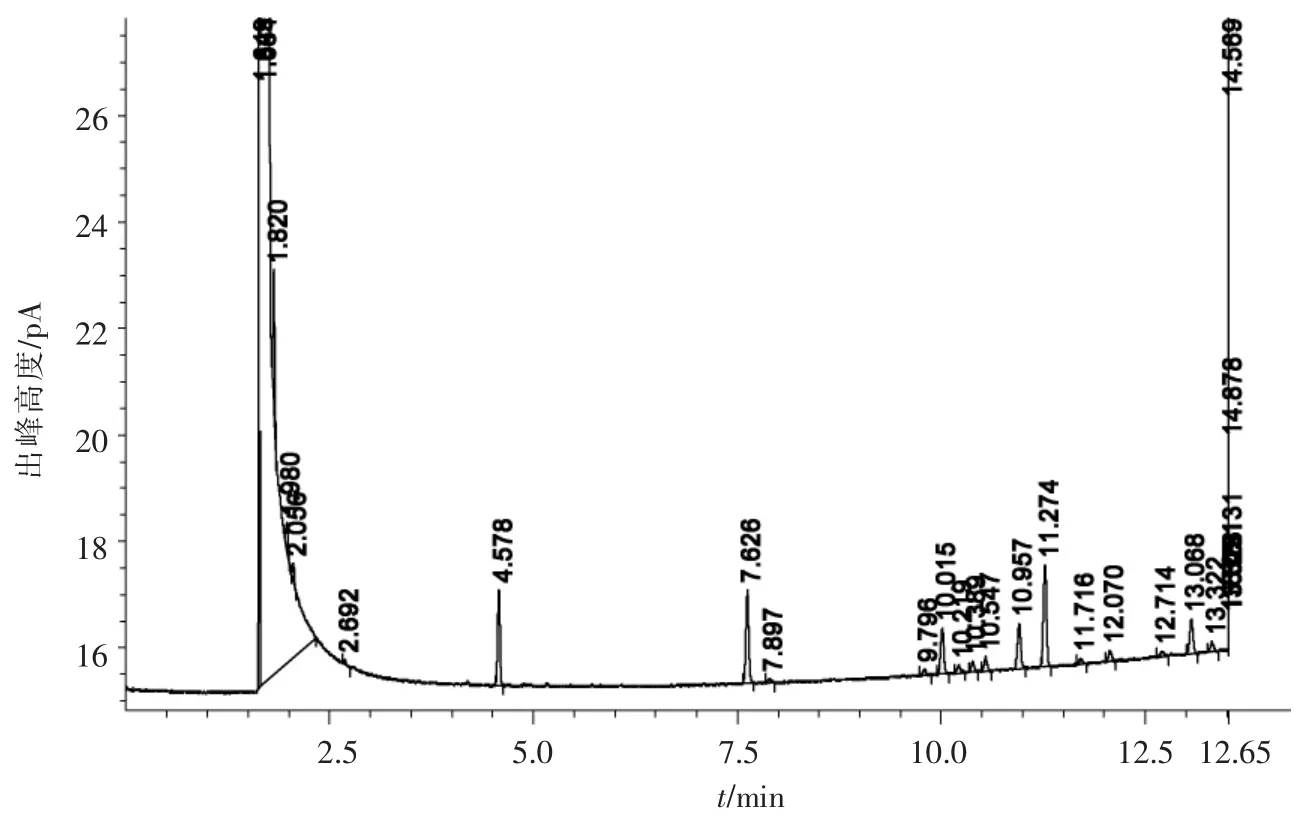
图3 GH-1脂肪酸-IC法鉴定图谱
图4为该菌株16srDNA序列鉴定结果,根据测序结果分析:该菌株16S rDNA序列与Rhodobacter sphaeroides KD131 (CP001151)、Rhodobacter sphaeroides ATCC 17029(CP00578)、Rhodobacter sphaeroides IFO 12203(D16425)等相似性为100%.可以确定其分类地位属于Rhodobacter sphaeroides.
2.2 处理大豆加工废水条件优化及效果
2.2.1 投菌量
如图5所示,各处理组的COD去除率随处理时间的增加逐渐升高,前72 h增加最快,72 h后数值变化趋于平缓,逐渐达极限值.投菌量为160与400 mg·L-1的处理组在第72小时时,COD的降解率分别达86.8%与81.9%,在96 h时,上述数值分别达93.7%与90.5%;菌种添加量为960与1 920 mg·L-1的处理组中,前96 h时的COD去除率均小于菌种投加量为160与400 mg·L-1的组合,而在第96小时以后,其去除率数值与160和400 mg·L-1的处理组相差不大;菌种添加量为8、40与80 mg·L-1的处理组COD去除率在每个时间点上均小于其他菌种添加量≥160 mg·L-1的4个处理组.综合考虑每个处理组的COD降解效果、菌种添加量的经济性与处理时间的长短可以得出,利用Z08处理大豆加工废水最佳的投菌量为160~400 mg·L-1,处理时间为72 h.
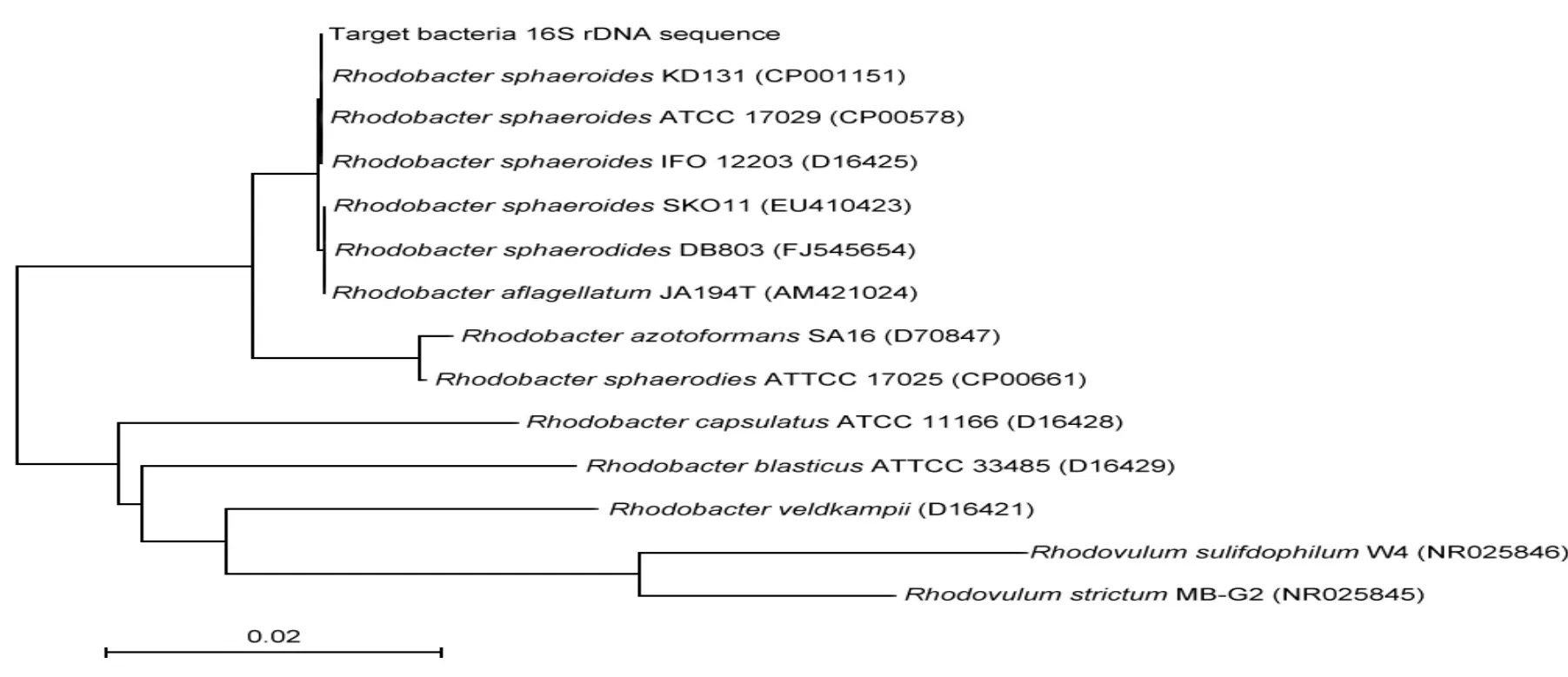
图4 球形红假单胞菌(Rhodopseudomonas sphaeroides)进化树
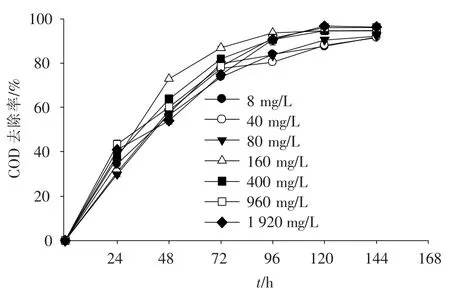
图5 大豆加工废水中COD去除率随投菌量变化
2.2.2 光照氧气
从图6中可以看出,各处理组的COD值随处理时间的增加呈下降趋势,且同一时间点上,各组COD去除率的趋势为黑暗好氧>自然光微氧>光照厌氧;在前72 h内,各组COD值下降最快,72 h后各组COD值变化相对平缓,逐渐达到处理极限值;在第72小时时,各组COD去除率相差不大,而在第168小时时,各组对COD的去除率为:黑暗好氧(95.1%)>自然光微氧(91.9%)>光照厌氧(83.4%).另外,在第72小时时,各处理组的菌体产量分别为:自然光微氧(2 125 mg·L-1)>光照厌氧(1 350 mg·L-1)>黑暗好氧(862.5 mg·L-1),综合处理效果、经济节能性以及菌体产量,自然光微氧为最佳处理条件.从COD去除效果的角度考虑,自然光微氧条件下对污水中COD的去除效果与黑暗好氧条件下的相差不大,且优于光照厌氧条件.而高浓度有机废水由于透光性差,氧气传质差,需要通过设置高光强的照明器以及高强度的曝气来分别控制污水处理过程中的严格光照厌氧与黑暗好氧条件,因此,相比之下,在自然光微氧条件下的PSB处理高浓度有机废水工艺在工程上的应用更具有现实意义.
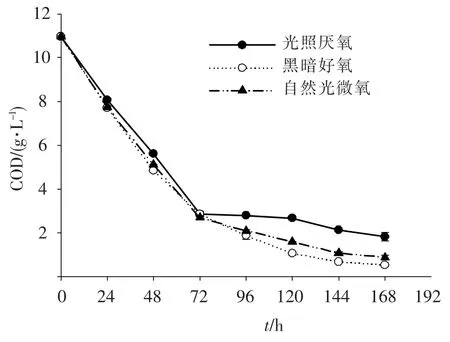
图6 大豆废水中COD质量浓度随光照氧气组合变化
3 结论
1)从土壤中富集分离的菌株Z08经Sherlock MIS系统鉴定及16S rDNA序列测定,判断其为Rhodobacter sphaeroides,菌体为球状,单个细菌的直径约为0.3~1.0 μm,属于革兰氏阴性菌.Z08能够在以乙醇、果糖、葡萄糖、甘油、甘露糖、甘露醇、山梨醇等小分子有机物为碳源的培养基中生长,而不能利用丙酸钠、硫代硫酸钠、甲基纤维素、油酸钠及蛋白质作为碳源进行代谢.
2)处理温度为26~28℃条件下,投菌量为160~400 mg·L-1时,Z08对大豆加工废水 COD的去除率最佳.
3)在不同的光照氧气组合条件中,自然光微氧组合处理条件最佳,第72小时时对COD的去除率达73.5%,菌体产量与光照厌氧及黑暗好氧两个处理组相比达到最大,为2 125 mg·L-1.
[1]小林正泰(日).光合细菌处理高浓度有机废水[J].发酵与工业,1978,36(9):753-760.
[2]R.E希坎南.伯杰氏细菌鉴定手册[M].8版.北京:北京科学出版社,1984.
[3]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[4]BAI H,ZHANG Z,YANG G,et al.Bioremediation of cadmium by growing Rhodobacter sphaeroides:kinetic characteristic and mechanism studies[J].Bioresource Technology,2008,99(16):7716-7722.
[5]EROGLU E,GUNDUZ U,YUCEL M,et al.Photosynthetic bacterial growth and productivity under continuous illumination or diurnal cycles with olive mill wastewater as feedstock[J].International Journal of Hydrogen Energy,2010,35:5293-5300.
[6]KAEWSUK J,THORASAMPAN W,THANUTTAMAVONG M,et al.Kinetic evelopment and evaluation of membrane sequencing batch reactor(MSBR)with mixed cultures photosynthetic bacteria for dairy wastewater treatment[J].Journal of Environmental Management,2010,91:1161 -1168.
[7]LU H F,ZHANG G M,DAI X,et al.Photosynthetic bacteria treatment of synthetic soybean wastewater:direct degradation of macromolecules[J].Bioresource Technology,2010,101:7672-7674.
[8]MYUNG K K,CHOI K M,YIN C R,et al.Odorous swine wastewater treatment by purple non-sulfur bacteria,Rhodopseupdomonas pulustris,isolated from eutrophicated ponds[J].Biotechnology Letter,2004,26:819-822.
[9]PONSANO E H G,PAULINO C Z,PINTO M F.Phototrophic growth of Rubrivivax gelatinosus in poultry slaughterhouse wastewater[J].Bioresource Technololgy,2008,99(9):3836-3842.
[10]SIRIANUNTAPIBOON S,SRIKU M.Reducing red color intensity of seafood wastewater in facultative pond[J].Bioresource Technology,2006,97(14):1612-1617.
[11]TIANA Y,YUEA T,YUANA Y,et al.Improvement of cultivation medium for enhanced production of coenzyme Q10 by photosynthetic Rhodospirillum rubrum[J].Biochemical Engineering Journal,2010,51:160-166.
[12]秦娟.光合细菌成分的研究及光合细菌制剂降血脂药效学初步筛选[D].太原:山西医科大学,2009.
[13]李福枝,刘飞,曾晓希,等.光合细菌(PSB)应用的研究进展[J].食品与机械,2009,24(1):152-156,158.
[14]王剑秋,管云涛,腾飞.光合细菌法降解淀粉废水积累菌体蛋白的研究[J].清华大学学报:自然科学版,2007,47(3):348-351.
[15]李福枝,刘飞,邓靖.沼泽红假单胞菌中类胡萝卜素的提取与分析[J].生物技术,2007,11(1):51-53.
[16]LORRUNGRUANG C,MARTTHONG J,SASAKI K,et al.Selection of photosynthetic bacterium Rhodobacter sphaeroides 14F for polyhydroxyalkanoate production with two-stage aerobic dark cultivation[J].Journal of Bioscience and Bioengineering,2006,102(2):128-131.
[17]吕春梅.环境污染微生物学实验指导[M].哈尔滨:哈尔滨工业大学出版社,2006.
[18]国家环保局水和废水分析方法编写组.水和废水监
测分析方法[M].北京:中国环境出版社,1989.

