抗除草剂转基因水稻对稻纵卷叶螟田间自然种群的影响
蒋显斌, 肖国樱
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125;2.广西农业科学院水稻研究所,南宁 530007; 3.中国科学院研究生院,北京 100049)
抗除草剂转基因水稻对稻纵卷叶螟田间自然种群的影响
蒋显斌1,2,3, 肖国樱1*
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125;2.广西农业科学院水稻研究所,南宁 530007; 3.中国科学院研究生院,北京 100049)
[目的]明确抗除草剂转基因水稻对非目标生物的影响。[方法]以稻纵卷叶螟为指示物种,调查其在抗除草剂转基因籼稻‘Bar68-1’稻田与非转基因亲本对照‘D68’稻田的种群密度、发育进度以及水稻的受害程度。[结果]在转基因和非转基因稻田中,除2007年水稻乳熟期外,稻纵卷叶螟幼虫的发生密度无显著差异;稻纵卷叶螟不同龄期幼虫比例(%)在转基因稻田与非转基因稻田之间表现出较高的一致性;除2007年分蘖末期外,处理与对照间的单株受害叶片数和卷叶率(%)差异均不显著;转基因水稻与对照植株的卷叶指数(%)表现基本一致。[结论]转基因抗除草剂水稻‘Bar68-1’对非目标物种稻纵卷叶螟不造成影响。
转基因抗除草剂水稻; 非目标生物; 指示物种; 稻纵卷叶螟; 自然种群
转基因作物的生态风险一直是人们广泛关注的热点问题[1]。转基因作物释放可能带来两种类型的危害:(1)对目标生物的非预期影响,例如转基因抗虫、抗病作物对目标害虫、病害的抗性演化;(2)对非目标生物的非预期影响,例如转基因植物直接或间接引起当地生物多样性的变化,或通过基因漂移途径将外源基因整合到不同的生物物种个体中[2]。由于转基因作物对非目标物种的任何不利影响都可能带来致使当地生物多样性改变的风险,越来越多的研究者对于转基因作物对非目标生物的影响高度关注[3-5]。由于具有可在将来不断扩展和完善,从而持续地得到改进和验证的优点,指示物种的方法已广泛应用于风险评估[4],对于严格要求依个案原则进行的转基因植物对非目标生物和生物多样性影响的风险评估来说也是一个新的应用趋势。
抗除草剂自商业化种植以来一直是转基因作物的主要性状。随着转基因抗除草剂作物已在全球广泛种植[6-7],转基因抗除草剂水稻的培育研究也进展迅猛[8-13]。但对于田间自然条件下非目标生物群体对抗除草剂作物的反应目前仍知之甚少[14]。为明确抗除草剂转基因水稻对非目标生物的影响,本试验以稻纵卷叶螟为指示物种,对抗除草剂转基因籼稻‘Bar68-1’稻田与非转基因亲本对照‘D68’稻田中稻纵卷叶螟的种群密度、发育情况及水稻受害程度进行调查、比较,并就抗除草剂水稻对生物多样性的影响的问题本质进行探讨。
1 材料与方法
1.1 材料
抗草铵膦除草剂水稻‘Bar68-1’是用Bar基因转化籼稻品种‘D68’而来的早籼稻[12],‘D68’为‘Bar68-1’的非转基因亲本对照。
1.2 试验设计和作物管理
试验于2007年和2008年在湖南省长沙市中国科学院亚热带农业生态研究所的实验田(28.20N,113.08E)进行(农业转基因生物安全审批书:农基安审字(2006)第060号)。田块面积 2 145 m2,小区面积120 m2,2007年设6个小区,2008年设4个小区,人工单本移栽,插植规格为20 cm×20 cm,各小区随机排列。2007年为5月18日播种,6月5日移栽,8月29日收割;2008年为5月25日播种,6月20日移栽,9月5日收割。田间管理除不喷施杀虫剂外,其余按照水稻田的普通栽培管理方法进行[15]。
1.3 取样
2007年在转基因水稻和非转基因对照稻田的各3个小区采用平行跳跃法取样,每点连续调查相邻2株水稻,每小区查10点,分别在水稻分蘖中期、分蘖末期、齐穗期和乳熟期调查稻纵卷叶螟造成的卷叶数及叶片受害程度;2007-2008年在转基因水稻和非转基因对照种植小区中各随机取一区采用对角线5点取样,每点调查5株连续相邻水稻,分别在水稻分蘖中期、分蘖末期、齐穗期和乳熟期剥查稻纵卷叶螟幼虫的发生密度和发育阶段,其中自2007年的水稻齐穗期始同时记录稻纵卷叶螟造成的稻株卷叶数及叶片受害程度[16]。卷叶率(%)以每株受稻纵卷叶螟为害叶片数×100/单株绿叶数计算。叶片受害程度按以下标准记录:0级,叶片未受害;1级,卷叶面积<1/3;2级,1/3≤卷叶面积<1/2;3级,卷叶面积≥1/2;卷叶指数(%)=(1级受害叶片数×1+2级受害叶片数×2+3级受害叶片数×3)×100/(调查叶片数×6)[17]。
1.4 统计分析
对转基因稻田和对照稻田的不同龄期幼虫比例(%)、卷叶指数(%)用统计软件SPSS 15.0(SPSS Inc.,Chicago,IL,USA)的 Wilcoxon秩-和检验(即Mann-Whitney U非参数检验)进行比较,其余均值比较以t检验进行。数值用平均值±标准误(SE)表示。
2 结果与分析
2.1 抗除草剂转基因水稻‘Bar68-1’稻田稻纵卷叶螟的发生情况
除2007年的水稻乳熟期外(图1),抗除草剂转基因水稻‘Bar68-1’与非转基因亲本对照‘D68’稻田稻纵卷叶螟幼虫的发生密度差异不显著(图1,图2);2007年乳熟期的差异原因可能由于转基因水稻的取样点正好处于具有一定的聚集分布特点的稻纵卷叶螟幼虫的高密度区。抗除草剂水稻与对照稻田的稻纵卷叶螟幼虫各发育阶段在转基因稻田与非转基因稻田之间表现出较高一致性(差异不显著即p值大于0.05的调查结果占全部调查时间的82.5%);在一些调查时期部分龄期的幼虫百分比在转基因稻田和对照稻田有显著差异,但是这种差异没有在不同调查时间及不同年份间得到重复(表1)。
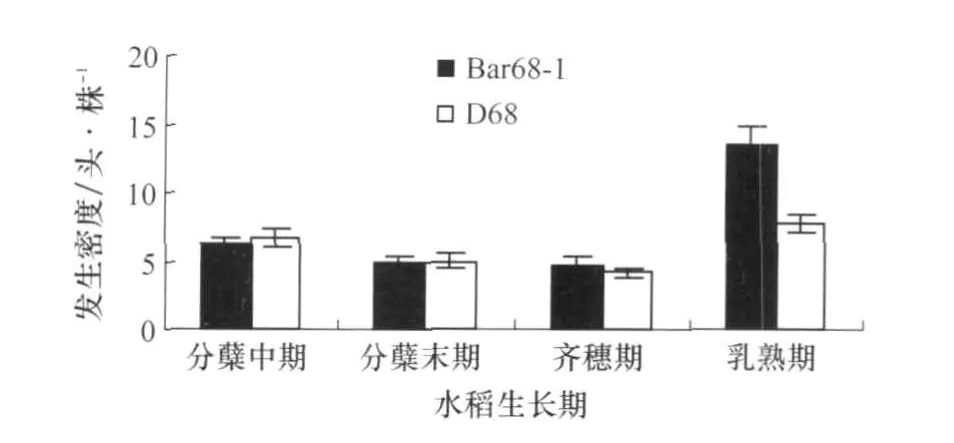
图1 抗除草剂转基因水稻‘Bar68-1’与非转基因亲本对照‘D68’稻田稻纵卷叶螟幼虫的发生密度(2007)
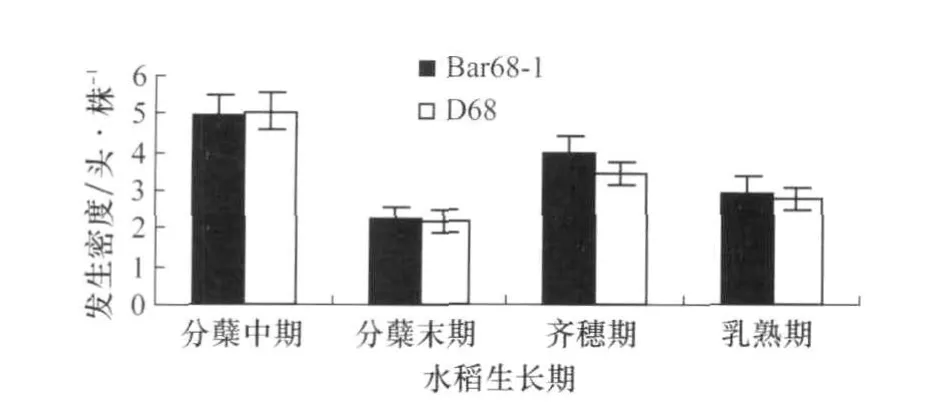
图2 抗除草剂转基因水稻‘Bar68-1’与非转基因亲本对照‘D68’稻田稻纵卷叶螟幼虫的发生密度(2008)
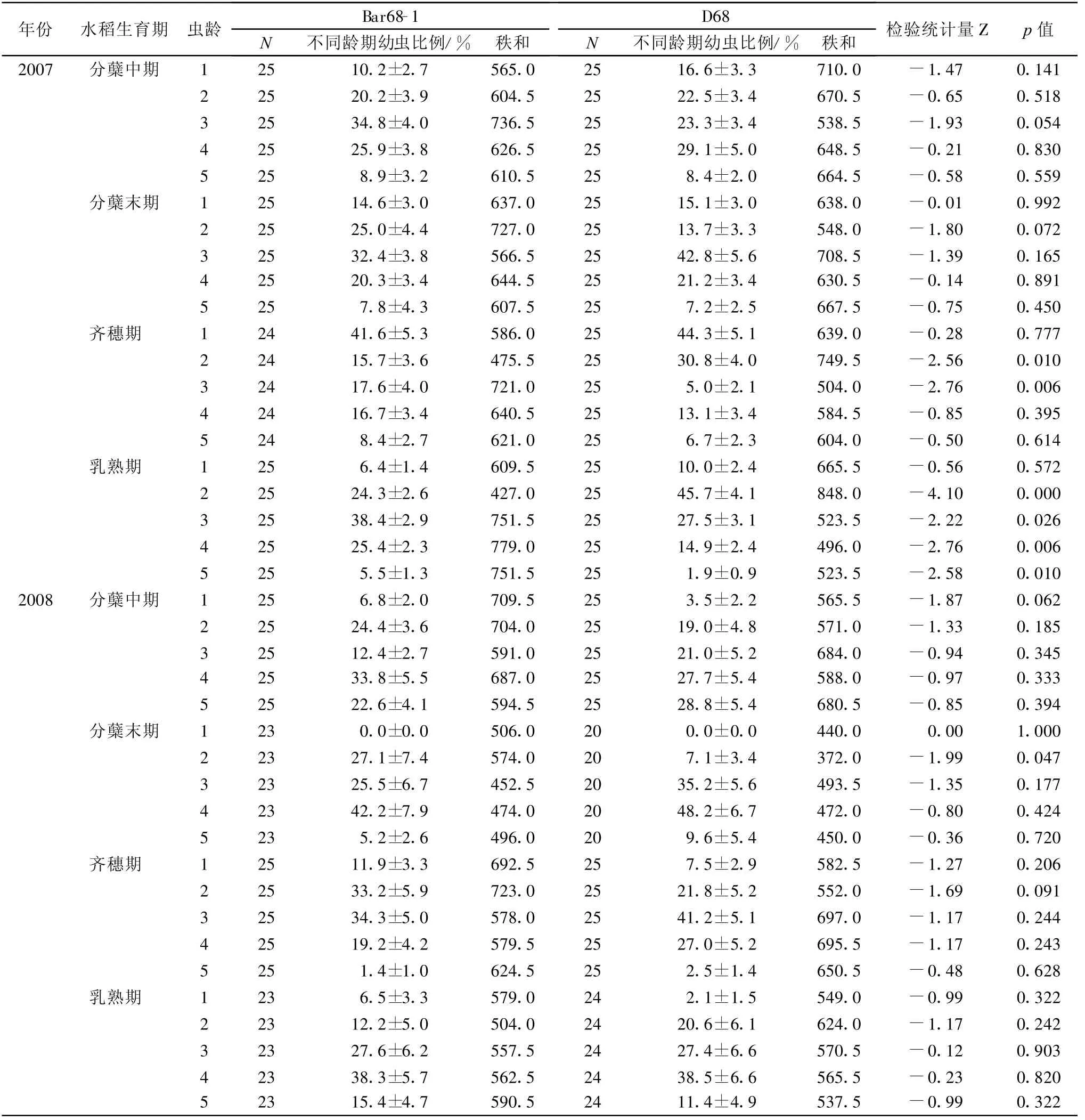
表1 抗除草剂转基因水稻‘Bar68-1’与非转基因对照‘D68’稻田稻纵卷叶螟幼虫发育阶段比较
2.2 抗除草剂转基因水稻‘Bar68-1’稻田稻纵卷叶螟的为害情况
田间调查结果表明,稻纵卷叶螟发生为害严重,水稻受害叶片数和卷叶率均较高。除2007年的水稻分蘖末期外,抗除草剂转基因水稻‘Bar68-1’与非转基因亲本对照‘D68’在大多数生育期的单株受害叶片数和卷叶率差异不显著(图3~图6)。水稻植株叶片受稻纵卷叶螟为害造成的卷叶指数在转基因稻田与非转基因稻田之间表现基本一致(差异不显著的调查期占全部调查期的62.5%)。
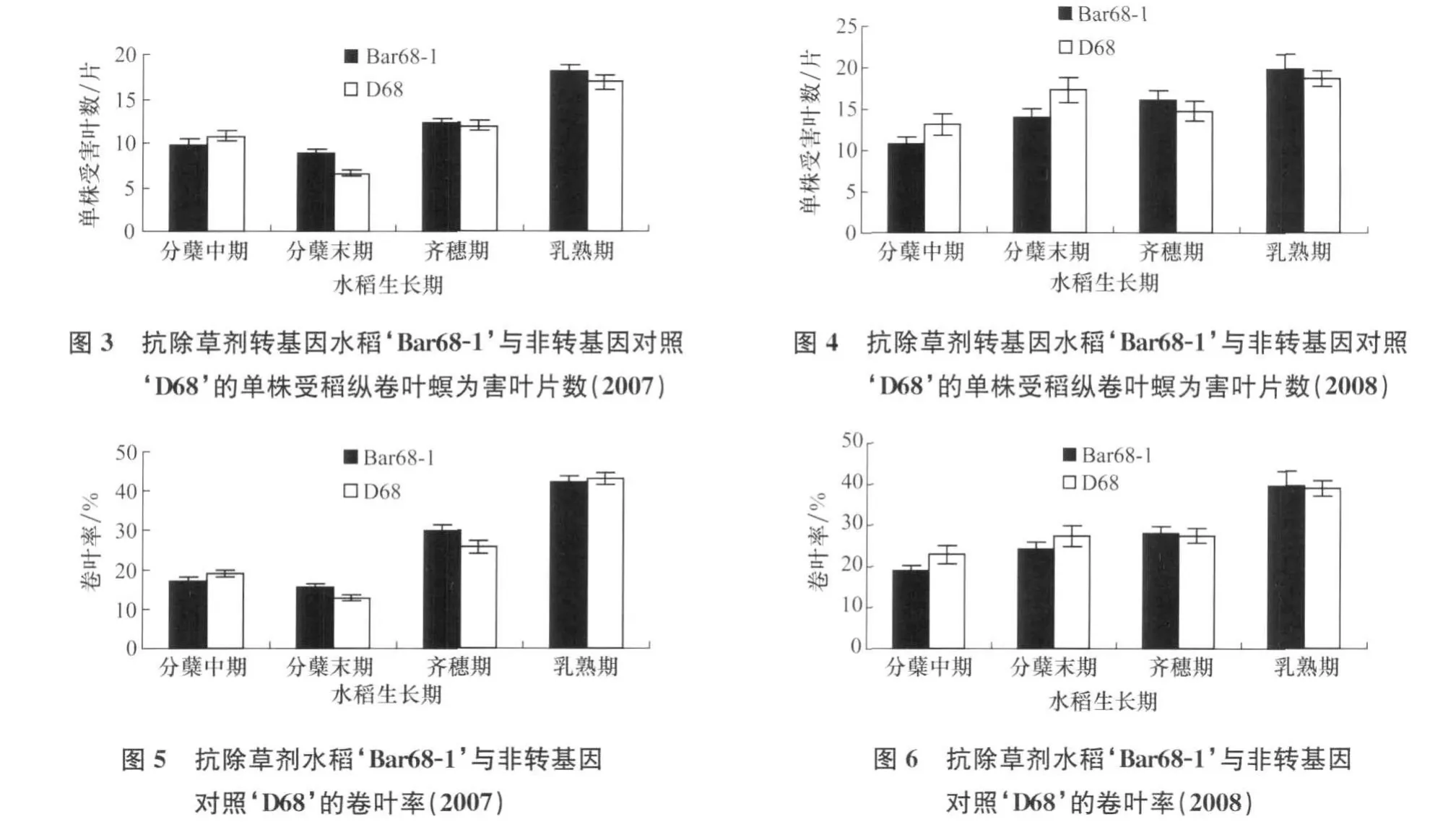
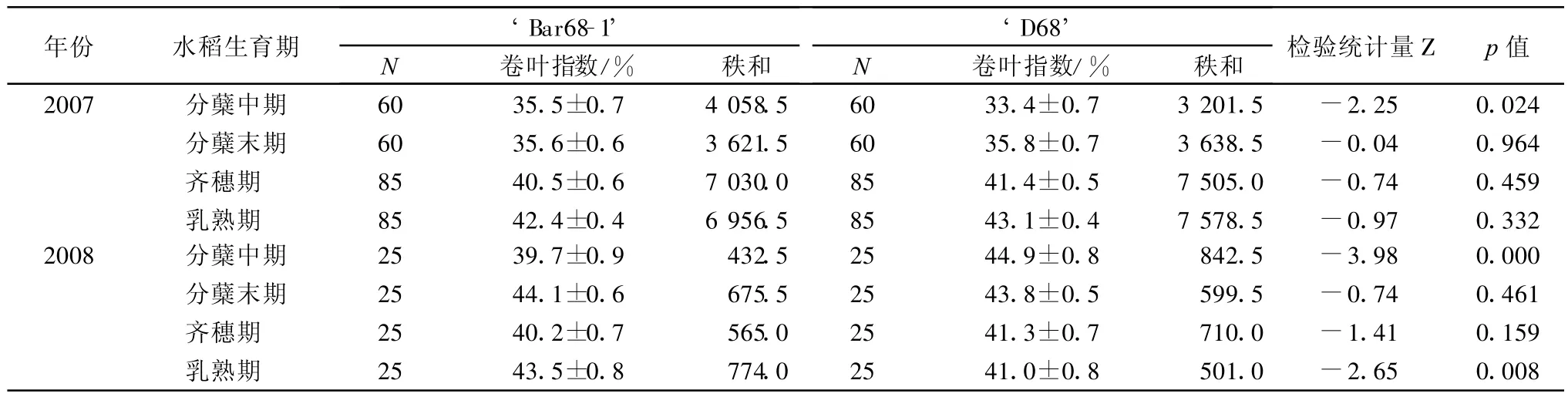
表2 抗除草剂转基因水稻‘Bar68-1’与非转基因对照‘D68’叶片受稻纵卷叶螟为害程度
3 讨论
转基因作物给生态环境造成的影响一般可分为直接影响和间接影响两种。如果转基因作物对非目标生物种群有直接毒理效应就是直接影响;如果转基因作物的推广应用使田间管理和农事操作发生改变,即因作物耕作制度改变从而带来农田生物多样性变化的,属于间接影响[18]。抗除草剂转基因作物对生态环境造成的影响也同样可分为抗除草剂作物的直接影响和使用除草剂带来的间接影响两种。为了减少试验影响因素的干扰,本试验并未使用草铵膦除草剂,只对稻纵卷叶螟的发生、发育及其对转基因抗除草剂水稻的致害程度进行了调查,即试验只研究抗除草剂水稻本身的直接影响,避免了除草剂及其与作物交互作用的干扰。研究结果表明,转基因抗除草剂水稻‘Bar68-1’对非目标物种稻纵卷叶螟没有直接影响(或者说其影响与非转基因对照品种基本一致)。
抗除草剂水稻对生态环境的影响与使用传统除草剂的影响有无本质区别,是个值得探讨的问题。如果抗除草剂水稻是因为使用了除草剂而使杂草数量减少,进而致使以杂草为食或为栖息地的非目标生物受到影响,那么这种影响是因使用除草剂造成的,应当属于间接影响。这种生态风险并不属于转基因技术所独有的风险[18],传统除草剂的使用也会产生同样的生态安全问题。田间进行的定量研究表明,农业管理方式的变化对非转基因作物农田生态环境造成的影响与转基因作物的影响一样显著[2]。在加拿大安大略省进行的转基因抗草甘膦作物及其管理方式对土壤腐食性生物丰度的影响研究结果表明,受观测生物群体的绝对丰度很少受到除草剂或作物品种的影响,其中差异显著的影响不能在所有年份或一年内的所有取样时间保持一致,转基因作物与传统农业管理措施的改变对非目标生物具有相同的潜在影响[14]。
转基因作物对非目标生物可能带来的生态风险取决于转基因作物的类型、外源基因导入性状的性质和转基因作物释放的环境等具体情况。通常认为要观察所有可能受到转基因作物影响的非目标物种是不可行的,需为风险评估选择一个指示物种[20]。理想的指示物种应是转基因作物释放的环境中最具代表性的类群[19]。因此指示物种的选择也应当具体问题具体分析,依照个案原则进行。Hilbeck等[21]应用改良事件树分析程序提出了21个杂草与鳞翅目昆虫的非目标物种组合,这些组合可作为对抗除草剂转基因玉米在德国释放种植后进行监测的指示物种;他们也同样提到没有必要对所有组合都进行监测。对本试验研究的抗除草剂转基因水稻‘Bar68-1’而言,因稻纵卷叶螟在该水稻种植区域普遍发生,对该区域的稻田生态特点具有一定的代表性,可以作为评估‘Bar68-1’对非目标生物的生态风险的一个指示物种。
[1]Wolfenbarger L L,Phifer P R.Biotechnology and ecology-T he ecological risks and benefits of genetically engineered plants[J].Science,2000,290(5499):2088-2093.
[2]Craig W,Tepfer M,Degrassi G,et al.An overview of general features of risk assessments of genetically modified crops[J].Euphytica,2008,164(3):853-880.
[3]Watkinson A R,Freckleton R P,Robinson R A,et al.Predictions of biodiversity response to genetically modified herbicidetolerant crops[J].Science,2000,289(5484):1554-1557.
[4]Andow D A,Zwahlen C.Assessing environmental risks of transgenic plants[J].Ecol Lett,2006,9(2):196-214.
[5]Ammann K.Biodiversity and genetically modified crops[M]∥Ferry N,Gatehouse A M R.Environmental impact of genetically modified crops.CAB International,2009:240-264.
[6]James C.Global status of commercialized biotech/GM crops:2008.ISAAA Brief 39-2008[M].Ithaca,NY:ISAAA,2008.
[7]Marshall A.13.3 million farmers cultivate GM crops[J].Nat Biotechnol,2009,27(3):221.
[8]Huang D N,Li J Y,Zhang S Q,et al.New technology to examine and improve the purity of hybrid rice with herbicide resistant gene[J].Chin Sci Bull,1998,43(9):784-787.
[9]Toldi O,Toth S,Oreifig A S,et al.Production of phosphinothricin tolerant rice(Oryza sativaL.)through the application of phosphinothricin as growth regulator[J].Plant Cell Rep,2000,19(12):1226-1231.
[10]Cao M X,Huang J Q,Wei Z M,et al.Engineering higher yield and herbicide resistance in rice by Ag robacterium-mediated multiple gene transformation[J].Crop Sci,2004,44(6):2206-2213.
[11]Endo M,Osakabe K,Ono K,et al.Molecular breeding of a novel herbicide-tolerant rice by gene targeting[J].Plant J,2007,52:157-166.
[12]Xiao G Y,Yuan L P,Sun S S M.Strategy and utilization of a herbicide resistance gene in two-line hybrid rice[J].Mol Breed,2007,20(3):287-292.
[13]Ahn I P.Glufosinate ammonium-induced pathogen inhibition and defense responses culminate in disease protection in bartransgenic rice[J].Plant Physiol,2008,146:213-227.
[14]Powell J R,Levy-Booth D J,Gulden R H,et al.Effects of genetically modified,herbicide-tolerant crops and their management on soil food web properties and crop litter decomposition[J].J Appl Ecol,2009,46(2):388-396.
[15]肖国樱,熊绪让,肖喜才,等.转基因抗除草剂两系杂交早稻高产栽培技术研究[J].湖南农业科学,2006(1):32-34.
[16]Elazegui F A,Soriano J,Bandong J,et al.Methodology used in the IRRI integrated pest survey[M]∥IRRI.Crop Loss Assessment in Rice.Manila,Philipppines:International Rice Research Institute,1990:243-271.
[17]IRRI.Standard evaluation sy stem for rice(SES)[M].M anila,Philipppines:International Rice Research Institute,2002.
[18]Poppy G.GM crops:environmental risks and non-target effects[J].T rends Plant Sci,2000,5(1):4-6.
[19]Garcia-Alonso M,Jacobs E,Raybould A,et al.A tiered system for assessing the risk of genetically modified plants to nontarget organisms[J].Environ Biosafety Res,2006,5(2):57-65.
[20]Schuler T H,Poppy G M,Denholm I,et al.Recommendations for assessing effects of GM crops on non-target organisms[C].Bcpc Conference:Pests&Diseases 2000,Vols 1-3,Proceeding s.Farnham;British Crop P rotection Council,2000:1221-1228.
[21]Hilbeck A,Meier M,Benzler A.Identifying indicator species for post-release monitoring of genetically modified,herbicide resistant crops[J].Euphy tica,2008,164(3):903-912.
Effects of genetically modified herbicide-tolerant rice on natural populations of rice leaf roller
Jiang Xianbin1,2,3, Xiao Guoying1
(1.Key Laboratory of Agro-Ecological Processes in Subtropical Region,Institute of Subtropical Agriculture,Chinese Academy of Sciences,Changsha410125,China;2.Research Institute of Rice,Guangxi Academy of Agricultural Sciences,Nanning530007,China;3.Graduate University of Chinese Academy of Sciences,Beijing100049,China)
[Objective]This study attempted to investigate the effects of genetically modified herbicide-tolerant(GMHT)rice(Oryza sativaL.)‘Bar68-1’on non-target organisms.[Method]The population density,larval development of the indicator species rice leaf roller,Cnaphalocrocis medinalisGuené e,and rice damage degrees were investigated both in the genetically modified herbicide tolerant(GMHT)rice‘Bar68-1’fields and non-GM rice‘D68’fields.[Result]There was no significantly difference in larval population density of rice leaf roller in the GMHT rice fields and in the control,except in the milky stage in 2007;larval development in the fields of GMHT rice wassimilar to that in the control.The number and percentage of rolled leaves per plant had nosignificant difference in GMHT and non-GM rice except at late tillering stage of rice in 2007.Damage ratings of the rolled leaves between GMHT and non-GM rice were basically the same.[Conclusion]The effects of GMHT rice‘Bar68-1’on natural populations of rice leaf roller in rice fields were similar to that of non-GM rice‘D68’.
GMHT rice; non-target organisms; indicator species; rice leaf roller; natural population
S 435.112;Q 145.1
A
10.3969/j.issn.0529-1542.2011.02.010
2010-01-19
2010-03-22
转基因生物新品种培育科技重大专项(2008ZX08001-003);中国科学院知识创新工程重大项目(KSCX1-Yw-03)
*通信作者Tel:0731-84619770;E-mail:xiaoguoying@isa.ac.cn

