空肠弯曲菌AhpC蛋白的克隆表达及抗原性分析*
曹芳芳,孟凡亮,乔 博,张茂俊,张建中
2.中国疾病预防控制中心传染病预防控制所,北京102206
空肠弯曲菌AhpC蛋白的克隆表达及抗原性分析*
曹芳芳1,孟凡亮2,乔 博2,张茂俊2,张建中2
目的 构建空肠弯曲菌烷基过氧化氢还原酶(ahpC)基因的原核表达系统,克隆表达AhpC蛋白,用Western blot以及ELISA方法检测表达蛋白的抗原性,为筛选空肠弯曲菌感染后特异性抗体检测试剂的制备奠定基础。方法 用PCR方法从中国分离菌株ICDCCJ07001的染色体DNA中扩增出ahpC基因,将目的基因插入表达载体pGEX-4T-1后转化入大肠杆菌E.coliBL21(DE3),IPTG诱导重组质粒pGEX-ahpC的表达。SDS-PAGE分析表达产物,采用GST标签亲和层析柱纯化表达蛋白。应用兔免疫血清、临床感染者血清以及健康无感染者血清,利用Western blot以及ELISA的方法分析AhpC蛋白的抗原性并初步评价其在ELISA检测方法中的应用。结果 PCR扩增及双酶切鉴定证实重组质粒构建成功。重组表达蛋白经飞行质谱鉴定为空肠弯曲菌AhpC蛋白,Western blot及ELISA检测结果显示AhpC具有特异抗原性。结论 成功构建了ahpC重组表达载体pGEX-4T-1/ahpC,并在大肠杆菌中高效表达。空肠弯曲菌AhpC蛋白具有抗原性,可以作为空肠弯曲菌感染后血清抗体检测的特异抗原。
空肠弯曲菌;克隆表达;AhpC;抗原性
2.中国疾病预防控制中心传染病预防控制所,北京102206
空肠弯曲菌(Campylobacterjejuni,C.jejuni)是一种微需氧,需要丰富营养的弯曲菌属。空肠弯曲菌的感染是发达国家和发展中国家导致人类腹泻的主要病原菌[1-2]。空肠弯曲菌前期感染是常见的导致炎症性神经病的细菌,例如格林巴利综合征(GBS)和fisher综合征(MFS)[3]。三分之一格林巴利综合征患者有空肠弯曲菌前驱感染[4]。虽然血清抗体的检测结果通常不作为细菌感染的诊断指标,但对于空肠弯曲菌感染导致GBS的病因分析具有重要价值。目前我国对于空肠弯曲菌血清特异抗体检测的试剂缺乏,获得高灵敏度、高特异度的空肠弯曲菌抗体的检测抗原具有重要的价值。
本研究组前期研究以空肠弯曲菌的全菌可溶性蛋白作为抗原,应用 Western-blot方法,发现AhpC蛋白可能具有抗原性,为进一步确定AhpC蛋白的抗原性特征并初步评价其在ELISA检测方法中的应用,本研究拟用原核重组蛋白表达系统进行AhpC蛋白的克隆表达,分析其重组蛋白的抗原性,并初步确定其在ELISA检测方法中的应用。
1 材料与方法
1.1 材料 空肠弯曲菌中国菌株ICDCCJ07001及质粒pGEX-4T-1由本实验室培养和保存;EX-Taq酶,限制性内切酶BamH I和XhoI,T4DNA连接酶,Pmd18-T Vector,protein marker,均购自大连TaKaRa公司;大肠杆菌E.coliDH5a,菌株E.coliBL21(DE3),Taq DNA聚合酶,dNTP,DNA marker,细菌基因组DNA提取试剂盒,DNA电泳琼脂糖凝胶回收试剂盒,质粒提取试剂盒购自天根生化科技(北京)有限公司;GST标签的快速亲和层析柱购自GE Healthcare公司;辣根过氧化物酶标记SPA(北京博奥森生物技术公司);兔免疫血清(本科室制备);其他试剂均为国产分析纯。引物合成由上海生工生物技术有限公司北京合成部完成,DNA测序由天一辉远公司完成,蛋白飞行质谱鉴定由本实验室完成。
1.2 方法
1.2.1 PCR的扩增 运用SwissPrpt预测AhpC蛋白的信号肽,确定其存在信号肽的概率几乎为0,Primer5.0设计对应基因的引物。ahpC上游引物:5′-CGCGGATCCATGATAGTTACTAAAAAA GCTTTAGATTT-3′;下游引物:5′-CCGCTCGAG TTAAAGTTTAGCTTCGTTTTTGC-3′,分 别 插入BamHI和XhoI的酶切位点。引物由上海生工公司合成。
PCR扩增体系为:75μL体系,扩增条件:95℃预变性5min,然后按以下参数进行30个循环:95℃变性1min,55℃退火1min,72℃延伸90s,最后72℃延伸5min,4℃保存。取PCR产物75μL,1%的琼脂糖凝胶(0.01‰GelRed染色),80V电泳50min,在凝胶电泳成像仪下切胶。
1.2.2 重组质粒的构建及鉴定 用琼脂糖凝胶切胶回收试剂盒回收PCR产物,将胶回收的PCR产物和表达载体pGEX-4T-1分别用BamH I和XhoI进行双酶切,30μL酶切体系:PCR产物与表达载体各20μL,10×buffer K 3μL,双蒸水5μL;酶BamH I,XhoI各1μL。酶切条件:30℃1h;37℃3h。酶切产物用1%的琼脂糖切胶回收,利用普通琼脂糖凝胶回收试剂盒进行胶回收。目的基因与表达载体以摩尔比6∶1的比例混合加入T4DNA连接酶16℃ 连接过夜。取连接产物1μL转化至E.coliBL21(DE3)感受态细胞,将转化菌均匀涂布于含氨苄青霉素的LB平板上,37℃过夜培养后挑选单菌落接种于5mL含氨苄青霉素的LB液体培养基中,37℃,200r/min摇床过夜,用质粒小提试剂盒抽提质粒,进行质粒的双酶切鉴定,阳性重组质粒命名pGEX-4T-1/ahpC。
1.2.3 重组质粒的诱导表达及表达水平的鉴定将阳性克隆子菌落接种到5mL含氨苄青霉素的LB液体培养基中,37℃,200r/min摇至菌液浓度OD值约为0.6~1.0时加入终浓度0.5mmol/L的IPTG,37℃诱导表达4h。用2只试管分别取菌液样品1mL,用0.01mol/L的PBS洗菌2次,其中1管菌液超声破碎处理;4 ℃,8 000r/min,离心30min,分离上清和沉淀,沉淀加入PBS悬浮;另一管菌液也加PBS悬浮;上清,沉淀,全菌蛋白各取30μL直接加4×蛋白上样缓冲液10μL,跑SDSPAGE电泳,分析重组蛋白的存在状态。
1.2.4 飞行质谱蛋白鉴定 SDS-PAGE电泳后,诱导表达的蛋白做考染胶切点制备质谱样,用飞行质谱鉴定克隆子表达蛋白的种类。AhpC蛋白质谱鉴定结果为空肠弯曲菌的烷基过氧化氢还原酶(AhpC)蛋白,其分子量约为22kD,其鉴定结果的可信度为100%。
1.2.5 Western-blot分析 表达产物用厚度为0.75mm的凝胶跑SDS-PAGE电泳,之后把准备好的PVDF膜用甲醇活化40s,然后将凝胶,5层滤纸,PVDF膜置于转膜液中浸泡活化20min,至半干式电转印仪25V转印60min,用含0.1%Tween 20的TBS(TBST)洗膜3次,每次10min,然后转入封闭液(1×TBS+0.5%脱脂奶粉+0.05%的Tween20)中,4℃封闭过夜;取出PVDF膜,用TBST洗膜3次,每次10min;加入1∶100的一抗反应液(空肠弯曲菌免疫前、后兔血清)37℃缓慢摇动孵育120min;取出PVDF膜用TBST洗膜3次,每次10min;加入1∶10 000的二抗反应液(辣根过氧化酶标记rSPA)37℃缓慢摇动孵育60min;洗膜后加入DAB(6mg DAB、10μL H2O2、1×TBS稀释至10mL)摇床上缓慢摇动显色1min,显色后用蒸馏水终止反应。
1.2.6 ELISA方法检测AhpC重组蛋白抗原特异度、灵敏度 利用上述方法获得的AhpC重组蛋白抗原包被ELISA检测板(每孔所含的蛋白为1μg),检测空肠弯曲菌免疫前血清、免疫后血清以及其它病原免疫血清,包括幽门螺杆菌免疫血清、小肠结叶尔森氏菌免疫血清、大肠杆菌O157∶H7免疫血清、霍乱弧菌免疫血清。血清稀释度分别为1∶100~1∶102 400。利用AhpC重组蛋白抗原包被ELISA检测板检测实验室验证的12份空肠弯曲菌抗体阳性患者血清,17份空肠弯曲菌抗体阴性血清进行抗体检测。
2 结 果
2.1 PCR扩增结果 琼脂糖凝胶电泳显示AhpC基因的PCR产物大小在597bp左右,与AhpC的基因预期大小相符。测序结果与GenBank数据库所收录的AhpC基因一致,见图1。

图1 AhpC PCR扩增凝胶电泳分析1.DNA 分 子 量 标 准;2-4.AhpC PCR 扩 增 结 果(597bp)Fig.1 Agarose gel electrophoresis analysis of AhpC PCR product1:DNA marker;2-4:PCR product of AhpC(597bp)
2.2 重组质粒酶切鉴定结果 重组质粒双酶切后经琼脂糖电泳检测到大小为597bp的片段,证明ahpC-pGEX构建成功,见图2。

图2 重组质粒酶切鉴定结果1.DNAmarker III,2.重组质粒ahpC-pGEX双酶切Fig.2 Identification of the recombinant plasmid1.DNAmarker III;2.recombinant ahpC- pGEX digested by BamH I and XhoI
2.3 目的蛋白的诱导表达 重组菌诱导前后表达产物的SDS-PAGE显示,诱导的重组菌在约48kD处有一蛋白条带,同预计的大小相吻合,而未诱导菌无此条带,见图3。
2.4 质谱鉴定结果 AhpC蛋白质谱鉴定结果为所表达蛋白条带为空肠弯曲菌的烷基过氧化氢还原酶(AhpC)蛋白,其分子量约为22kD,其鉴定结果的可信度为100%。

图3 目的蛋白的诱导表达1.protein marker;2.空宿主菌 BL21的诱导;3.携带表达载体pGEX的宿主菌BL21的诱导;4.携带重组表达载体ahpC-pGEX的宿主菌BL21的未诱导;5.携带重组表达载体ahpC-pGEX的宿主菌BL21的诱导后菌体超声破碎的沉淀;6.携带重组表达载体ahpC-pGEX的宿主菌BL21的诱导后菌体超声破碎的上清;7.重组质粒ahpC-PGEX表达纯化后的蛋白。Fig.3 The expression product of the recombinant plasmid ahpC-PGEX1:Protein marker;2:the induction of BL21without PGEX;3:Expression product of induced PGEX in BL21;4:expression product of the ahpC-PGEX without induction in BL21;5:Precipitatant of induced BL21that transformed ahpC-PGEX;6:Supernatant of induced BL21that transformed ahpCPGEX;7:Purified protein of expression product of ahpC-PGEX in BL21
2.5 Western blot图片 纯化后的ahpC表达的蛋白作为抗原,一抗用3组6种血清,分别是从散发格林巴利综合征患者分离到的空肠弯曲菌菌株免疫兔子得到的多抗血清,暴发格林巴利综合征患者分离到的空肠弯曲菌菌株免疫兔子得到的多抗血清,普通腹泻病病人分离到的空肠弯曲菌菌株免疫兔子得到的多抗血清,一抗的浓度1∶50;二抗用HRPSPA,浓度1∶10 000。
2.6 ELISA检测结果 显示克隆表达的空肠弯曲菌的AhpC蛋白作为抗原检测空肠弯曲菌抗体具有较高的灵敏度和特异度。
2.6.1 AhpC抗原包被ELISA板对不同血清抗体检测OD值 见表1、表2。
2.6.2 应用AhpC重组蛋白抗原12份临床阳性标本血清,17份人群阴性血清进行抗体检测结果。
3 讨 论
本研究建立了用pGEX-4t-1载体表达C.jICDCCJ07001的ahpC基因。Western-blot检测rahpC的抗原性,以空的BL21宿主菌,含pGEX的BL21宿主菌作为阴性对照,ahpC的表达产物与GBS散发相关的空肠弯曲菌,与2007年吉林GBS暴发菌株ICDCCJ07001相关的空肠弯曲菌,及与普通腹泻相关的空肠弯曲菌全菌的抗血清均起反应,表明AhpC蛋白可能是空肠弯曲菌血清学诊断的候选抗原。

表1 AhpC抗原包被ELISA板对不同血清抗体检测Table 1 OD value to AhpC antigen as ELISA of different serum antibodies test
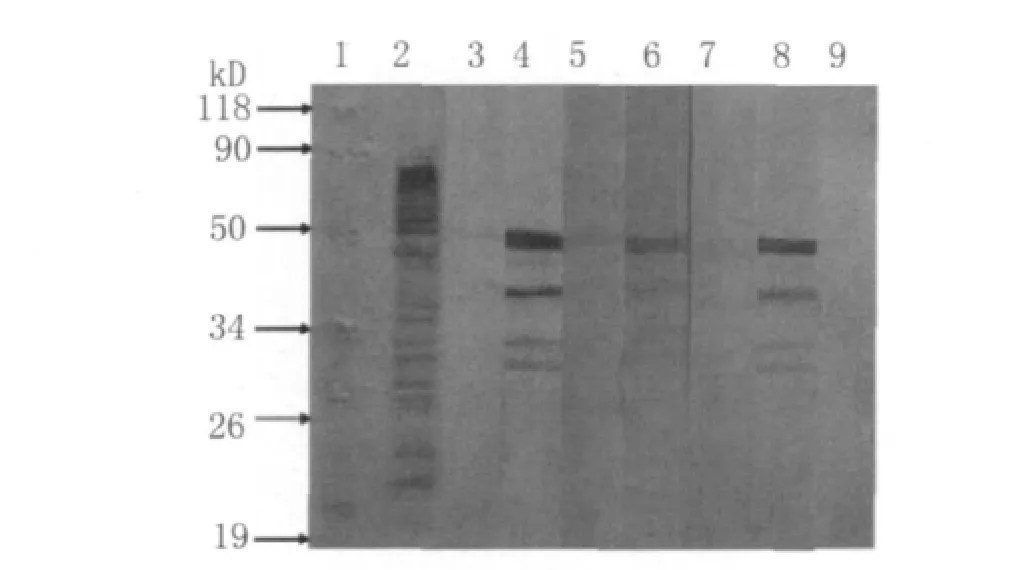
图4 表达产物的Western-blot鉴定1.Protein marker;2.ICDCCJ07001全菌蛋白做阳性对照;3.散发GBS分离到的C.j免疫前兔血清;4.散发GBS分离到的C.j免疫后多抗兔血清;5.爆发GBS分离到的C.j ICDCCJ07001免疫前兔血清;6.爆发GBS分离到的C.j ICDCCJ07001免疫后多抗兔血清;7.普通腹泻病人分离到的C.j免疫前兔血清;8.普通腹泻病人分离到的C.j免疫后多抗兔血清;9.阴性对照。Fig.4 The results of Western-blot analysis1.Protein marker;2.Positive control;3.Blood serum of the rabbit before immunized by the C.jisolated from scattered GBS patient;4.Blood serum of the rabbit immunized by the C.jisolated from scattered GBS patient;5.Blood serum of the rabbit before immunized by the C.j isolated from outbreak GBS patient;6.Blood serum of the rabbit immunized by the C.j isolated from outbreak GBS patient;7.Blood serum of the rabbit before immunized by the C.jisolated from diarrhea patient;8.Blood serum of the rabbit immunized by the C.j isolated from diarrhea patient;9Negative control
研究表明,空肠弯曲菌因其与神经组织具有相同或类似的抗原成分促使机体对抗原的错误识别从而引起自身免疫反应导致GBS的发生[5]。因此,获得能够有效评价空肠弯曲菌感染后特异抗体水平的有效抗原,不仅可以进行针对空肠弯曲菌感染的血清学诊断,同时对于既往感染者血清抗体分布的流行病学研究以及进一步探索空肠弯曲菌引起肠外感染的致病机制具有重要意义[6]。
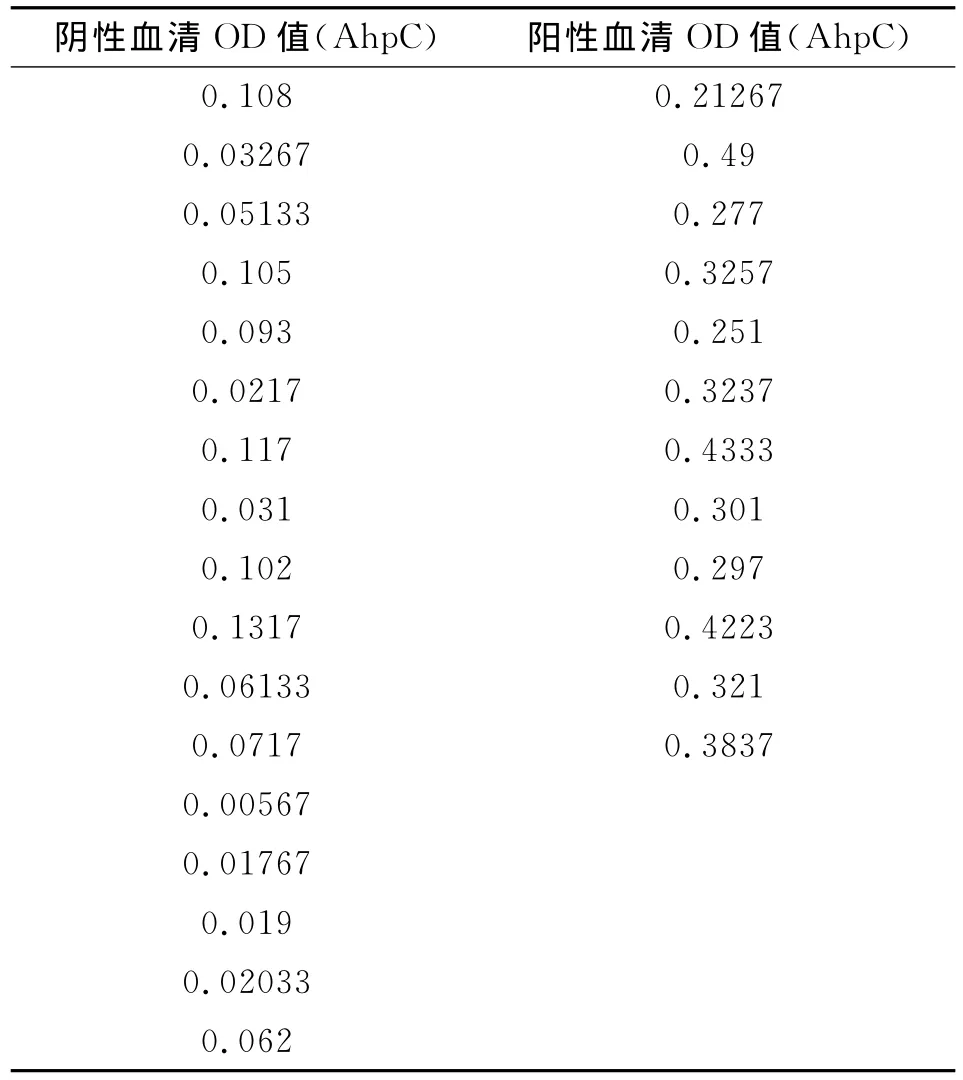
表2 临床标本检测结果Table 2 Results of the detection of clinical samples
本研究对编码空肠弯曲菌小分子外膜蛋白ahpC的基因进行克隆,并进行序列测定,所得序列与GenBank公布的ICDCCJ07001的ahpC序列一致性为100%;成功构建重组表达载体ahpC-pGEX,经过双酶切及测序鉴定,结果与预测一致;经42℃转化入感受态细胞BL21(DE3)中;重组工程菌在37℃使用IPTG进行诱导表达,SDS-PAGE电泳可见相对分子质量约为48kD的目的蛋白;经超声破菌和电泳分析,重组表达蛋白存在可溶性成分,经蛋白飞行质谱鉴定所得蛋白为烷基过氧化氢还原酶,用GST标签的亲和层析柱纯化得到重组蛋白,经Western-blot检测证明AhpC具有针对空肠弯曲菌抗体的特异的抗原性,同时标签蛋白谷胱甘肽(GST)经 Western-blot验证与空肠弯曲菌抗体不反应,证明其没有抗原性。本研究利用重组表达的AhpC蛋白作为ELISA抗原分别检测了免疫血清以及实验室保存的空肠弯曲菌抗体阳性及阴性血清,同时检测了其它肠道感染病原的免疫血清,证明AhpC重组蛋白针对空肠弯曲菌抗体均有较高的特异性,不与其它免疫血清发生交叉反应,100%(12/12)的阳性临床患者血清获得阳性结果,100%(17/17)的阴性血清获得阴性结果,表明本研究获得的AhpC蛋白具有检测空肠弯曲菌血清抗体的特异的抗原性,可以作为检测空肠弯曲菌抗体的候选抗原。作为诊断试剂其特异度、灵敏度可能需要增加样本量继续验证,但本研究的小样本检测结果证实,其灵敏度、特异度均为100%。
AhpC是一种硫氧还原蛋白依赖的烷基过氧化氢还原酶,是抗氧化酶家族peroxire-doxins(prxs)的成 员 之 一[7]。抗 氧 化 酶 家 族 peroxire-doxins(prxs)种类繁多,其功能除了抗氧化功能外,还可以调解细胞信号传导,细胞的凋亡和分化[8]。其作用是通过在高氧化环境中还原有毒的氢化氧化物来实现的[3]。像空肠弯曲菌这样的微需氧病原生物,AhpC蛋白是其能够在有氧环境中生存的决定因素[2]。烷基过氧化氢还原酶是细菌清除活性氧(ROS)的一种主要成分,AhpC基因功能缺陷能导致多效的表型改变,包括形态学和细胞表面性质的改变[9]。在多数细菌中,AhpC是双组分系统,由蛋白AhpF和AhpC组成。AhpC在过氧化物还原酶活性中起主要作用[10]。本研究除了提示空肠弯曲的诊断抗原外,也为进一步研究烷基过氧化氢还原酶的作用机制奠定基础。
[1]Kirkpatrick BD,Tribble DR.Update on human Campylobacter jejuni infections[J].Curr Opin Gastroenterol,2011,27(1):1-7.
[2]Baillon ML,van Vliet AH,Ketley JM,et al.An Iron-Regulated Alkyl Hydroperoxide Reductase(AhpC)Confers Aerotolerance and Oxidative Stress Resistance to the Microaerophilic PathogenCampylobacterjejuni[J].Journal of Bacteriology,1999,181(16):4798-4804.
[3]李艳青,段广才,宋春花,等.幽门螺杆菌ahpC基因的克隆与原核表达[J].西安交通大学学报(医学版),2010,31(1):47-50.
[4]Israeli E,Agmon-Levin N,Blank M,et al.Guillain-Barr Syndrome-A Classical Autoimmune Disease Triggered by Infection or Vaccination[J].Clin Rev Allergy Immunol,2010:[Epub ahead of print]
[5]Lazzaroni JC,Portalier R.TheexcCgene ofEscherichiacoliK-12required for cell envelope integrity encodes the peptidoglycanassociated lipoprotein(PAL)[J].Mol Microbiol,1992,6(6):735-742.
[6]乔博,孟凡亮,顾一心,等.空肠弯曲菌外膜蛋白rOMP18克隆表达及抗原性分析[J].中国人兽共患病学报,2011,27(1):41-45.
[7]Papinutto E,Windle H J,Cendron L.Crystal structure of alkyl hydroperoxide-reductase(AhpC)fromHelicobacterpylori[J].Biochimica Biophsica Acta,2005,1753(2):240-246.
[8]Wood ZA,Poole LB,Hantgan RR,et al.Dimers to doughnuts:redox-sensitive oligomerization of 2-cysteine peroxiredoxins[J].Biochemistry,2002,41(17):5493-504.
[9]Wasim M,Bible AN,Xie Z,et al.Alkyl hydroperoxide reductase has a role in oxidative stress resistance and in modulating Changes in cell-surface properties in Azospirillum brasilense Sp245[J].Microbiology,2009,155:1192-1202.
[10]张卫军,邹全明,毛旭虎,等.重组幽门螺杆菌AhpC基因的克隆表达及其初步纯化[J].重庆医学,2006,35(11):1012-1014.
Cloning,expression,purification and antigenicity analysis of AhpC inCampylobacterjejuni
CAO Fang-fang,MENG Fan-liang,QIAO Bo,ZHANG Mao-jun,ZHANG Jian-zhong
(SchoolofPublicHealth,PekingUnionMedicalCollege,Beijing100730,China)
To clone and express the AhpC protein ofCampylobacterjejuniinE.coliand characterize its antigenicity and specificity.Theahpcgene was amplified by PCR fromC.jejeunistrain ICDCCJ07001,and cloned into pGEX-4T-1.The recombinant PGEX-4T-1-ahpCwas transformed toE.coliBL21(DE3)for protein expression.The expression product was analyzed and identified by SDS-PAGE and MALDI TOF-TOF 4700Proteomics Analyzer.The expressed protein was identified asCampylobacterjejuniAhpC protein by Proteomics Analyzer.Both Western blot and ELISA showed that AhpC had specific antigenicity forCampylobacterjejuni.The expression and purification of recombinant AhpC antigen with good antigenicity and specificity will facilitate the research and clinical application in the diagnosis ofC.jejuniinfection.
Campylobacterjejuni;cloning and expression;ahpC;antigenicity
R378
A
1002-2694(2010)10-0909-05
*中国疾病预防控制中心青年基金 (2009A102);国家自然科学基金(81071314)
张茂俊,Email:zhangmaojun@icdc.cn;
1.北京协和医学院公共卫生学院,北京 100730;
2011-05-21;
2011-08-15

