抗骨桥蛋白抗体对沙鼠肝泡球蚴组织细胞因子表达的影响*
张永国,张示杰,赵江桥,张 龙,曹玉文,彭心宇,吴向未,杨宏强,孙 红
抗骨桥蛋白抗体对沙鼠肝泡球蚴组织细胞因子表达的影响*
张永国1,张示杰1,赵江桥1,张 龙1,曹玉文2,彭心宇1,吴向未1,杨宏强1,孙 红1
目的 观察抗骨桥蛋白(OPN)抗体对沙鼠肝泡状棘球蚴组织中细胞因子表达的影响,并探讨其免疫机制。方法
选长爪沙鼠30只,采用开腹直视下肝脏穿刺接种泡状棘球蚴组织混悬液的方法建立模型后,随机分为实验组(抗OPN抗体干预,10只)、对照组(兔血清干预,10只)和模型组(无干预,10只)。于100d后剖杀所有沙鼠,取肝泡状棘球蚴组织,采用苏木精-伊红(HE)染色法和免疫组织化学SP法观察沙鼠肝泡状棘球蚴组织中IL-2,IL-5,IL-10及TNF-α因子的表达情况。结果 感染泡状棘球蚴的沙鼠肝脏和腹腔中见大小不等的团块状囊泡。IL-2,IL-5及TNF-α在实验组、对照组与模型组间免疫组化染色阳性细胞率比较差异无统计学意义(P>0.05),而实验组IL-10的阳性细胞率明显低于对照组与模型组(P<0.05)。结论 Th1细胞介导的细胞免疫与Th2细胞介导的体液免疫共同参与了宿主抗肝泡状棘球蚴免疫。抗OPN抗体可使IL-10的表达减低。
骨桥蛋白;抗体;肝脏;泡状棘球蚴
肝泡状棘球蚴病(Hepatic alveolar echinococcosis)属恶性人兽共患寄生虫病[1],由多房棘球绦虫的幼虫寄生于肝脏并不断增殖芽生,似癌样浸润扩散,造成肝组织不可逆的进行性损害。泡状棘球蚴对人体来说是感染性外源性物质 ,具有抗原性,可诱发宿主的体液免疫和细胞免疫[2],针对其免疫应答,存在着免疫保护和免疫损伤并存的复杂机制。本课题组前期研究已表明,骨桥蛋白(OPN)在肝泡状棘球蚴纤维囊壁和炎症细胞中高表达,可能与肝泡状棘球蚴的生长及转移相关[3]。本实验通过外源性给予抗OPN抗体,来观察其对肝泡状棘球蚴组织中细胞因子表达的影响,并探讨其免疫机制。
1 材料和方法
1.1 材料
1.1.1 多房棘球蚴和实验动物 泡状棘球蚴种鼠购自新疆医科大学动物实验中心;雌性6周龄长爪沙鼠(Merionesunguiculatus)30只,体重为(30±5)g,购自新疆维吾尔自治区疾控中心。
1.1.2 主要试剂和仪器 鼠抗鼠OPN单克隆抗体、鼠抗鼠TNF-α单克隆抗体及鼠抗鼠IL-10单克隆抗体均购自美国Santa cruz生物科技公司;兔抗鼠IL-2多克隆抗体及兔抗鼠IL-5多克隆抗体均购自北京博奥森生物有限公司;正常兔血清本室自制;即用型免疫组化染色试剂盒(山羊抗小鼠IgG)及二氨基联苯胺(DAB)显色剂(北京中杉生物有限公司);显微镜(0lympus公司,型号CX31RBSF),石蜡切片机(德国莱卡Leica2135型),图像采集系统sonyExwaveHAD(日本sony公司),自动组织包埋机LeicaEGI160(德国Leica公司)等。
1.2 方法
1.2.1 沙鼠分组 随机分为3组,第一组单纯接种泡状棘球蚴组(模型组,10只),第二组在接种泡状棘球蚴同时予以兔抗鼠OPN抗体干预(实验组,10只),第三组在接种泡状棘球蚴同时予以兔血清干预(对照组,10只)。
1.2.2 动物模型的建立 参照文献[4]建立动物模型。将人工腹腔感染泡状棘球蚴18周的长爪沙鼠种鼠经乙醚麻醉快速处死,无菌操作,取出腹腔中泡球蚴组织,选择光滑、透亮、成簇游离于腹腔或附着在腹壁、肠系膜、肝表面的泡状棘球蚴,用生理盐水反复冲洗后,剪碎,过筛,再用生理盐水漂洗3次,用0.5%伊红染色,可见泡状棘球蚴原头蚴1~3个/视野,结构清晰,着色率<l5%,再加庆大霉素、青霉素注射液各250u/mL,制成20%的混合悬液用于动物接种。分别将3组沙鼠麻醉、消毒,采用开腹直视下进行肝内穿刺接种,每只注射悬液0.1mL。
1.2.3 抗OPN抗体及血清注射方法 实验组、对照组于接种后当天分别经尾静脉注射抗OPN抗体0.15mL(效价1∶32)和兔血清0.15mL,以后每隔两日注射1次,注射方法及剂量同上,注射7次后,每隔1周注射1次。模型组无处理。普通饮食饲养100d后处死,摘出沙鼠肝泡状棘球蚴组织进行观察。
1.2.4 观察
1.2.4.1 病理组织学观察 取出沙鼠肝泡状棘球蚴组织,用10%甲醛溶液固定,石蜡包埋、切片,HE染色,镜下观察泡状棘球蚴角质层、生发层病理形态改变及育囊和原头蚴发育情况。
1.2.4.2 免疫组织化学染色分析 采用免疫组织化学SP法检测沙鼠肝泡状棘球蚴组织中IL-2,IL-5,IL-10及TNF-α因子的表达情况。每批染色以磷酸盐缓冲液(PBS)代替一抗作为阴性空白对照。IL-2,IL-5,IL-10及 TNF-α染色阳性为胞浆着色阳性。依据染色程度和阳性细胞数,参照文献[5]制定判断标准,实验结果以阳性细胞的百分率来表示。整个读片过程采用双盲法,由两位病理科医师独立观察后一起做出判断。
2 结 果
2.1 HE染色结果 肝组织内见散在大小不等的泡状棘球蚴小囊,囊壁有均质红染的角质层构成,部分囊内壁见单细胞性的生发层,外壁附少量纤维组织及肝细胞,囊腔内可见多个散在的原头节,部分区可见囊液。泡壁周围肝组织血管扩张充血,慢性炎症细胞浸润(多为淋巴细胞、浆细胞和部分嗜酸性粒细胞),单核巨噬细胞增生形成肉芽肿改变(单核细胞和多核巨细胞形成栅栏样排列)和纤维组织增生。HE染色结果显示实验组、对照组、模型组间囊壁病理的改变无显著性差异(P>0.05)(图1)。
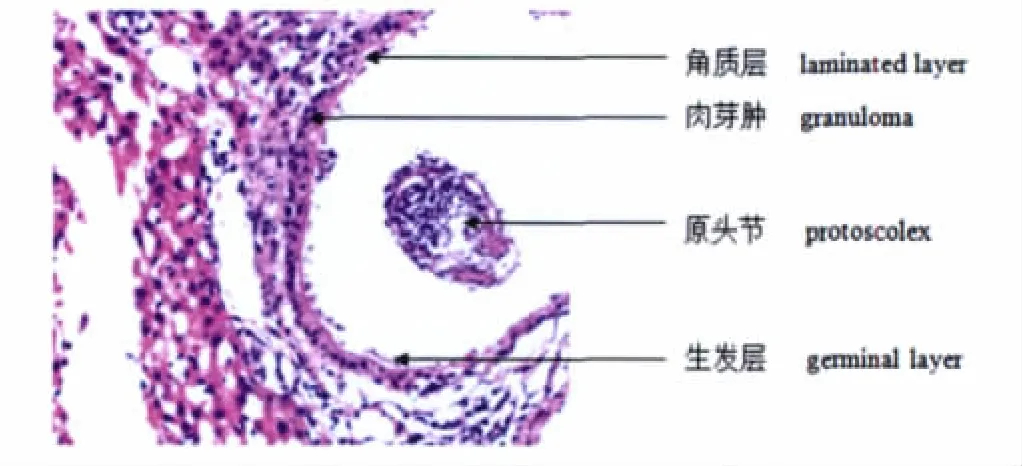
图1 肝脏泡状棘球蚴 (HE染色,×200)Fig.1 Hepatic echinococcus cyst(HE stain,×200)
2.2 免疫组织化学染色分析 免疫组化染色结果显示①肝泡状棘球蚴组织中均可见IL-2,IL-5,IL-10及TNF-α不同程度的表达,均定位于细胞浆,主要分布在肝泡状棘球蚴纤维囊壁的生发层、炎症细胞和部分肝细胞中,以上细胞的细胞浆中可见黄色、棕黄色或棕褐色等阳性颗粒(图2)。②IL-2,IL-5及TNF-α在实验组与对照组、实验组与模型组间免疫组化染色阳性细胞表达率比较无显著性差异(P>0.05),IL-10的阳性细胞表达率在实验组与对照组、实验组与模型组比较有显著性差异(P<0.05)(图3)。

图2 肝泡状棘球蚴IL-10免疫组化染色 (×400)A:实验组;B:对照组;C:空白对照组Fig.2 IL-10expression in hepatic echinococcus cyst(SP,×400)A:experimental group;B:control group;C:blank control group
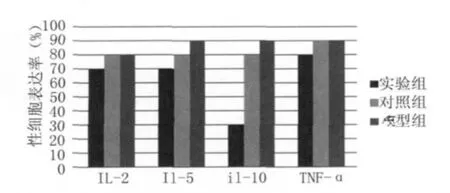
图3 四种因子在肝泡状棘球蚴组织中的阳性细胞表达率Fig.3 Positive expression rate of four kinds of factors in hepatic echinococcus cyst
3 讨 论
在寄生虫免疫中,根据Th细胞产生不同细胞因子的性质,将其分为两个功能亚群,即Th1亚群和Th2亚群[6]。Th1细胞偏向于分泌IL-2、TNF-α和IFN-γ,可促进细胞介导的免疫应答;Th2细胞偏向于分泌IL-4、IL-5、IL-6和IL-10,可增强抗体介导的免疫应答,它们在免疫调节中互相拮抗。泡状棘球蚴对机体来说是感染性外源性物质,具有抗原性,可诱发宿主的体液免疫和细胞免疫。在免疫应答的过程中,OPN可能是最重要也是最早起作用的细胞因子,介导细胞趋化作用,并诱导细胞定向的趋化活动[7]。研究[8-9]发现,在炎症组织修复及肿瘤进展的过程中,OPN可诱导免疫细胞迁移和浸润并促进T细胞的增殖以支持机体的免疫。
本实验共选择了与Th细胞有关的4种细胞因子,即Th1型细胞因子(IL-2、TNF-α)和 Th2型细胞因子(IL-5、IL-10),来探讨在抗 OPN 抗体干预后,宿主对泡球蚴的免疫应答机制。
IL-2主要是由抗原诱导活化的CD+4Th1细胞产生,具有加强宿主免疫力的作用,可抑制肿瘤和寄生虫生长。TNF-α作为Th1细胞分泌的一种免疫反应介质,参与多种感染性疾病的炎症反应和免疫应答。本实验中,IL-2及TNF-α在实验组、对照组与模型组间免疫组化染色阳性细胞率比较差异无统计学意义(P>0.05),这可能是因为,首先肝泡状棘球蚴寄生部位周围出现明显的淋巴细胞、单核巨噬细胞浸润,局部IL-2、TNF-α过量产生,其次泡状棘球蚴本身可直接诱导单核巨噬细胞产生IL-2、TNF-α。感染泡状棘球蚴后,宿主肝脏不仅受到泡球蚴的破坏,还受到代谢性物质的损伤,导致肝组织萎缩,退行性改变,以及局部和全身的免疫应答的改变。
IL-5是由活化的Th2细胞产生,可促进B细胞生长及分化,诱导机体产生体液免疫。IL-10是由Th2细胞产生的一种细胞因子合成抑制因子(CSIF),可抑制Th1细胞克隆合成细胞因子,促进B细胞增殖分化和产生抗体,具有双向调节作用。本实验中,IL-5在实验组、对照组与模型组间免疫组化染色阳性细胞率比较差异无统计学意义(P>0.05),而实验组IL-10的阳性细胞表达率降低,与对照组和模型组比较差异有统计学意义(P<0.05)。研究表明:体内IL-10过表达说明T细胞的免疫功能处于抑制状态,使寄生虫得以逃避宿主的免疫攻击,同时避免宿主的免疫损伤,有利于寄生虫的存活[10]。而在本实验研究中发现IL-10的表达是降低的,这说明抗OPN抗体可提高沙鼠的免疫功能,使以Th2为主的免疫抑制功能有所减弱 ,Th1反应有所增强。这可能因为:抗OPN抗体通过结合体内的OPN,阻碍了OPN的功能,从而抑制泡球蚴的生长,泡球蚴的增殖作用受到抑制,使宿主与寄生虫的相互关系发生改变 ,机体的保护性免疫有所恢复,由于泡球蚴病灶未彻底治愈,故机体的免疫应答仍处于免疫抑制状态。
根治性肝切除是肝泡状棘球蚴病的首选治疗方式,但大部分患者发现时已是晚期,肝内重要血管、胆管及周围脏器受浸,根治性切除率低,文献报道仅为20%~40%[11],未进行治疗的患者5年死亡率高达90%[12]。彭玲等研究发现,抗OPN抗体能通过抑制肿瘤细胞的转移活性同时阻碍肿瘤血管生成,从而达到抑制肿瘤转移的目的。据此本实验在泡球蚴生长过程中,外源性给予抗OPN抗体,以了解宿主的免疫应答变化及寻找抗OPN抗体干预后疗效评价的免疫标志具有重要意义,为临床肝泡状棘球蚴病的治疗提供了线索。
[1]辛维藩,吴新民,郭亚民,等.肝泡球蚴病的分型与外科治疗[J].中华普通外科杂志,2000,15(1):8-9.
[2]Bauder B,Auer H,Schilcher F,et al.Experimental Investigations on the B and T Cell Immune Response in Primary Alveolar Echinococcosis[J].Parasite Immunol,1999,21(8):409-421.
[3]张龙,张示杰,曹玉文,等.骨桥蛋白与肝泡型棘球蚴转移的相关性研究[J].中国寄生虫学与寄生虫病杂志,2011,29(1):33-36.
[4]张金辉,温浩,刘章锁,等.原发性肝泡球蚴动物模型的建立[J].中国局解手术学杂志,2000,9(1):11-13.
[5]陆健,李克,卞建民,等.骨桥蛋白在肝癌中表达的临床意义[J].南京医科大学学报(自然科学版),2007,27(9):931-935.
[6]Mosmann TR,Cherwinski H,Bond MW,et al.Two types of mu-rine helper T cell clone.l.Definition according to profiles of lymphokine activities and secreted proteins.1986[J].J Immunol,2005,175(1):5-14.
[7]NauGJ,Liaw L,Chupp GL.et al.Attenuated host resistance against Mycobacte-rium bovis BCG infection in mice lacking osteopontin[J].Infect Immun,1999,67(8):4223-4230.
[8]Rittling SR,Chambers AF.Role of osteopontin in tumour progression[J].Br J Cancer,2004,90(10):1877-1881.
[9]Chabas D,Baranzini SE,Mitchell D,et al.The influence of the proinflammato-ry cytokine,osteopontin,on autoimmune demyelinating disease[J].Science,2001,294(5547):1731-1735.
[10]Vuitton DA,Godot V,Harraga S,et al.Role of IL-10in Human alveolar echinococcosis[J].J Allergy Clin Immunol,1997,9(2):283.
[11]Polat KY,Balik AA ,Celebi F.Hepatic alveolar echinococcosis:clinical report from an endemic region[J].Can J Surg,2002,45(6):415-419.
[12]Reuter S,ManfrasB,MerkleM,et al.In vitro activities of itraconazole,methiazole,and nitazoxanide versus Echinococcus multilocularis larvae[J].Antimicrob Agents Chemother,2006,50(9):2966-2970.
Effect of anti-osteopontin antibody on expression of cytokines in hepatic alveolar hydatid tissue of gerbil
ZHANG Yong-guo,ZHANG Shi-jie,ZHAO Jiang-qiao,ZHANG Long,CAO Yu-wen,PENG Xin-yu,WU Xiang-wei,YANG Hong-qiang,SUN Hong
(TheFirstAffiliatedHospital,MedicalCollegeofShiheziUniversity,Shihezi832008,China)
In order to observe the effect of anti-osteopontin antibody on expression of cytokines in hepatic alveolar hydatid tissue of gerbil and further discuss the mechanism of anti-osteopontin antibody action.30gerbils were infected withE.multilocularissuspension through abdominal opening injection in liver.Gerbils were randomly divided into experimental group(Anti-OPN antibody interference,ten gerbils),control group(Rabbit serum interfere,ten gerbils)and model group(No intervention,ten gerbils).Gerbils were sacrificed at 100days post infection,Cysts were removed to observe the pathological changes resulting from HE staining,the expression of IL-2,IL-5,IL-10and TNF-αwere measured by immunohistochemistry staining(SP method).The experiment results showed thatE.multiloculariswere spread over the liver and abdominal cavity.Immunohistochemistry staining results indicated that the IL-2,IL-5and TNF-αpositive expression rate in this three groups was no significant difference(P>0.05),and the positive expression rate of IL-10in experimental group was significantly lower than that in the control group and model group(P<0.05).It was concluded that the induction of Th2antibody-mediated immunity(AMI)with a parallel expansion of Th1cell-mediated inflammatory(CMI)responese as an important mechanism of host defence against the hepatic alveolar hydatid.The anti-OPN antibodies could reduce the expression of IL-10.
osteopontin;antibody;liver;alveolar hydatid
R383.3
A
1002-2694(2011)10-0897-04
*国家自然科学基金资助项目(No.30860274)
张示杰,Email:zsj-sh@tom.com
1.石河子大学医学院第一附属医院,石河子 832008;2.石河子大学医学院病理教研室
2011-06-27;
2011-08-11

