预测动脉瘤性蛛网膜下腔出血预后的生化指标研究
赵 勇,赵兰英,林国有
(1.洮南市医院,吉林 洮南 137100;2.农安县人民医院,吉林 农安 130200)
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是致残率及致死率极高的一种颅内血管疾病,约1/3存活下来的患者存在不同程度的神经功能障碍、智力和/或情感功能缺失等。除了动脉瘤破裂出血造成的损害外,缺氧,低血压,脑水肿,脑血管痉挛,及在夹闭、栓塞动脉瘤时操作,都会造成脑组织损伤。aSAH患者预后与Hunt-Hess分级,出血破入脑室,既往高血压病史,及多次出血有关[1]。有学者认为某些生化指标,如S100B蛋白、胶质纤维酸性蛋白(glial flbrillary acidic protein,GFAP)及脑脊液丙二醛(malondialdehyde,MDA)含量等可以作为预测aSAH患者预后生存质量的指标[2、3]。本研究的目的在于确定上述3种生化指标在预测aSAH患者预后中的作用及相应采样时间。
1 材料与方法
1.1 临床资料及评定标准研究对2009年3月—2010年3月,收入本院的52名aSAH患者中的40名进行研究,排除未在急性期内(动脉瘤破裂后3日内)行手术治疗的患者,及术前未行侧脑室引流和腰池置管引流的患者。其中男性18例,女性22人,年龄45-68岁,平均53岁。患者术前神经功能及蛛网膜下腔血量分别采用GCS评分和Fisher分级标准进行评定;患者预后判定标准则为术后6个月时GOS评分,GOS评分定义如下:GOS 5分,恢复良好,即恢复正常工作和生活;GOS 4分,轻度缺陷,即残疾但可独立生活,能在保护下工作;GOS 3分,重度残疾,即清醒、残疾,生活不能自理;GOS 2分,植物生存,长期昏迷,去皮层或去大脑强直状态;GOS 1分,死亡[4]。研究将 6个月后GOS评分为GOS 5分的患者定义为预后良好,GOS为1—4分的患者定义为预后较差。
1.2 脑脊液采样分别在无菌条件下,取患者出血后第3天、第7天、第14天的脑脊液 5 ml;对照组则选取10名腰椎麻醉患者的脑脊液5 ml。取出样品后立即以4 000转/分的速度在4℃下离心20 min,然后将样品装入适当的器皿以-80℃迅速冷冻30 min,之后将样品进行检测。
1.3 检测方法使用Ultrafree-MC离心滤过器将脑脊液中分子量大于100,000的杂质滤过,应用人S100B、GFAP ELIS试剂盒和MDA分光光度计检测试剂盒分别对S100B、GFAP和MDA水平进行定量检测。S100B、GFAP和MDA的最小敏感度分别为0.10 ng/ml,0.05 ng/ml, 和 0.04 μ M 。
1.4 统计分析利用SPSS17.0软件对所得数据进行统计学分析,P<0.05或P<0.01具有统计学意义。实验结果用平均值±标准差表示,年龄变量采用t检验;计数资采用χ2检验;Hunt-Hess分级、Fisher分级(分级资料)采用秩和检验后,预后良好组和预后较差组临床一般资料均无统计学差异(P>0.05)。
2 结果
S100B、GFAP和MDA 3种生化指标对在不同时期对预测aSAH患者预后具有统计学意义(详见表1—3),可作为aSAH患者预后评定标准。其中预后较差组发病后第14天患者脑脊液中MDA含量明显增高,波动明显。
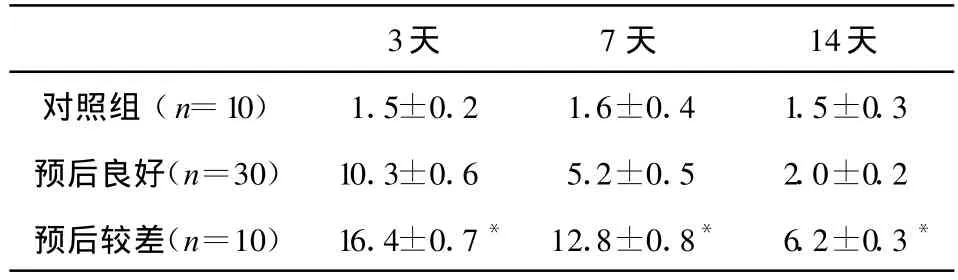
表1 S100B在aSAH后两周内的变化(ng/ml)

表2 GFAP在aSAH后两周内的变化(ng/ml)
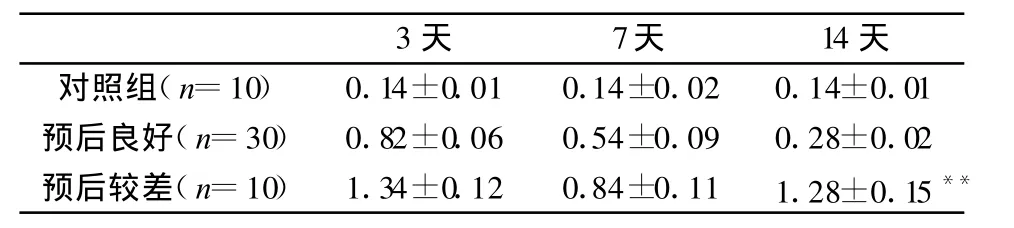
表3 MDA在 aSAH后两周内的变化(μ M)
3 讨论
S100B蛋白和GFAP可对脑组织产生损害,而MDA可用来衡量氧化应激的程度。因此,研究术后aSAH患者脑脊液中3种生化指标,对判断aSAH患者的预后生存质量具有重要意义。其中MDA是预测预后3种生化指标中最有意义的指标。
MDA是脂质过氧化的最终产物,也是氨基酸、核酸和DNA的氧化产物,同时它还可从过度氧化应激的非特异细胞提取出来。相比之下,S100B主要位于细胞质功能蛋白内,GFAP是星形胶质细胞细胞骨架结构蛋白之一。这项研究中患者术后6个月时的生存质量还是令人满意的,仅有5名患者GOS评分为2分和3分。通过这一预后结果我们可以发现动脉瘤破裂出血时,神经元细胞和星形胶质细胞损伤并不严重,S100B蛋白和GFAP逐渐减少,而MDA在第14天却又再次升高,且具有明显的统计学意义。
有研究表明S100B蛋白水平在发病4天后与患者的预后具有相关性[7],GFAP的再次升高提示患者术后出现脑血管痉挛的风险极高[8]。Dugan等认为S100B蛋白和GFAP可来源于星形胶质细胞,二者升高常可预示患者即将迟发性缺血性神经功能障碍[9]。
除了动脉瘤破裂初期造成的脑组织损伤外,脑血管痉挛也是影响aSAH患者预后的重要因素,严重的脑血管痉挛往往致使患者预后极差。动脉瘤性蛛网膜下腔出血后所有的病人均会不同程度地出现脑血管痉挛。有学者经研究认为发生脑血管痉挛的高峰期为动脉瘤破裂后7—10天,一般持续两周左右[5]。在脑血管痉挛发生高峰期,有些痉挛较重的患者除严重头痛外,往往无任何症状。本研究发现脑血管痉挛逐渐缓解后MDA在第14天又在次升高,这可以用缺血再灌注产生了氧自由基来解释。国外有学者应用大鼠脑缺血模型也证明这一点:大鼠血清和脑中MDA浓度随大鼠缺血脑组织中超氧阴离子自由基的升高而增加[6]。当MDA的值为小于0.3 μ M时,提示aSAH患者恢复良好的可能性较大。从表3发现,预后较差组患者的MDA水平波动明显,因此,对比发病后不同时期的MDA对预测患者预后有重要意义。综上所述,本实验对S100B蛋白、GFAP和MDA 3种物质在预测aSAH患者预后生活质量的意义进行了研究。结果发现S100B蛋白、GFAP和MDA可作为预测标准,其中MDA更具有在临床实用价值。
[1]季 楠,赵继宗.动脉瘤性蛛网膜下腔出血后慢性脑积水易患因素分析[J].北京医学,2003,25(3):151.
[2]Vos PE,van Gils M,Beems T,et al.Increased GFAP and S100 beta but not NSE serum levels after subarachnoid haemorrhage are associated with clinical severity[J].European Journal of Neurology,2006,13(6):632.
[3]Oertel Matthias,Schumacher,Ute,McArthur David L,et al.S-100B and NSE:markers of initial impact of subarachnoid haemorrhage and their relation to vasospasm and outcome[J].Journal of Clinical Neuroscience,2006,13(8):834.
[4]Jennett B,BondM.Assessment of outcome after severe brain damage[J].Lancet,1975,1(7905):480.
[5]Sehba FA,Schwartz AY,Chereshnev I,et al.Acute decrease in cerebral nitric oxide levels after subarachnoid hemorrhage[J].Journal of Cerebral Blood Flow and Metabolism,2000,20(3):604.
[6]Aki Hiromi Shinagawa,Fujita Motoki,Yamashita Susumu,et al.Elevation of jugular venous superoxide anion radical is associatedwith early inflammation,oxidative stress,and endothelial injury in forebrain ischemiareperfusion rats[J].Brain Research,2009,1292:180.
[7]Hardemark H G,Almqvist O,Johansson T,et al.S-100 protein in cerebrospinal fluid after aneurysmal subarachnoid haemorrhage:relation to functional outcome,late CT and SPECT changes,and signs of higher cortical dysfunction[J].Acta Neurochirurgica,1989,99:135.
[8]Petzold Axel,KeirGeoffrey,Kerr Mary,et al.Early identification of secondary brain damage in subarachnoid hemorrhage:a role for glial fibrillary acidic protein[J].Journal of Neurotrauma,2006,23(7):1179.
[9]Dugan LL,Kim-Han JS.Astrocyte mitochondria in in vitro models of ischemia[J].Journal of Bioenergetics and Biomembranes,2004,36(4):317.

