蒙药巴特尔-7体外对胃癌细胞生长的影响
邓秀玲 刘淑萍 王栋
恶性肿瘤严重威胁着人们的生命,它的发生、发展与细胞异常增殖和分化有关,如何抑制肿瘤细胞的无限增殖能力,是肿瘤治疗的一个基本问题。本实验探讨蒙药巴特尔-7对胃癌细胞生长的影响,为抗肿瘤蒙药的进一步开发提供一些理论依据。
1 材料和方法
1.1 实验材料 培养基DMEM为Gibco公司产品,胎牛血清为中国医学科学院血液学研究所生产,噻唑蓝(MTT)和二甲基亚砜(DMSO)均为Sigama公司产品。蒙成药巴特尔-7(以下简称蒙药)、由内蒙古中蒙医院制剂室生产,用PBS配成50 mg/ml贮液,0.2 mm滤膜过滤除菌4℃保存,实验时用培养液稀释到所需浓度。
1.2 细胞培养 MGC-803细胞由北京肿瘤研究所提供,于含庆大霉素80U/ml、10%灭活胎牛血清的DMEM的培养液中培养,置37℃、5%CO2温箱中孵育,取对数生长期细胞用于实验。
1.3 蒙药对胃癌MGC-803的细胞杀伤作用:采用噻唑蓝比色法(MTT法),取对数生长期的MGC-803细胞,经消化液消化后制成单细胞悬液,调整细胞浓度为3×104个/ml接种96孔培养板,吹打均匀,每孔接种细胞悬液100 μl,置37℃、5%CO2温箱中孵育。24 h后实验组分别加入不同浓度的蒙药,终浓度分别为 2.5、1.25、0.63、0.31、0.15 mg/ml。另设阴性对照组(只有细胞,不加药),空白对照组(只含等量培养基,无细胞和药)。各处理组设8个复孔。以上各处理组总体积均为200 ul。加药后继续培养72 h,每孔加入20 ulMTT(5mg/ml)37℃温育4 h,离心弃上清后每孔加200 ulDMSO,振荡10 min。选择570 nm波长,酶标仪上检测各复孔吸光度(A值)。进行数据统计时,每组去除一个最大值和最小值,按下列公式计算细胞生长抑制率。
抑制率%=(对照组平均A值-实验组平均A值)/(对照组平均A值-空白组平均A值)×100%
1.4 细胞形态变化观察 ①倒置光显微镜观察:将MGC-803细胞以6×105个/ml接种于75 ml培养瓶中,培养24 h,更换培养液,对照组细胞用DMEM继续培养,实验组细胞加入含蒙药的培养基,培养后每6 h观察细胞形态变化。②荧光双染检测细胞核形态变化:收集蒙药处理24、36、48 h的细胞,离心、洗涤后制成细胞悬液,hochest33342和PI荧光染色、洗涤后滴片,于荧光显微镜(日本Nikon)下观察。
1.5 琼脂糖凝胶电泳检测 收集2.5 mg/ml不同时间处理组细胞1.8×106个,按文献1方法提取DNA。取DNA样品20 ul与上样缓冲液按6∶1混匀,上样于凝胶样品孔中,于0.5 TBE电泳缓冲液中进行电泳,55 V,2~3 h。
2 结果
2.1 蒙药对MGC-803细胞杀伤作用 从表1可见,巴特尔-7能显著抑制细胞的生长,与阴性对照组比较具有显著性差异(P<0.05)。且随着药物剂量增加,抑制率逐渐增高。计算半数抑制浓度(IC50)1mg/ml。
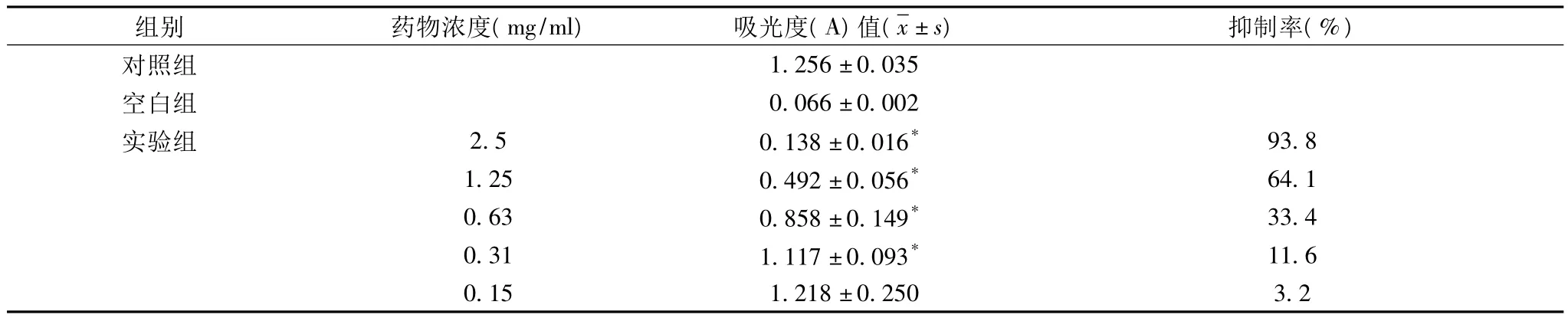
表1 蒙药对胃癌MGC-803细胞的生长影响
2.2 细胞形态学观察 倒置光镜下见,对照组细胞呈不规则多角形生长,细胞均质而透明,生长旺盛。低浓度巴特尔-7处理24 h后既有少数细胞开始变圆,细胞皱缩,细胞增殖速度减慢。2.5 mg/ml药物作用24 h后部分细胞已变圆,体积变小,细胞表面变得粗糙,出现“吐泡”现象,形似梅花状改变,呈现出凋亡细胞的形态改变。随着作用时间延长,细胞亮度明显下降,凋亡细胞数目逐渐增加。荧光双染后,可见对照组细胞核均匀一致,被Hoechst/33342染成蓝色荧光。2.5 mg/ml药物作用48 h细胞核染色质凝集、碎裂、凋亡小体形成。
2.3 DNA电泳检测 对照组在距点样孔附近有一条亮带,2.5 mg/ml娜仁处理细胞24 h电泳时隐约可见“梯状带”,36 h、48 h处理组未见梯状带的出现。
3 讨论
蒙医药是蒙古民族特有的医药,蒙医以经验医学为主,积累了许多经验方用于治疗各种肿瘤,并取得了一定的疗效[2,3,4]。本实验将巴特尔-7作用于体外培养的胃癌细胞,发现其可明显抑制胃癌细胞的生长,且呈现剂量依赖性的细胞毒作用。这与一些复方中药[5-7]体外抗肿瘤的细胞毒作用相似。在倒置光显微镜下观察,药物作用后部分细胞皱缩、体积变小,细胞出现“吐泡”现象,呈现凋亡细胞的形态学变化。为进一步证实倒置光显微镜下的观察结果,我们采用Hoechst3342/PI双重染色,来观察细胞核的变化,也显示了凋亡细胞的改变。提示该蒙药可能具有诱导细胞凋亡的作用。
自1980年Wyllie[8]把内源性核酸内切酶降解DNA产生的“梯形带”与细胞凋亡相联系,DNA的ladder带一直被认为是鉴定细胞凋亡的重要生化标志。本实验DNA电泳没有出现典型的凋亡“梯形带”,巴特尔-7作用24 h电泳隐约可见“梯形带”。其他时间组未见“梯形带”,但也没有坏死细胞DNA涂抹状的拖带现象。提示巴特尔-7作用方式较温和,可能在早些时候DNA被降解成大的片段。有学者认为大片段的形成可能发生在细胞凋亡早期,寡核甘酸片段则出现于凋亡晚期,但有些研究则认为,在凋亡晚期不一定出现小片段。赵小英等[9]在研究紫杉醇对K562细胞的凋亡诱导作用中也观察到此现象的发生。谭宇蕙等[10]报道小糵碱对人胃癌MGC-803细胞生长抑制及诱导凋亡的作用实验中也出现本结果。本实验结果表明巴特尔-7可抑制体外培养的胃癌细胞的生长,这种抑制作用是通过诱导细胞凋亡还是通过其他机制实现的尚需进一步研究。
[1]奥斯伯.布伦特.精编分子生物学实验指南.科学出版社,1998:32-35.
[2]武超,马东野.蒙药乌门-17味散治疗晚期食管贲门癌234例临床观察.中国民族医药杂志,2001,4(7):12-13.
[3]陈露华,赵宇明.蒙医药治疗原发性肝癌的机理探讨.中国民族民间医药杂志,2000,42:15-18.
[4]李兰英,田国才.那如注射液激活腹腔巨噬细胞的体内抗L615白血病的作用.内蒙古医学院学报,1995,17(1):34-37.
[5]王洪峰,宋颖,史祺云,等.吴茱萸碱对人胃低分化黏液腺癌MGC-803细胞作用的研究.长春中医药大学学报,2010,(02):185-186.
[6]白英,李华.白英水提物诱导人SGC-7901细胞凋亡的实验研究. 时珍国医药,2009,20(10):2509-2511.
[7]杨策尧,杨丽红.复方象胆水煎剂的体外抗肿瘤试验研究.海南医学,2003,14(7):72-73.
[8]Wyllie AH,Cell death:the significance apoptosis.Natrure,1980,284:555.
[9]赵小英,徐磊,张晓红,等.紫杉醇对K562细胞增殖抑制作用及诱导凋亡的作用.实用肿瘤学杂志,2002,17(6):376-378.
[10]谭宇蕙,陈冠林,郭淑杰,等.小糵碱对人胃癌MGC-803细胞生长抑制及诱导凋亡的作用.中国药理学通报,2001.12(1):40-43.

