转炉钒渣氧压酸浸过程V-Fe-H2O系的电位—pH图
张廷安, 牟望重, 豆志河, 吕国志, 刘 燕
(东北大学 材料与冶金学院 多金属共生矿生态化利用教育部重点实验室,沈阳 110819)
钒是一种具有战略价值的金属元素,因具有较高的强度、硬度、较优的耐腐蚀性能而被广泛地应用于各类合金中。世界上已经探明的钒资源储量中有98%共生于钒钛磁铁矿中。我国是钒资源大国,储量居世界第4位,仅次于南非、俄罗斯、美国。其中,四川攀枝花地区的钒钛磁铁矿储量近100亿t,占世界储量的11%。钒钛磁铁矿在冶炼过程中含钒铁水吹炼产生的转炉渣中钒含量为3%~15%,是目前世界上提钒的主要原料[1−2]。
目前,从含钒原料中提钒的方法主要有钠盐焙烧−酸 浸[3]/水浸[4]法、空白焙烧−碱浸[5]/酸浸[6]法、钙盐焙烧−酸浸[7]/碱浸[8]法及氧化焙烧−酸浸法[9]等。其中,钠盐焙烧效果较好,对原料的适应性较强,近年来得到了广泛的应用。该工艺的主要问题在于焙烧烟气中含有Cl2及HCl等有害气体,严重污染大气环境;同时,钒的回收率有待进一步提高[10]。与传统工艺相比,氧压酸浸技术取消了焙烧工艺段,缩短了工艺流程,减少了物料用量,避免了焙烧过程中有害气体的排放,提高了钒的综合利用率,是一种低碳环保型绿色冶金新工艺。
电位—pH图是研究湿法冶金过程重要的热力学依据。目前,对于 V−H2O体系的研究仅限于常温、常压条件(25 ℃、0.1 MPa)[11];虽有学者在150 ℃下对Fe−H2O体系进行了研究,但其研究对象为硫化矿的FeS−H2O体系[12−14];而目前对于转炉钒渣氧压酸浸过程V-Fe-H2O系电位—pH图的研究未见报道。为此,本文作者绘制了氧分压为 0.5 MPa及不同温度(60、100、150、200℃)下V-H2O 系、Fe-H2O 系、V-Fe-H2O系的电位—pH图,为转炉钒渣的氧压酸浸过程提供了热力学依据,并以此为基础进行了氧压酸浸实验,对理论计算结果进行了验证。
1 热力学计算
1.1 高温电位—pH图的计算方法
湿法冶金过程中物质在水溶液中发生的基本反应可用式(1)表示。

式中:Ab和 Ba分别为氧压酸浸过程中特定种类的钒和铁化合物。
根据反应有无电子参加,高温条件下氧化还原反应体系的φT及溶解−沉淀反应体系(无电子参加,z=0)的pHT的计算公式如式(2)和(3)所示[15]。
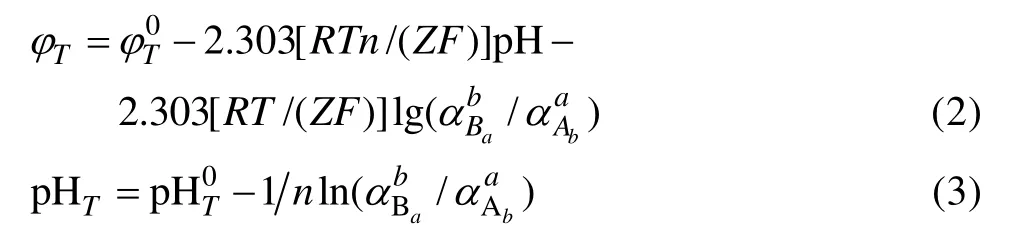


式中:αT和βT为给定温度下的常数,只与选择的标准态、溶剂、温度以及离子类型有关,而与个别离子性质无关。表1所列为60~200 ℃下4种离子类型的αT和 βT[16]。
电解质的平均活度因子随温度而变,根据文献[17]报道,采用Debye–Hückel方程式计算温度高于25 ℃水溶液中各离子的平均活度因子。
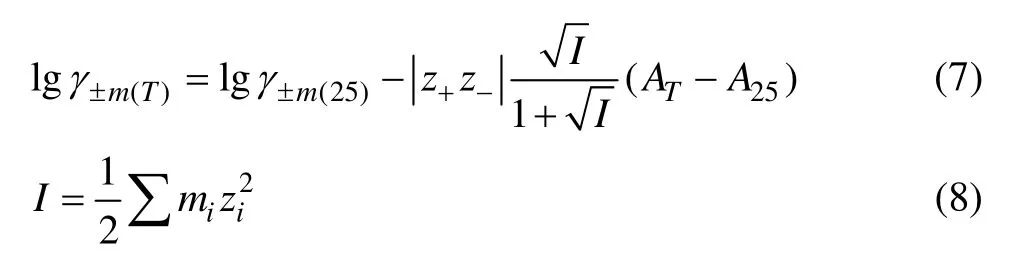
式中:γ±为溶液中电解质的平均活度因子(以摩尔浓度计算);I为水溶液的离子强度;z+为正离子的电荷数;z-为负离子的电荷数;AT为常数,其值随温度的变化而变化,如表2所列。
本文作者采用戴维斯公式计算 25 ℃水溶液中电解质的活度因子:

据文献[10]报道,式(9)的平均误差约为1.6%,是目前较为精确的计算方法。
1.2 高温下V-H2O系的电位—pH图
根据文献[11−12,18−19]中的热力学数据,采用式(4)和(5)的计算方法,分别得到了温度为 25、60、100、150和200 ℃,氧分压为0.5 MPa,V-H2O系中各反应的φ0值及pH0值,结果如表3和4所列。根据式(7)和(9)的活度因子计算方法,代入表2中的AT值,得到不同温度下V-H2O系各物质的活度因子,如表5所列。 取V-H2O系中各离子的质量浓度为0.1 mol/kg,得到各物质在不同温度下的活度。
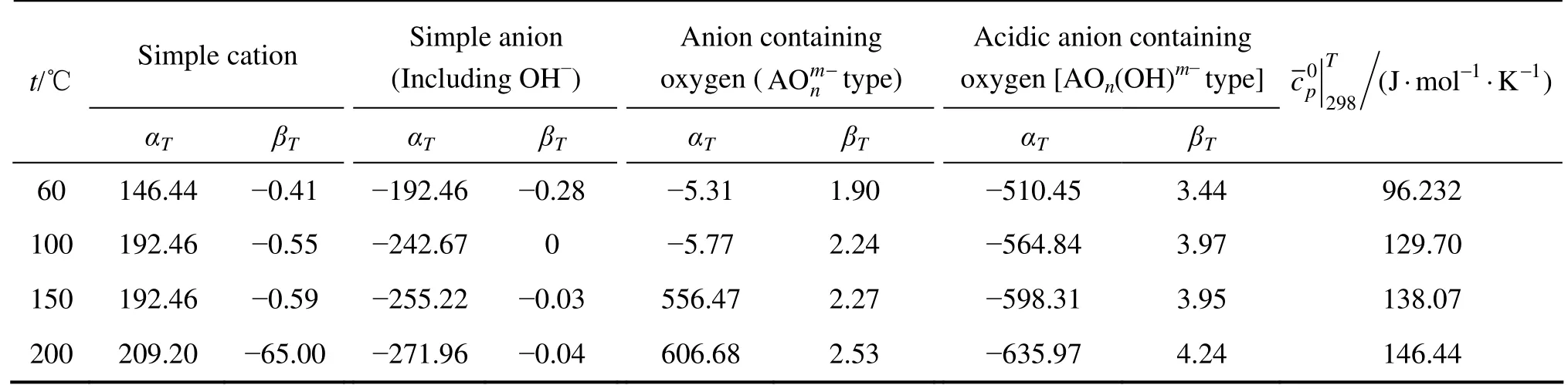
表1 60~200 ℃时4种离子类型的αT和βT值[16]Table 1 Values of αT and βT for calculating four kinds of ions at 60~200 ℃[16]

表2 不同温度下的AT值Table 2 AT values at different temperatures from 25 ℃ to 300 ℃
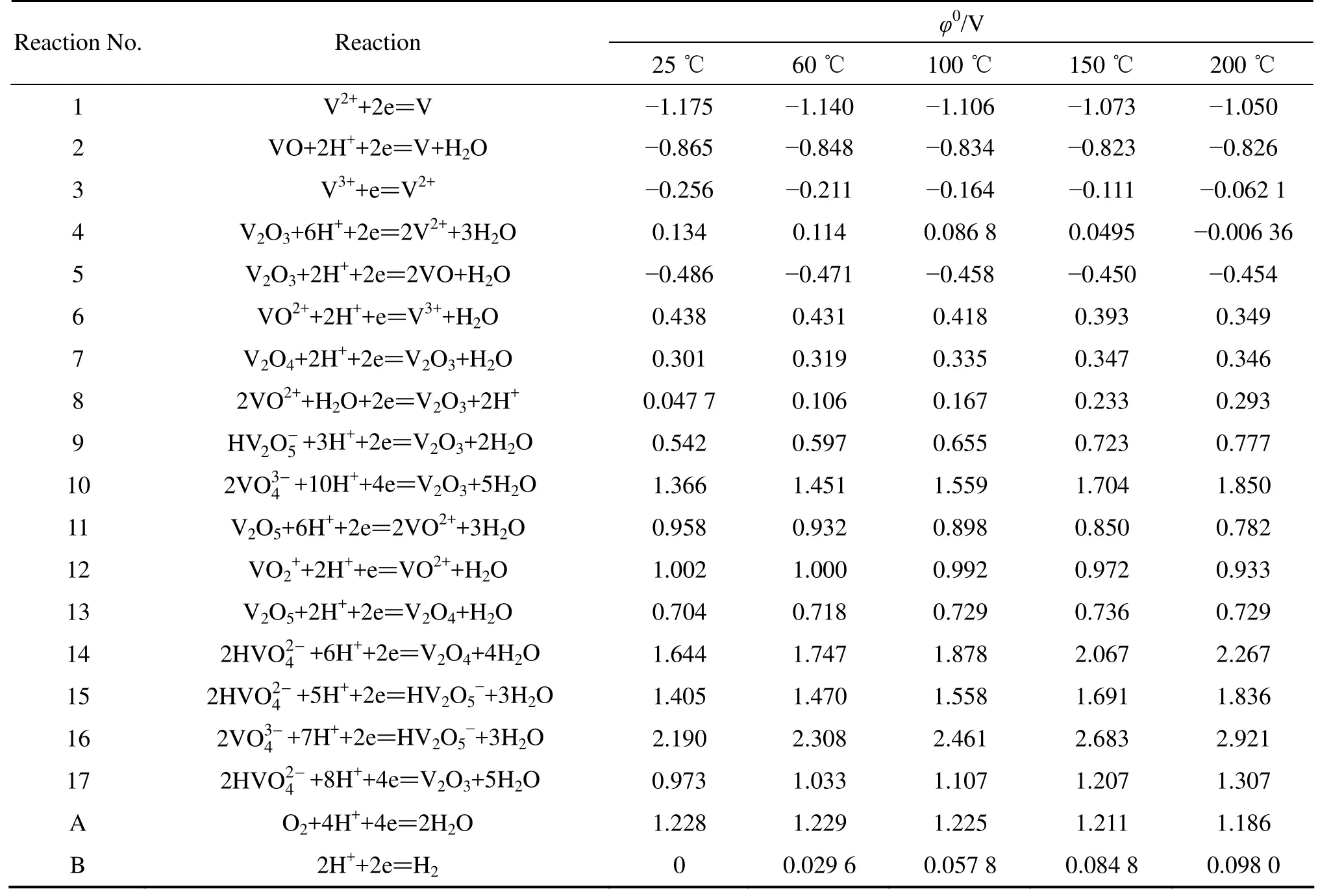
表3 V-H2O系各反应在不同温度下的φ0值Table 3 φ0 values of various reactions in V-H2O system at different temperatures

表4 V-H2O系各反应在不同温度下的pH0值Table 4 pH0 values of various reactions in V-H2O system at different temperatures
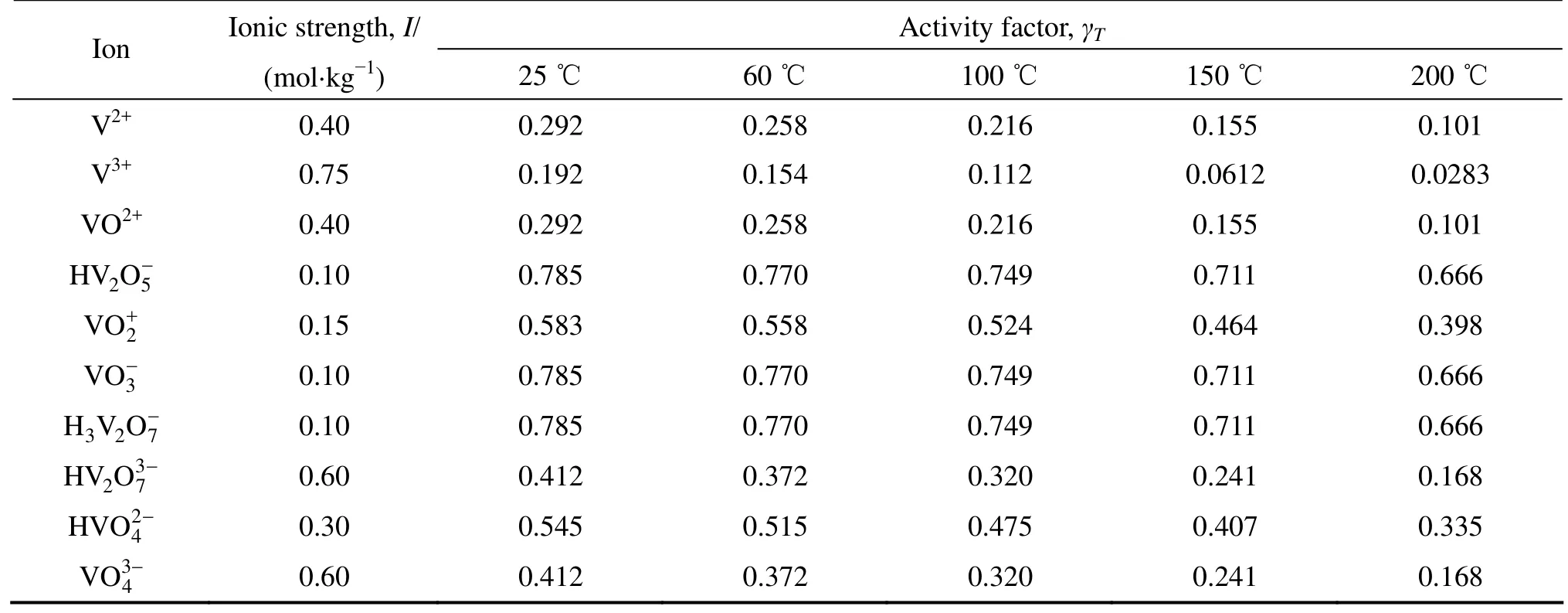
表5 V-H2O系各物质在不同温度下的活度因子Table 5 Activity factors for substances in V−H2O system at different temperatures
根据V-H2O系中各反应的不同类型,分别采用式(2)和(3)计算各反应的φ或pH表达式并绘图,即可得到氧分压为0.5 MPa、温度分别为60、100、150和200℃ V-H2O系的φ—pH图(见图1)。
由图1可知,在水的稳定区范围内,钒主要以固体氧化物的形式存在,但在pH<2的酸性条件下,有V3+、VO2+和VO2+3种水溶性离子存在;在pH>8的碱性条件下,有 H VO、H V2O和VO等离子存在,这些稳定区的存在从热力学角度验证了采用酸浸或碱浸工艺从转炉钒渣中提钒的可行性。
针对转炉钒渣的氧压酸浸工艺进行热力学研究,主要考察在pH<2的酸性条件下可溶性钒离子稳定区的变化情况。由表3可知,随着温度由60 ℃升高到200 ℃, 构成 V3+稳定区的反应(3)对应的 φ0值由−0.211 V提高到−0.062 1 V;构成V3+、VO2+和VO2+稳定区的反应(19)、(20)和(22)对应的 pH0值分别由1.640、1.615和−1.030降低至0.198、0.283和 −1.606。由此可知,随着反应温度的升高,钒的浸出反应在酸性条件下所需要达到的标准氧化还原电位逐渐升高,所需酸浓度逐渐增大,从热力学角度对钒的浸出是不利的。但由于φ0及pH0值变化不大,并不影响渣中钒在酸性条件下能够被充分浸出的热力学结果;同时,对于在密闭体系下进行的氧压浸出反应,为了强化浸出过程,必须提高浸出温度来加快反应速度并活化反应的动力学因素。因此,实际浸出过程选择的温度不宜过低[20]。
1.3 高温下Fe-H2O系的电位—pH图
不同温度下 Fe-H2O系 φ—pH图的绘制方法与V-H2O 的一致,根据文献[11−12,18−19]中的热力学数据,得到Fe-H2O系各反应在不同温度条件下的φ0及pH0,结果分别如表6和7所列,各物质的活度因子如表8所列。取Fe-H2O水溶液中各离子浓度为0.1 mol/kg,经过计算得到氧分压为0.5 MPa,温度分别为60、100、150和200 ℃时Fe-H2O系的φ—pH图(见图2)。
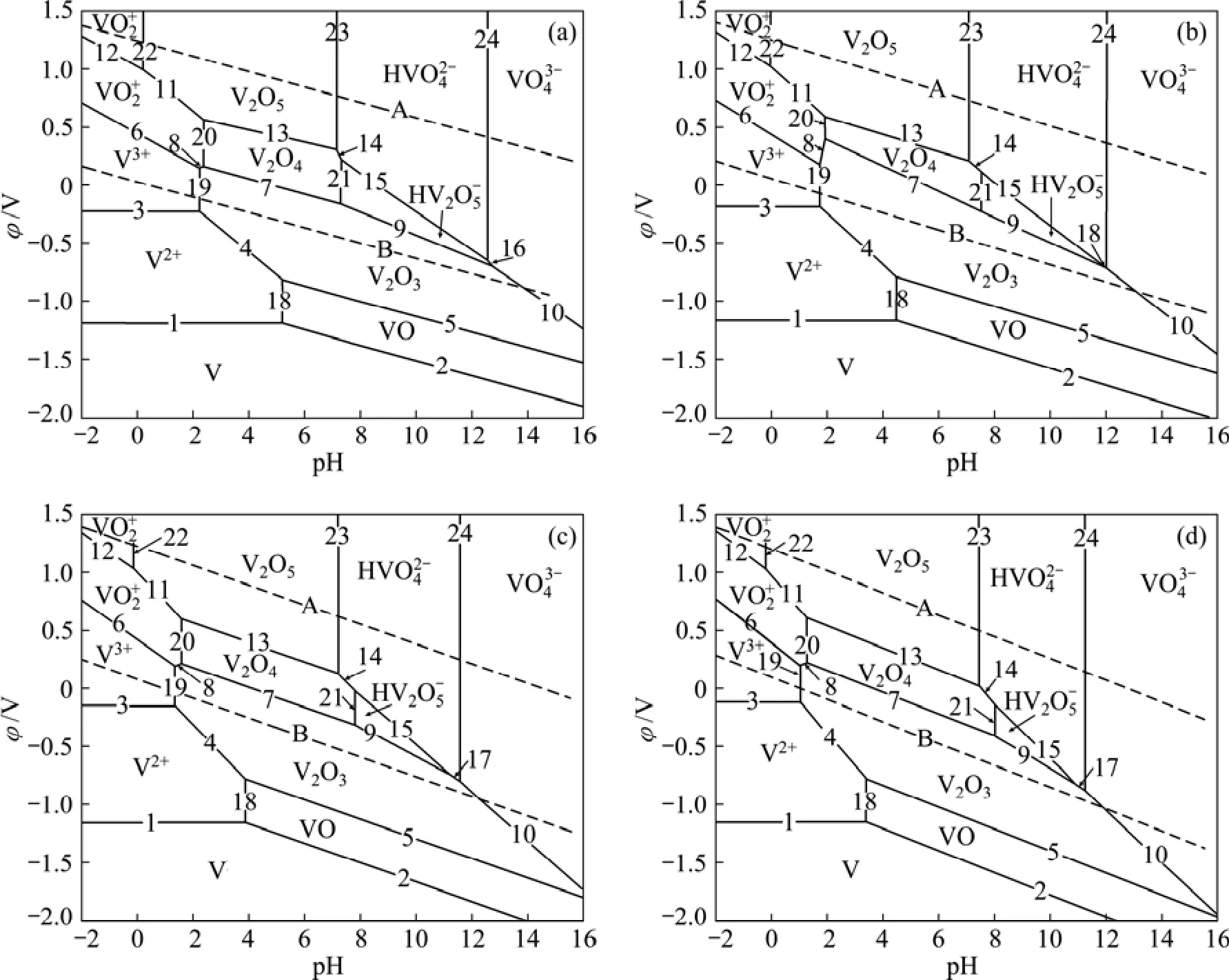
图1 不同温度下氧分压为0.5 MPa时V-H2O系的φ—pH图Fig.1 φ—pH diagrams of V-H2O system at oxygen partial pressure of 0.5 MPa and different temperatures: (a)60 ℃; (b)100 ℃;(c)150 ℃; (d)200 ℃
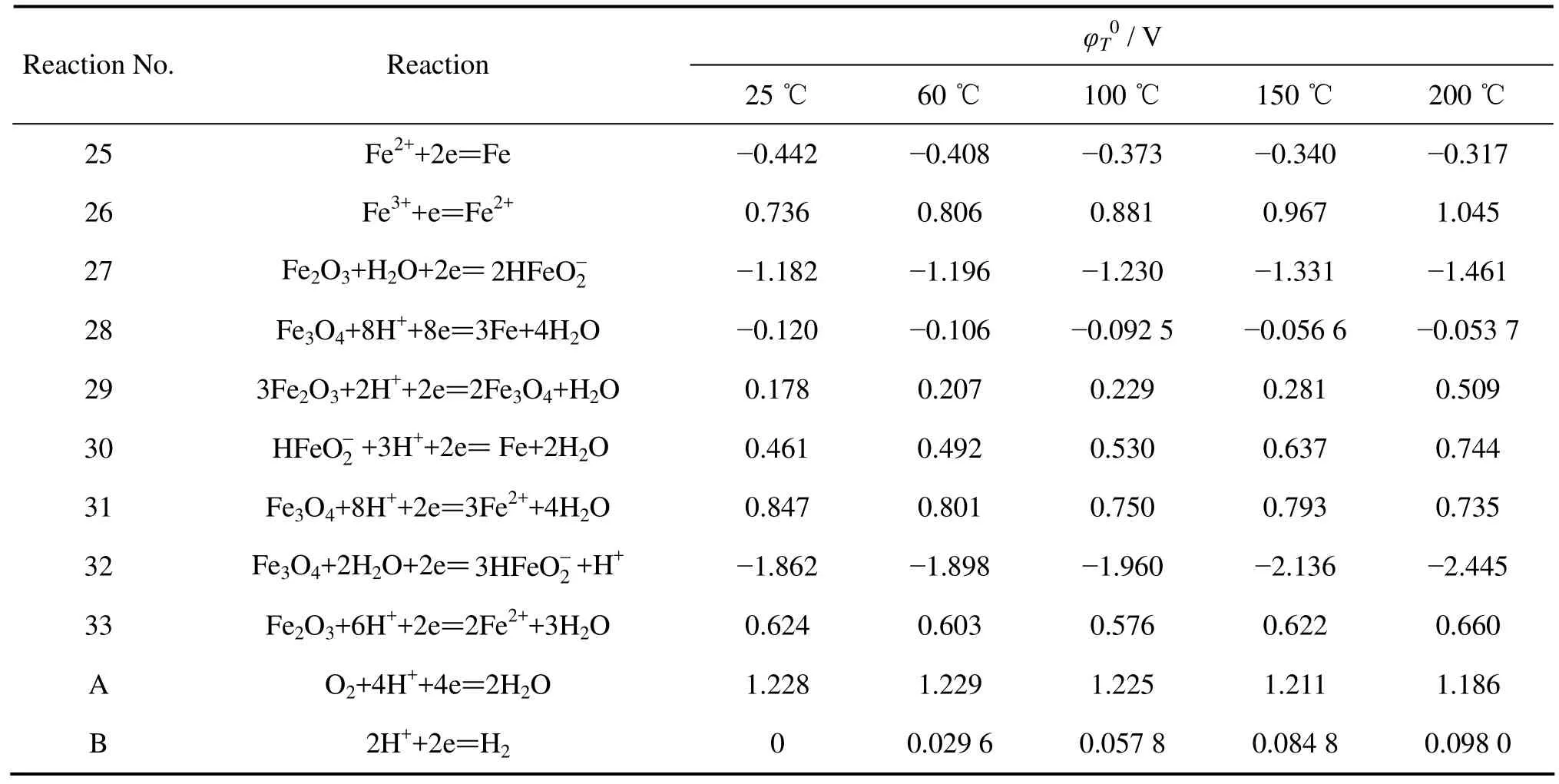
表6 Fe-H2O系各反应在不同温度下的φ0值Table 6 φ0 values of various reactions in Fe-H2O system at different temperatures
由图2可知,在水的稳定区范围内,铁除一部分以 Fe2O3及 Fe3O4等固体氧化物的形式存在外,其余均呈可溶性离子状态。在pH<2的酸性条件下,以Fe2+和 Fe3+的形态存在;在 pH>14的碱性条件下,以HFeO2−的形式存在。当氧化还原电位较低时,出现铁的钝化区。由此可知,在氧压酸浸条件下,钒渣中的铁以Fe2+及Fe3+的形态存在于浸出液中。由于钒渣是由含钒铁水在转炉中通过氧气吹炼而形成,氧化条件充分,因此,渣中主要以铁的氧化物形式存在,而浸出液中一部分Fe3+的存在提高了浸出体系的氧化还原电位。

表7 Fe-H2O系各反应在不同温度下的pH0值Table 7 pH0 values of various reactions in Fe-H2O system at different temperatures

表8 Fe-H2O系各物质在不同温度下的活度因子Table 8 Activity factors for substances of Fe-H2O system at different temperatures
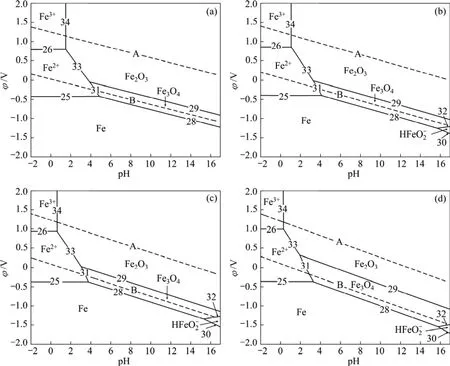
图2 高温下氧分压为0.5 MPa时Fe-H2O系的φ—pH图Fig.2 φ—pH diagrams of Fe-H2O system at high temperatures and oxygen partial pressure of 0.5 MPa: (a)60; (b)100 ℃; (c)150℃; (d)200 ℃
由表6和7可知,随着温度由60 ℃提高到200 ℃,构成Fe3+稳定区的φ0值由0.806 V提高到1.045 V,pH0值由1.525降低到0.370;Fe2+的φ0值由−0.408 V提高到−0.317 V。可见,随着温度的提高,Fe2+和Fe3+的浸出需要浸出体系具有更高的氧化还原电位以及更高的酸浓度。从热力学角度考虑,温度的提高抑制了低温、低酸条件下铁的浸出,根据从转炉渣中提钒时应尽可能减少进入浸出液杂质的原则,提高温度是有利的;但从动力学角度考虑,提高温度将加快反应的浸出速率,促进铁氧化物的溶解,反而不利于除杂过程。因此,需要进行转炉渣的氧压酸浸实验,以确定合适的浸出温度。
1.4 高温下V-Fe-H2O系的φ—pH图
转炉钒渣通过铁水吹炼产生,钒和铁主要以尖晶石的形式共存于渣中。根据图1和2及文献[11−12,18−19]中的热力学数据,得到V-Fe-H2O系各反应在不同温度下的φ0及pH0值,结果分别如表9和10所列。根据表5和8中各物质的活度因子,取V-Fe-H2O系水溶液中各离子浓度为 0.1 mol/kg,经过计算得到氧分压为0.5 MPa,温度分别为 60、100、150和200 ℃时V-Fe-H2O系的φ—pH图(见图3)。
由图3可知,钒铁尖晶石(FeO·V2O3)的稳定区几乎全部包含在水的稳定区范围内,且不随温度变化而改变。在氧压酸浸工艺的酸性条件下,可溶性 V3+、VO2+和VO2+的稳定区全部包含在Fe3+和Fe2+的稳定区范围内,表明转炉钒渣的氧压酸浸工艺在浸出可溶性钒离子的同时,伴随着Fe3+和Fe2+的浸出。从热力学的分析可知,试图通过改变温度及酸浓度等因素控制氧化还原电位,在保证钒充分浸出的同时铁不浸出而使铁与钒分离是不可行的,浸出液还需要进行净化除杂以生产高纯度的钒制品。
由图1~3可知,随着温度的提高,可溶性钒、铁离子的稳定区对应的氧化还原电位逐渐增大,pH值逐渐降低。热力学分析表明,提高温度对于有价元素钒以及杂质铁的浸出都是不利的;同时综合考虑温度对反应速率等动力学因素的影响,还需要进行氧压酸浸实验来验证热力学计算结果的准确性。

表9 V-Fe-H2O系各反应在不同温度下的φ0值Table 9 φ0 values of various reactions in V-Fe-H2O system at different temperatures

表10 V-Fe-H2O系各反应在不同温度下的pH0值Table 10 pH0 values of various reactions in V-Fe-H2O system at different temperatures

图3 不同温度下氧分压为0.5 MPa时V-Fe-H2O系的φ—pH图Fig.3 φ—pH diagrams of V-Fe-H2O system at oxygen partial pressure of 0.5 MPa and different temperatures: (a)60 ℃; (b)100 ℃;(c)150 ℃; (d)200 ℃
2 实验
2.1 原料
实验用转炉钒渣取自四川攀枝花地区,其主要化学成分见表11。钒渣的XRD谱如图4所示。实验用浸出剂由98%的化学纯浓硫酸稀释至一定浓度范围,气体为工业瓶装纯氧。
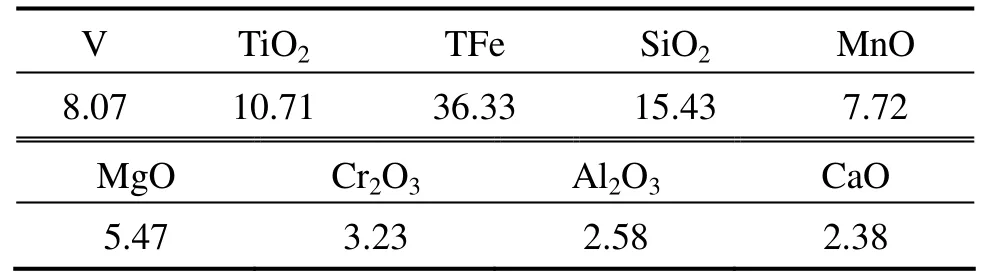
表11 转炉渣的化学成分Table 11 Chemical composition of converter slags (mass fraction, %)
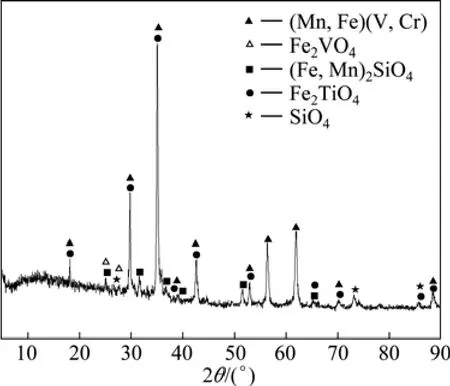
图4 转炉渣的XRD谱Fig.4 XRD pattern of converter slags
由图4及表11可知,转炉钒渣中主要成分为含铬、锰的钒铁尖晶石相,还包括铁橄榄石相、钛铁尖晶石相和石英相等,成分复杂。
2.2 实验仪器及方法
实验装置主要包括KCFD2−10型永磁旋转搅拌加压反应釜、Pulverisette5行星式高能球磨机、2XZ−1型旋片式真空泵及ZK−82B型真空干燥箱。
将转炉渣与一定浓度的硫酸溶液按所设定的液固比调浆后置入加压反应釜内,检查气密性后开始通氧、搅拌、加热。浸出结束后,采用真空抽滤泵对浸出矿浆进行液固分离,量取滤液体积并称取滤渣质量。取样分析,钒、铁浸出率通过浸出液及浸出渣的计算方法如下:

式中:ηi为钒、铁的浸出率(i=V, Fe),%;m0为原矿加入质量,g;wi为原矿中钒、铁的质量分数,%;ci为浸出液中钒、铁离子的浓度,g/L;V为浸出液体积,L;w′i为浸出渣中钒、铁的质量分数,%;m为浸出渣质量,g。
2.3 检测方法
使用美国Leeman公司制造的Prodigy XP型全谱直读等离子光谱仪(ICP)对浸出液中的钒、铁离子浓度进行检测;使用日本理学3070e型X荧光光谱仪对浸出渣中钒、铁元素含量进行表征。
3 结果与讨论
在氧分压0.5 MPa、粒度范围0.055~0.075 mm、液固比15:1、浸出时间120 min、搅拌速度500 r/min、初酸浓度200 g/L的条件下,温度对转炉钒渣浸出率的影响如图5所示。由图5可知,随着温度由60 ℃升高到140 ℃,钒的浸出率由65.48%提高到96.87%;当温度继续升高到180 ℃时,钒的浸出率为97.07%,趋于稳定。铁的浸出率在60 ℃为77.32%,在120 ℃增加到88.33%;随着温度继续提高到180 ℃,铁的浸出率略有提高,增加到91.56%。
由不同温度下钒、铁浸出率的变化趋势可知,转炉钒渣的氧压酸浸过程主要由反应动力学因素控制,提高温度能强化反应动力学过程,提高反应速率,缩短固液反应时间[20],进而增大钒、铁的浸出率。由图4可知,转炉渣中存在着铁橄榄石等难溶相,是造成铁浸出率略低于钒浸出率的主要原因。氧压酸浸的目的在于提钒的同时,使其他元素尽可能少的进入浸出液。实验结果表明,在钒充分浸出的同时,铁的浸出率也在90%左右。温度继续升高至140 ℃以上,钒的浸出率趋于稳定而铁的浸出率略有提高。因此,浸出温度不宜超过140 ℃,实验结果与φ—pH图计算结果相符合。
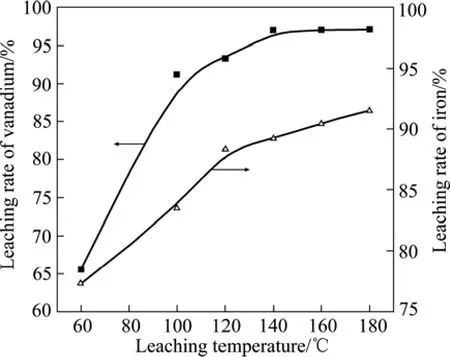
图5 浸出温度对钒、铁浸出率的影响Fig.5 Effect of leaching temperature on leaching rate of vanadium and iron
4 结论
1) 由不同温度下V-H2O系的φ—pH图可知,在水的稳定区范围内,在pH<2的酸性条件下,钒主要以V3+、VO2+和 V O3种水溶性离子形态存在,为转炉渣采用氧压酸浸工艺提取钒提供了热力学条件。
2) 由不同温度下Fe−H2O系的φ—pH图可知,在水的稳定区范围内,在pH<2的酸性条件下,铁主要以Fe2+和Fe3+形态存在。热力学分析表明,随着氧压酸浸工艺的进行,转炉渣中的铁氧化物将以可溶性铁离子形式进入浸出液。
3) 由不同温度下V-Fe-H2O系的φ—pH图可知,在pH<2的酸性条件下,V3+、VO2+和 V O的稳定区一直位于Fe3+和Fe2+的稳定区范围内。随着温度由60℃提高到200 ℃,可溶性钒、铁离子稳定共存区的pH值逐渐降低,氧化还原电位逐渐提高。热力学分析表明,采用氧压酸浸工艺能将转炉渣中的钒充分浸出,但不能通过一步浸出在提钒的同时将钒、铁分离,生产钒制品时浸出液需要进行进一步净化。
4) 由不同温度下转炉钒渣的氧压酸浸实验结果可知,在温度 140 ℃、氧分压 0.5 MPa、粒度0.055~0.075 mm、液固比15:1、浸出时间120 min、搅拌速度500 r/min、初酸浓度200 g/L的条件下,钒的浸出率为 96.87%,铁的浸出率为 89.25%,实验结果与热力学计算结果相符合。
[1]MOSKALYK R R, ALFANTAZI A M. Processing of vanadium:A review[J]. Minerals Engineering, 2003, 16: 793−805.
[2]NAVARRO R, GUZMAN J, SAUCEDO I, REVILLA J,GUIBAL E. Vanadium recovery from oil fly ash by leaching precipitation and solvent extraction processes[J]. Waste Management, 2006, 27: 425−438.
[3]SHELWIT H, ALIBRAHIM M. Extraction of sulfur and vanadium from petroleum coke by means of salt-roasting treatment[J]. Fuel, 2006, 85(6): 878−880.
[4]范必威, 林海玲. 方山口石煤提钒焙烧工艺研究[J]. 湿法冶金, 2001, 20(2): 79−83.FAN Bi-wei, LIN Hai-ling. Effects of roasting process on extraction of vanadium from stone coal at Fangshankou[J].Hydrometallurgy of China, 2001, 20(2): 79−83.
[5]谭爱华. 某石煤钒矿空白焙烧−碱浸提钒工艺研究[J]. 湖南有色金属, 2008, 24(1): 24−27.TAN Ai-hua. Study on extracting V2O5by the roasting-alkaline leaching from vanadium-containing stone coal[J]. Hunan Nonferrous Metals, 2008, 24(1): 24−27.
[6]宾智勇. 钒矿石无盐焙烧提取五氧化二钒试验[J]. 钢铁钒钛,2006, 27(1): 21−26.BIN Zhi-yong. Study on extraction of V2O5from vanadium ore by roasting and acid leaching process[J]. Iron Steel Vanadium Titanium, 2006, 27(1): 21−26.
[7]邹晓勇, 彭清静, 欧阳玉祝, 田仁国. 高硅低钙钒矿的钙化焙烧过程[J]. 过程工程学报, 2001, 1(2): 189−192.ZOU Xiao-yong, PENG Qing-jing, OUYANG Yu-zhu, TIAN Ren-guo. Research on the roasting process with calcium compounds for silica based vanadium ore [J]. The Chinese Journal of Process Engineering, 2001, 1(2): 189−192.
[8]王金超. 钙对钒渣提钒的影响[J]. 四川有色金属, 2004(4):27−29.WANG Jin-chao. Effect of calcium on leaching of vanadium from vanadium slag[J]. Sichuan Nonferrous Metals, 2004(4):27−29.
[9]冯其明, 何东升, 张国范, 欧乐明, 卢毅屏. 石煤提钒过程中钒氧化和转化对钒浸出的影响[J]. 中国有色金属学报, 2007,17(8): 1348−1352.FENG Qi-ming, HE Dong-sheng, ZHANG Guo-fan, OU Le-ming, LU Yi-ping. Effect of vanadium oxidation and conversion on vanadium leaching in extraction of vanadium from stone coal[J]. The Chinese Journal of Nonferrous Metals,2007, 17(8): 1348−1352.
[10]LI Min-ting, WEI Chang, FAN Gang, LI Cun-xiong, DENG Zhi-gan, LI Xing-bin. Pressure acid leaching of black shale for extraction of vanadium[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(S1): 112−117.
[11]POST K, ROBINS R G. Thermodynamic diagrams for the vanadium-water system at 298.15 K[J]. Electrochimica Acta,1976, 21(6): 401−405.
[12]BRUCE G P, GRAHAM A W, ROY M S. Electrochemical phase diagrams for the Fe/S/H2O system under geothermal conditions[J]. Journal of Chemistry, 1985, 38(8): 643−657.
[13]王吉坤, 李存兄, 李 勇, 张红耀, 黄 卉, 阎江峰, 刘 露, 魏昶. 高铁闪锌矿高压酸浸过程中ZnS-FeS-H2O系的电位—pH图[J]. 有色金属: 冶炼部分, 2006(2): 2−5.WANG Ji-kun, LI Cun-xiong, LI Yong, ZHANG Hong-yao,HUANG Hui, YAN Jiang-feng, LIU Lu, WEI Chang. The E—pH diagram of ZnS-FeS-H2O system during acid leaching under high pressure of iron sphalerite[J]. Nonferrous Metals: Extractive Metallurgy, 2006(2): 2−5.
[14]牟望重, 张廷安, 吕国志, 古 岩, 豆志河. 硫化锌加压浸出过程的电位—pH图[J]. 中国有色金属学报, 2010, 20(8):1636−1644.MU Wang-zhong, ZHANG Ting-an, LÜ Guo-zhi, GU Yan,DOU Zhi-he. φ—pH figure during oxidative pressure leaching of zinc sulfide[J]. The Chinese Journal of Nonferrous Metals, 2010,20(8): 1636−1644.
[15]钟竹前, 梅光贵. 湿法冶金过程[M]. 长沙: 中南工业大学出版社, 1988: 1−10.ZHONG Zhu-qian, MEI Guang-gui. Hydrometallurgy process[M]. Changsha: Central South University of Technology Press, 1988: 1−10.
[16]田彦文, 翟秀静, 刘奎仁. 冶金物理化学简明教程[M]. 北京:化学工业出版社, 2007: 225−227.TIAN Yan-wen, ZHAI Xiu-jing, LIU Kui-ren. Short course of metallurgical physical chemistry[M]. Beijing: Chemical Industry Press, 2007: 225−227.
[17]黄子卿. 电解质溶液理论导论[M]. 北京: 科学出版社, 1983:83−87.HUANG Zi-qing. Introduction of electrolyte solutions theory[M].Beijing: Science Press, 1983: 83−87.
[18]杨显万. 高温水溶液热力学数据计算手册[M]. 北京: 冶金工业出版社, 1983: 523−674.YANG Xian-wan. Handbook of thermodynamic data in aqueous solutions at high temperature[M]. Beijing: Metallurgical Industry Press, 1983: 523−674.
[19]伊赫桑·巴伦. 纯物质热化学数据手册[M]. 程乃良, 牛四通,徐桂英, 译. 北京: 科学出版社, 2003: 716−726.BARIN I. Thermochemical data of pure substances[M]. CHENG Nai-liang, NIU Si-tong, XU Gui-ying, transl. Beijing: Science Press, 2003: 716−726.
[20]马荣骏. 湿法冶金原理[M]. 北京: 冶金工业出版社, 2007:324.MA Rong-jun. Principle on hydrometallurgy[M]. Beijing:Metallurgical Industry Press, 2007: 324.

