猪流行性腹泻病毒N基因的克隆及原核表达
杨 巍,李广兴,孟凡丹,王 鑫,任晓峰
(东北农业大学动物医学学院,哈尔滨 150030)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒 (Porcine epidemic diarrhea virus,PEDV)引起的一种接触性肠道传染病[1]。常以腹泻、呕吐、脱水和对哺乳仔猪的高致死率为主要特征。PEDV属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)[2]。其基因组是单股正链的并且具有感染性的RNA,全长为28 033 nt,在基因组的5′端有一个帽子结构(Cap),3′端有一个Poly(A)尾。PEDV的结构蛋白与其他冠状病毒相似,该病毒有糖基化纤突蛋白(Spike)、糖基化囊膜蛋白(Membrane)和与RNA结合的未糖基化核衣壳蛋白(N蛋白)三种[3]。其中N蛋白是由441个氨基酸组成的,分子质量为55~58 ku之间的磷酸化的核衣壳蛋白。N蛋白在PEDV的结构蛋白中所占的比例最大,在感染的细胞中能够得到大量的表达。在感染PEDV的早期,动物体内就能够产生抗N蛋白的较高水平的抗体,而且N蛋白的保守性很高,所以利用PEDV的N蛋白为基础来建立PEDV的分子生物学诊断技术具有很好的应用前景[4]。
1 材料与方法
1.1 材料
1.1.1 病毒
猪流行性腹泻病毒(PEDV)在黑龙江省某猪场分离。
1.1.2 细胞
Vero细胞由本实验室保存。
1.1.3 主要试剂和工具菌
M-MLV逆转录酶、dNTP Miture、TaqDNA聚合酶、RNA酶抑制剂购自Sigma公司;DNA回收试剂盒购自南京凯基公司。PET-30a、感受态菌TG1、BL21等由本实验室保存。
1.2 方法
1.2.1 猪流行性腹泻病毒(PEDV)的分离与鉴定
1.2.1.1 PEDV的分离
由黑龙江某猪厂采取的患病猪粪便样品用PBS按10倍稀释,研碎充分混匀。将研碎的内溶物混合液离心(10 000 r·min-1,15 min,4 ℃)去除较大的沉淀物,然后取上清液二次离心 (10 000 r·min-1,15 min,4℃)彻底去除沉淀物。将上清液用无菌滤膜除菌分储存于-70℃冰箱备用。
1.2.1.2 猪流行性腹泻病毒(PEDV)RNA的提取
取上清液3 mL,用PEG法浓缩病毒,即加入等体积预冷的20%的PEG8000(1 mol·L-1NaOH溶解),反复颠倒数次,室温放置30 min(或4℃过夜)。室温12 000 r·min-1离心5 min,弃去上清。加入100 μL灭菌水(DEPC水)重悬病毒粒子。参照试剂盒说明书用试剂盒提取RNA。然后进行反转录,合成病毒cDNA[5-6]。
反转录体系(10 μL体系)如下:d H2O 2.75 μL;MgCl2(25 mmol·L-1)2 μL;5 × MLV Buffer 2 μL;dNTP 1 μL;RNase Inhibitor(40 U·μL-1)0.25 μL;M-MLV 0.5 μL;样品 RNA 1 μL;特异性下游引物P2 0.5 μL。
反应条件为:42℃30 min,99℃5 min,5℃5 min,然后将产物-20℃保存备用。
1.2.1.3 基因片段的PCR扩增
根据登录号为DQ355224基因序列设计一对引物进行PCR扩增。
上游(P1):5′TGCTTCATTTAGTCTAAACAGAAA 3′
下游(P2):5′CGGTCTAACATTGTTTAATTTCC 3′
RT-PCR 体系(25 μL)如下:10×Ex-Taq Buffer 2.5 μL;Ex-Taq 0.25 μL;P1(上游引物) 0.5 μL;P2(下游引物)0.5 μL;cDNA 5 μL;d H2O 16.25 μL。
反应条件为:95℃预变性5 min,94℃变性1 min,54.4℃退火1 min,72℃延伸1.5 min,72℃终延伸10 min,30个循环,反应结束后,对PCR产物进行核酸电泳鉴定。
1.2.2 猪流行性腹泻病毒N基因原核表达载体的构建与鉴定
将上述的PCR产物胶回收后与PMD18-T载体16℃连接过夜。将连接产物转化至E.coli TG1中并均匀涂在A+抗性的LB平板上。24 h后菌落PCR鉴定。然后将初步鉴定的菌液提取质粒进行酶切鉴定。最后将初步鉴定为阳性的菌液进行测序[7-8]。根据测序结果的基因序列设计一对引物进行N基因的亚克隆,引物中划线的部分分别为插入的Bam HⅠ和Hind III酶切位点。
上游(N1):5′GGATCCATGCCTCTTAGGGTT 3′
下游(N2):5′AAGCTTGATTTCCTGTATCGAA 3′
RT-PCR 体系如下:10×Ex-Taq Buffer 2.5 μL;Ex-Taq 0.25 μL;P1(上游引物)0.5 μL;P2(下游引物)0.5 μL;cDNA 5 μL;d H2O 16.25 μL。将 PCR产物经胶回收后与PET-30a载体分别用Bam HⅠ和HindⅢ进行双酶切、常规转化筛选阳性的质粒转入BL21中经RT-PCR鉴定构建重组质粒,命名为PET-30a-PEDV-N/BL21[9]。
1.2.3 重组的猪流行性腹泻病毒N蛋白的表达
将重组的PET-30a-PEDV-N/BL21菌液进行活化,加入终浓度为0.5 mmol·mL-1IPTG在37℃条件下诱导表达。加入IPTG后用1.5 mL EP管每隔1 h取一管菌液,共取7 h。将收集到的菌液4℃、12 000 r·min-1离心5 min收集沉淀。每管沉淀用20 μL的PBS悬起后加入等量的2×SDS凝胶上样缓冲液,沸水煮10 min,用于SDS-PAGE电泳分析。1.2.4 猪流行性腹泻病毒的细胞培养
生长良好的Vero单层细胞弃去培养液,用PBS液清洗2次,将分离的病毒上清液与含2%胎牛血清的DMEM按10%的比例进行混合接种于细胞瓶内,并加入不含EDTA的胰酶,使混合液中胰酶的终浓度为50 μg·mL-1。在37℃培养箱内孵育1 h,之后加入含终浓度50 μg·mL-1胰酶维持液的DMEM(含2%血清),37℃培养,逐日观察,72 h为一个传代周期。传代前细胞培养物反复冻融3次,离心去除细胞碎片后同样方法进行传代。整个过程中都设有不接种病毒并含有同样浓度胰酶的细胞培养物作对照[10]。
1.2.5 猪流行性腹泻病毒(PEDV)全病毒多克隆抗体的制备
将大量细胞培养的病毒超离纯化,然后测定病毒的浓度,调整病毒的浓度达到2 mg·mL-1[11]。取1 mL病毒与等量的弗氏完全佐剂充分乳化,采用皮下多点注射到兔子背部进行免疫。两周后,调整病毒浓度为1 mg·mL-1,取1 mL病毒与等量的弗氏不完全佐剂充分乳化经皮下多点注射进行加强免疫,以后每隔7 d加强免疫一次,共进行4次。最后一次免疫后一周,颈动脉无菌取血。血液在37℃放置2 h后,转入4℃放置过夜,次日无菌收集血清,分装后于-40℃保存[12]。
1.2.6 多克隆抗体及重组蛋白的特异性检测
用Western blot的方法检测重组的N蛋白的生物学活性[13]。试验样品为重组的PEDV的N蛋白,以及诱导后的空载体。二抗为山羊抗兔的HRPIgG。用DAB显色进行观察。
2 结果与分析
2.1 N基因扩增及重组质粒的鉴定
利用RT-PCR方法扩增出PEDV的N基因,PCR产物经1%的琼脂糖凝胶电泳分析与预期大小一致,约为1 400 bp(见图1)。DNA测序表明该基因与参考毒株序列同源性在90%以上,基因大小为1 326 bp,并获得GenBank登录号(GU321197),其编码氨基酸序列(441 aa)(见图2)。将重组质粒PET-30a-PEDV-N进行双酶切及PCR产物经1%的琼脂糖凝胶电泳分析与预期的目的片段大小相符(结果见图3和4), 表明基因克隆成功,重组质粒可用于诱导表达蛋白。

图1 PCR扩增结果Fig.1 PCR amplifying N gene

图2 PEDV HLJBY株N基因编码的氨基酸序列Fig.2 Deduce amino acids of PEDV isolate HLJBY N gene
2.2 重组质粒的诱导表达
将重组的PET-30a-PEDV-N/BL21菌液经IPTG在37℃条件下诱导后,SDS-PAGE分析显示诱导后的菌体蛋白与未诱导的对照菌以及诱导后的空载体菌相比较,有一条非常明显的蛋白表达带。并且随表达时间的增加蛋白的浓度增大(见图5)。参照分子质量标准,蛋白大小约为54 ku,与预测的目的蛋白大小一致,证明该重组质粒在大肠杆菌中得到了表达。Western blot证实该蛋白可与抗全病毒多抗血清发生特异性反应。
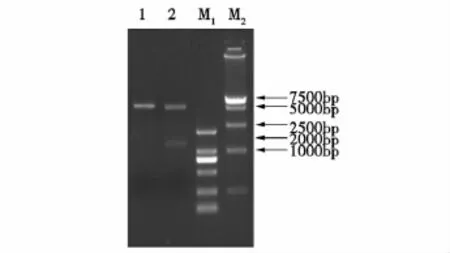
图3 重组质粒PET-30a-PEDV-N的单双酶切结果Fig.3 Enzyme digestion of PET-30a-PEDV-N
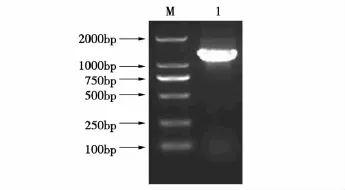
图4 PET-30a-PEDV-N/BL21重组菌的菌液PCR扩增结果Fig.4PCRofPET-30a-PEDV-N/BL21transformedbacteria

图5 PET-30a-PEDV-N/BL21重组菌的蛋白表达结果Fig.5 Expression of PEDV N protein
2.3 猪流行性腹泻病毒的细胞培养结果
定的中和的能力,因此TGEV对欧洲猪群的危害目前没有PEDV严重[16]。相对比,TGEV和PEDV对包括中国在内的亚洲国家的猪群均有较大的潜在威胁,特别是目前有关PEDV流行病学、病毒致病特性、诊断预防等相关研究报道较少。本研究首要目的是特性一株我们实验室近来分离的PEDV地方分离株(HLJBY)在细胞上的培养特性,并通过PCR和基因克隆技术分子鉴定该毒株。
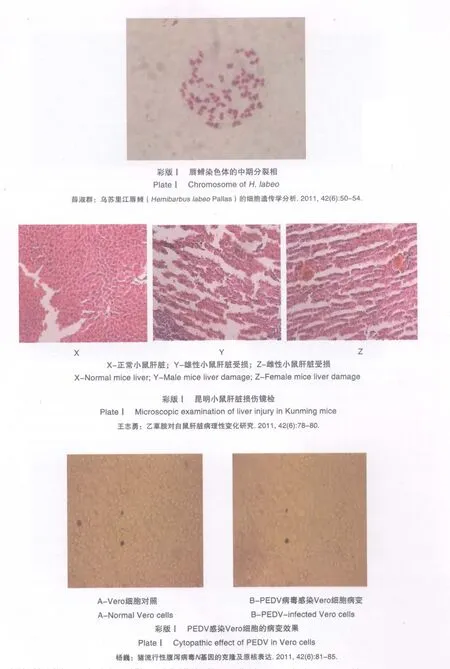
1988年,Hofmann等首次在培养基中含胰酶的Vero细胞上成功繁殖了PEDV[10],试验中仍采用相似的技术分析PEDV HLJBY株的细胞感染特性,致细胞病变(CPE)分析表明该毒株能很快适应Vero细胞,盲传8代以后即可出现典型的CPE。该细胞适应株的获得可为病毒大量繁殖及为可适用于现地
彩图版ⅠA为正常Vero细胞,细胞保持致密单层呈长梭形,轮廓清晰,细胞脱落极少。彩图版IB为被PEDV病毒感染的Vero细胞,细胞开始圆缩,脱落,细胞间空隙加大,最后大量细胞脱落拉成网状,表明该病毒已经适应Vero细胞,可进行连续传代。
3 讨论
PEDV和猪传染性胃肠炎病毒(TGEV)均属于造成仔猪腹泻的重要I群动物冠状病毒,给养猪业造成了巨大的经济损失[13-15]在欧洲的猪群中近年来出现了一个TGEV的一个呼吸道变异株(PRCV)的广泛感染。由于感染PRCV猪的血清对TGEV有一免疫的疫苗研制提供了重要基础。
PEDV的N蛋白在病毒RNA合成过程中发挥着重要的作用,它能与细胞膜和磷脂结合,促进病毒的组装和RNA复制体的形成。并且N蛋白在PEDV的结构蛋白中所占的比例最大,在感染的细胞中能得到大量表达。猪在感染PEDV的早期体内就能产生抗N蛋白的高水平抗体。因此我们利用RT-PCR技术扩增了PEDV HLJBY株的N基因。测序结果表明扩增的产物含N基因完整开放阅读框,通过序列测定在分子水平上证实了我们分离的病毒为PEDV。同时通过基因融合技术,成功构建了PET-30a-PEDV-N重组质粒;在大肠杆菌表达系统建立了高效表达N蛋白的原核表达体系,获得了大量的N蛋白,为PEDV功能研究提供了重要实验材料。随后我们将PEDV在Vero细胞上大量繁殖后超离纯化,作为免疫原制备了兔抗PEDV的多克隆抗体血清。Western-blot显示原核表达重组蛋白能与PEDV全病毒多抗血清发生特异性反应说明重组蛋白和多抗血清具有较好的生物学活性,为建立新的PEDV检测方法奠定了重要基础。
4 结论
本试验分离了一PEDV地方流行株HLJBY,并将该分离株通过连续多次盲传后使其适应在Vero细胞上增殖。利用基因重组技术,构建了含PEDV N基因的重组DNA质粒,转化大肠杆菌后,在该外源表达系统高效表达了PEDV N蛋白。通过超速离心的方法将PEDV进行纯化,用纯化后的全病毒作为抗原免疫家兔,通过抗体测定实验表明纯化后的PEDV可作为良好的免疫原制备高免血清。通过蛋白电泳分离PEDV N蛋白后,用抗PEDV多克隆抗体作为一抗进行免疫印迹实验证明表达的PEDV N蛋白与抗PEDV多克隆抗体有良好的免疫反应性。
[1] Pensaert M B,Debouck P.A new coronavirus-like particle associated with diarrhea in swine[J].Arch Virol,1978,58(3):243-247.
[2] 张强敏,郭福生,尹燕博,等.猪流行性腹泻病毒分子生物学特征[J].中国病毒学,2002,17(4):381-384.
[3] 斯特劳B E.猪病学[M].8版.赵德明,张仲秋,沈建忠,译.北京:中国农业大学出版社,2000:181-187.
[4] Kocherhans,R.,Bridgen,A.,Ackermann,M.,et al.Completion of the porcine epidemic diarrhoea coronavirus (PEDV)genome sequence[J].Virus Genes,2001,23(2):137-144.
[5] Timani K A,Liao Q J,Ye L B,et al.Nuclear/nucleolar localization properties of C-terminal nucleocapsid protein of SARS coronavirus[J].Virus Res,2005,114:23-34.
[6] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.黄培堂,王嘉玺,朱厚础,等译.北京:科学出版社,2002.
[7] 孙东波,冯力,时洪艳,等.猪传染性胃肠炎病毒N基因的原核表达及重组蛋白的免疫活性分析[J].病毒学报,2006,22(2):147-149.
[8] 任晓峰,李一经,李广兴,等.猪传染性胃肠炎病毒S基因杆状病毒/昆虫细胞表达系统重组质粒的构建 [J].东北农业大学学报,2002,33(4):359-363.
[9] Ren XF,LI YJ,LI GX,et al.Cloning and identification of S gene from Chinese isolate TH-98 of transmissible gastroenteritis virus[J].Journal of Northeast Agricultural University:English Edition,2002,9(1):49-54.
[10] Hofmann M,Wyler R.Propagation of the virus of PED in cell culture[J].J Clin Microbiol,1988,26:2235-2239.
[11] 钱刚,冯力,刘胜旺,等.猪传染性胃肠炎病毒纤突蛋白基因的修饰及原核表达的研究[J].东北农业大学学报,2005,36(5):611-614.
[12] 裴敦国,葛俊伟,马广鹏,等.抗猪流行性腹泻病毒N蛋白单克隆抗体制备及部分特性鉴定[J].东北农业大学学报,2008,39(7):84-89.
[13] 石娜,李广兴,任晓峰,等.猪IL-15与PRRS病毒GP5基因核酸疫苗免疫效力[J].东北农业大学学报,2010,41(1):97-102.
[14] Bridgen A,Duarte M,Tobler K,et al.Sequence determination of the nucleocapsid protein gene of the porcine epidemic diarrhea virus confirms that this virus is a coronavirus related to human coronavirus 229E and porcine transmissible gastroenteritis virus[J].J Gen Virol,1993,74:1795-1804.
[15] Ren X,Suo S,Jang Y S.Development of a porcine epidemic diarrhea virus M protein-based ELISA for virus detection[EB/OL].Biotechnol Lett.2010[Epub ahead of print]DOI 10.1007/s10529-010-0420-8.2010.
[16] Schwegmann-Wessels C,Herrler G.Transmissible gastroenteritis virus infection:a vanishing specter [J].Dtsch Tierarztl Wochenschr,2006,113:157-159.

