小鼠乳腺组织不同发育时期STAT1和PIAS1蛋白表达
李 晔,李庆章
(乳品科学教育部重点实验室,东北农业大学,哈尔滨 150030)
STATs蛋白家族是一类反式作用因子,它既参与细胞跨膜信息向核内的传输,又直接参与靶基因的转录调控,广泛参与细胞增殖、分化、周期调控及凋亡过程[1]。STAT1是STATs家族中最先发现的成员,可被INFα、INFY、IL-6、FGF、GM-CSF和PDGF等细胞因子激活[2]。它不仅在机体免疫应答、炎症反应等多种生理、病理过程中发挥重要作用,还控制着大量基因的转录,涉及到细胞的生长分化、凋亡的调节、细胞因子产生等。
PIAS1是Shuai等用酵母双杂交筛选能与STAT1的C端转录活性功能区作用的蛋白质时发现的[3],是STAT1特异性抑制子,同时也是PIASs蛋白家族的第一个成员。其对STAT1的抑制作用,一方面是通过与二聚化的STAT1结合、掩盖STAT1的DNA结合功能域,从而抑制转录[4];另一方面是通过与STAT1单体结合阻碍其二聚化而实现。近期研究表明,PIAS蛋白不只是激活STATS的抑制蛋白,它们还与许多其他蛋白质相互作用,参与多种转录因子的活性调控和多种蛋白质修饰,从而调控细胞的增殖、分化及细胞凋亡等,与肿瘤性疾病密切相关[5]。PIAS1-/-小鼠表现为STAT1介导的部分基因转录增加,对病毒和细菌的抵抗力增强,对脂多糖引起的内毒素性休克敏感,血清中促炎症反应因子水平增高,发育迟缓,围产期死亡等[6]。目前为止还没有对正常乳腺组织中STAT1及PIAS1在蛋白水平表达进行系统检测的报道,也没有关于STAT1及PIAS1在小鼠乳腺发育和泌乳中具体作用的系统研究。本研究旨在阐述STAT1及PIAS1在哺乳动物乳腺发育、泌乳及退化过程中表达定位的动态变化,揭示STAT1及PIAS1表达变化与乳腺发育及泌乳功能的关系。
1 材料与方法
1.1 材料
1.1.1 动物分组与取材
实验动物为BALB/c小鼠。根据小鼠乳腺发育的时间和生理特点,分别在青春期(V)、妊娠期(P)、泌乳期(L)以及退化期(I)(在泌乳22 d时将母鼠与子鼠分笼,分笼后第1日记为自然退化1 d),4个时期共设立12个取样点(青春期4周V4w,青春期5周(V5w),青春期7周(V7w),妊娠期2 d(P2 d),妊娠期9 d(P9 d),妊娠期13 d(P13 d),泌乳期2 d(L2 d),泌乳期9 d(L9 d),泌乳期13 d(L13 d),退化期2 d(I2 d),退化期5 d(I5 d),退化期10 d(I10 d),每个取样点选取3只小鼠作平行,每次试验至少重复3次。断颈处死,分离剪取第4对腺体,液氮速冻3 min,转移至-80℃低温冰箱保存。
1.1.2 主要试剂和仪器
Trizol(Invitrogen), SYBR PrimeScriptTMRT-PCR Kit(TaKaRa),羊抗鼠PIAS1多克隆IgG(sc-8152),兔抗鼠STAT1多克隆IgG(sc-346),β-Actin小鼠单克隆IgG(sc-47778),辣根过氧化物酶标记兔抗羊IgG,辣根过氧化物酶标记羊抗兔IgG,驴抗羊IgG-FITC(sc-2024),驴抗兔 IgG-R(sc-2095)(以上均为 Santa Cruz Biotechnology)。DAPI,Triton-X-100。其他试剂均为市售分析纯试剂。7300 PCR扩增仪(美国Applied Biosystem)、激光扫描共聚焦显微镜(德国Leica TCS SP2)、蛋白电泳仪、半干转移电泳仪(美国Bio-RAD公司)。
1.2 方法
1.2.1 小鼠乳腺中STAT1及PIAS1的荧光定量PCR分析
应用荧光定量PCR方法检测青春期、妊娠期、泌乳期和退化期小鼠乳腺组织中STAT1和PIAS1基因mRNA表达水平变化。试验中选用β-actin这一在不同组织中稳定表达的基因作为内参,各基因表达的检测结果通过计算可获得相对表达量,各基因的引物如表1所示。
RNA经过反转录后使用TaKaRa公司的SYBR®Premix Ex TaqTM试剂盒进行荧光定量PCR试验,试验仪器为ABI公司的7300荧光定量PCR仪。反应条件为:预变性95℃ 10 s;95℃5 s,60℃31 s,40个循环;溶解曲线分析。每个基因进行3个平行试验。

表1 相关基因qRT-PCR引物设计Table 1 Primer of genes for qRT-PCR
1.2.2 小鼠乳腺中STAT1及PIAS1的Western blotting表达定量分析
分别取青春期、妊娠期、泌乳期和退化期小鼠乳腺组织提取总蛋白,选择5%的浓缩胶和10%的分离胶进行SDS-PAGE分析。电泳结束后将凝胶上的蛋白转印到硝酸纤维素膜上,37℃用脱脂牛奶封闭2 h,用3 mL 1∶500稀释的抗体4℃孵育过夜。取出后用TBST洗3次,每次5 min,再用3 mL 1:2 000稀释的相应IgG二抗37℃摇床孵育1 h,TBST洗3次,发光液显色,在暗室中曝光、显影。使用BandScand 4.3软件对图像进行灰度扫描,记录灰度值。
1.2.3 小鼠乳腺中STAT1及PIAS1的免疫荧光表达定位检测
分别取青春期、妊娠期、泌乳期和退化期小鼠乳腺组织制作冰冻切片,4%多聚甲醛室温固定10 min后用PBS洗3次,每次10 min,10%BSA 37℃孵育90 min,STAT1和PIAS1混合抗体4℃孵育过夜(抗体用0.4%TritonX-100/PBS稀释,稀释比例1∶100)。取出后用PBS洗3次,每次5 min,用驴抗羊IgG-FITC和驴抗兔IgG-R二抗混合物,37℃孵育30 min(稀释比例1∶200),PBS洗3次,每次10 min,DAPI染核5 min,PBS洗2次后,用抗荧光淬灭封片剂封片。每只小鼠的乳腺取不同部位进行连续切片,每个试验至少重复3次,每张切片选取3个视野观察,用激光扫描共聚焦显微镜(Laser scanning confocal microscopy,LSCM)进行扫描拍照(400×)。
1.3 数据处理
应用SPSS16.0统计分析软件进行数据统计分析,所得数据均以平均数±标准差表示,同一样本不同处理的结果进行t检验,多组数据之间进行方差分析(P<0.05),为统计学有显著性差异。
2 结果与分析
2.1 小鼠乳腺中STAT1及PIAS1的荧光定量PCR分析
不同时期小鼠乳腺组织样品提取总RNA,应用qRT-PCR方法,以β-actin为内参,分别扩增STAT1、PIAS1及内参基因β-actin,得出表达结果。STAT1在小鼠乳腺不同发育时期表达的变化趋势:STAT1在青春期随着乳腺组织的发育表达量有所增加,但相对较低(P<0.05);妊娠期表达量最低且显著低于其他时期(P<0.05);而在泌乳期初期出现相对较高峰值,随后降低至妊娠期水平、退化期表达相对逐渐升高,在退化末期达到峰值,且差异显著(P<0.05)(见图1)。PIAS1在小鼠乳腺不同发育时期表达的变化趋势:PIAS1在青春期表达相对较低(P<0.05),妊娠初期表达量相对青春期有
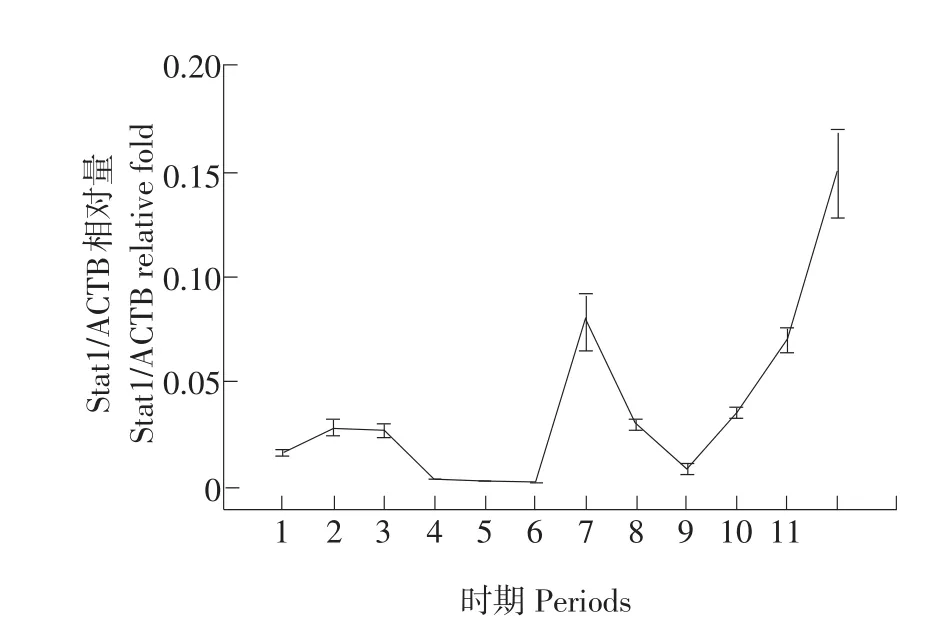
图1 小鼠乳腺发育、泌乳及退化过程中STAT1 mRNA表达动态变化Fig.1 Expression of STAT1 mRNA in mouse mammary gland development,lactation and involution
2.2 小鼠乳腺中STAT1及PIAS1的Western blotting表达定量分析
不同时期小鼠乳腺组织样品提取总蛋白,以β-actin为内参,分别检测STAT1、PIAS1及内参基因。STAT1在小鼠乳腺不同发育时期表达的变化趋势:STAT1在青春期随着乳腺组织的发育表达量有所增加;妊娠期表达量最低且显著低于其他时期(P<0.05);而在泌乳期初期相对较低,随后随着泌明显升高,在泌乳期初期出现相对较高峰值且维持在泌乳时期,停止泌乳后表达量降低至妊娠期水平,在乳腺退化过程中逐渐升高在退化末期达到峰值,且差异显著(P<0.05)(见图2)。乳结束、退化期表达相对逐渐升高在退化末期达到峰值,且差异显著(P<0.05)(见图3,4)。PIAS1在小鼠乳腺不同发育时期表达的变化趋势:PIAS1在青春期低表达,妊娠初期表达量相对青春期有明显升高,在泌乳期初期出现相对较高峰值且维持在泌乳时期,停止泌乳后表达量降低至妊娠期水平,在乳腺退化过程中逐渐升高在退化末期达到峰值,且差异显著(P<0.05)(见图3,4)。

图2 小鼠乳腺发育、泌乳及退化过程中PIAS1 mRNA表达动态变化Fig.2 Expression of PIAS1 mRNA in mouse mammary gland development,lactation and involution

图3 小鼠乳腺发育、泌乳及退化过程中STAT1和PIAS1蛋白表达变化Fig.3 Expression of STAT1 and PIAS1 in mouse mammary gland development,lactation and involution

图4 小鼠乳腺发育、泌乳及退化过程中STAT1和PIAS1蛋白表达动态变化Fig.4 Expression of STAT1 and PIAS1 in mouse mammary gland development,lactation and involution
2.3 小鼠乳腺中STAT1及PIAS1的免疫荧光表达定位检测
STAT1和PIAS1作为重要的转录因子,主要分布于导管和腺泡上皮细胞及脂肪细胞细胞质中。青春期乳腺中实质组织很少,乳腺大部分被脂肪垫占据,STAT1和PIAS1表达相对较弱,腺泡上皮细胞和导管上皮细胞有少量表达(见彩版ⅠA~C)。妊娠期乳腺上皮细胞广泛增殖,引起乳腺腺泡结构的大量发育,脂肪细胞和乳腺腺泡上皮细胞均有STAT1和PIAS1表达,主要在乳腺腺泡和乳导管的腔壁上,PIAS1表达相对明显(见彩版ⅠD~F)。泌乳期,腺泡上皮细胞和脂肪细胞STAT1和PIAS1表达明显(见彩版ⅠG~I)。退化期乳腺的腺泡开始逐渐消失,乳腺腺泡和导管上皮细胞都有STAT1和PIAS1表达,而随着退化期的进行乳腺上皮细胞PIAS1表达也较明显(见彩版ⅠJ~L)。
3 讨论
STAT1是STATs家族中最先发现的成员,可被细胞因子激活,参与机体多种生理、病理过程[7];同时还控制着大量基因的转录,涉及到细胞的生长分化、凋亡的调节[8]、细胞因子产生等。STAT1是由IFNs介导的抑制生长、促进凋亡蛋白因子,研究表明STAT1缺失可导致生长抑制失调,并且可以激活转录因子cyclin D1的激酶抑制子p21[9-11]。PIAS蛋白最初是作为STAT信号通路的负性调节因子而确定的,PIAS1与STAT1相互作用并阻止其与DNA结合。除了STAT1,PIAS1还能与NF-κBp65亚单位相互作用,抑制其介导的转录。新近研究发现PIAS具有SUMO-E3连接酶活性,介导多种蛋白发生类泛素化[12-13],PIAS1能促进SMAD4的类泛素化,正性调节TGF-β信号通路[13];PIAS蛋白亦具有促凋亡效应,在人293T细胞系和骨肉瘤U2OS细胞系中PIAS1能够诱导凋亡[14];PIAS1促进Sam68类泛素化,从而抑制细胞周期蛋白cyclin D1表达及细胞凋亡[15];PIAS1可抑制Oct4作用,影响干细胞分化影响[16];以上提示了PIAS1蛋白重要功能。STAT1和PIAS1,作为细胞生长、分化、凋亡的调控因子,近年研究主要集中在病理状态,据报道,乳腺组织缺少STAT1的表达可加剧癌症风险[17];但在正常组织中其生物学功能的研究甚少。
本研究的结果表明,青春期4周龄小鼠乳腺开始发育,STAT1和PIAS1表达水平较低,进入青春晚期后,STAT1表达略微升高,而PIAS1表达量几乎没有变化,青春期7周龄小鼠乳腺发育基本结束,进入性成熟阶段。进入妊娠期后,STAT1的表达下降,PIAS1表达升高,在妊娠期维持相对高水平。推测PIAS1抑制STAT1的表达及行使功能。进入泌乳期后,细胞因子主要是维持细胞生存,抑制细胞凋亡;在泌乳初期STAT1和PIAS1的表达量均出现较高水平;泌乳后期,泌乳量下降,STAT1和PIAS1表达也呈下降趋势。进入退化期STAT1和PIAS1表达水平再次升高,表明其在正常小鼠乳腺退化过程中也具有重要作用。
在小鼠乳腺发育的生理过程中,STAT1和PIAS1主要表达于乳腺上皮细胞的胞质中,表达量变化波动明显,提示STAT1和PIAS1参与乳腺发育、泌乳及退化并通过信号转导通路间的交互作用,并发挥一定的功能调控乳腺组织中细胞的生长和凋亡。
4 结论
小鼠乳腺整个发育各时期,STAT1和PIAS1均有表达,表达水平具有较强的相关性。青春期较低,妊娠期STAT1下降、PIAS1升高,泌乳期表达均升高并逐渐下降,退化期显著升高,在退化末期达到最高。STAT1和PIAS1可能促进泌乳期乳腺上皮细胞的分化及泌乳发动,启动退化期乳腺细胞凋亡和乳腺组织重建。

[1] Levy D E,Darnell JE.STATs:Transcriptional control and biological impact[J].Nature Rev Mol Cell Biol,2002,3:651-662.
[2] Shuai K,Liu B.Regulation of JAK-STAT signaling in the immune system[J].Nat Rev Immunol,2003(3):900-911.
[3] Shuai K,Horvath C M,Huang H L,et al.Interferon activation of the transcription factor STAT1 involves dimerization through SH-phosphotyrosyl peptide interactions[J].Cell,1994,76:821-828.
[4] Liang M,Melchior F,Feng X H,et al.Regulation of Smad4 sumoylation and transforming growth factor-beta signaling by protein inhibitor of activated STAT1[J].J Biol Chem,2004,279:22857-22865.
[5] Schmidt D,Muller S.PIAS/SUMO:new partners in transcriptional regulation[J].Cell Mol Life Sci,2003,60:2561-2574.
[6] Liu B,Mink S,Wong K A,et al.PIAS1 selectively inhibits interferon-inducible genes and is important in innate immunity[J].Nature Immunol,2004,5(9):891-898.
[7] Hae H J,Jeeyun L,Joo H K,et al.STAT1 and Nmi are downstream targets of Ets-1 transcription factor in MCF-7 human breast cancer cell[J].FEBS Letters,2005,579:3941-3946.
[8] Velmurugesan A,Iryna K,Linn H,et al.Activation of STAT1 is required for interferon-alpha- mediated cell death[J].Experimental cell research,2011,317:9-19.
[9] Bromberg J F,Horvath C M,Wen Z,et al.Transcriptionally active Stat1 is required for the anti-proliferative effects of both interferon alpha and interferon gamma[J].Proc Natl Acad Sci USA,1996,93:7673-7678.
[10] Gooch J L,Herrera R E,Yee D.The role of p21 in interferon gamma-mediated growth inhibition of human breast cancer cells[J].Cell Growth Differ,2000(11):335-342.
[11] Dimco G,Knight R A,Latchman D S,et al.STAT1 interacts directly with cyclin D1/cdk4 and mediates cell cycle arrest[J].Cell Cycle,2010(9):4638-4649.
[12] Jackson P K.A new RING for SUMO:Wrestling transcriptional responses into nuclear bodies with PIAS family E3 SUMO ligases[J].Genes Dev,2001,15:3053-3058.
[13] Seiyu I,Kenji S,Ryuta M,et al.Regulation of transforming growth factor beta signaling by protein inhibitor of activated STAT,PIASy through Smad3[J].J Biol Chem,2003,278:34253-34258.
[14] Liu B,Shuai K.Induction of apoptosis by protein inhibitor of activated Stat1 through c-Jun NH2-terminal kinase activation[J].J Biol Chem,2001,276:36624-36631.
[15] Babicl I,Cherry E,Fujita D J.SUMO modification of Sam68 enhances its ability to repress cyclin D1 expression and inhibits its ability to induce apoptosis[J].Oncogene,2006,25:4955-4964.
[16] Elena T,Anna M,Vladimir N,et al.PIAS proteins as repressors of Oct4 function[J].J Mol Biol,2007,374:1200-1212.
[17] Peter J K,William J M,Gertraud W R,et al.Loss of STAT1 from mouse mammary epithelium results in an increased Neu-Induced tumor burden[J].Neoplasia,2010(12):899-905.

