小鼠附睾分泌蛋白Fam12b的原核表达与纯化
陈立瑾,田利源,李秀丽,汪 莉,王玉民,陈树林
(1.西北农林科技大学动物医学院,陕西 杨凌 712100;2.军事医学科学院 生物工程研究所,北京 海淀 100071)
附睾是连接睾丸和输精管的细长管道,哺乳动物的精子在睾丸中生成后,并没有达到功能上的成熟。在穿过附睾时,与附睾中的液体相互作用,才逐步获得授精的能力[1-3]。附睾基因功能的研究已经成为生殖生物学的一个热点。
本文研究的fam12b基因属于小鼠附睾基因,在小鼠出生后不久即有表达,且可以分泌到附睾腔中[4]。近来的研究将fam12b归为RNase A超家族的新成员[5-6]。大部分RNase A基因在大鼠、小鼠和人中含有同源基因[7],RNase A超家族成员具有多种生物学功能:可以降解核酸、抗菌、抗病毒[8]、抑制肿瘤生成[9]、参与哺乳动物内源宿主防御[10-11]等。fam12b基因在小鼠附睾中高表达[4],我们推测它可能参与了精子成熟的过程。目前还未见研究报道Fam12b蛋白的功能。
本试验中我们克隆了小鼠附睾基因fam12b,串联后连入pET28(a)载体,于大肠杆菌 Rosetta(DE3)中诱导表达,获得高纯度融合蛋白,为进一步研究Fam12b的功能创造了条件。
1 材料与方法
1.1 材料 8周龄C57雄鼠由北京军事医学科学院实验动物中心提供。
表达载体pET28(a)由国家仪器分析中心张学敏实验室惠赠;大肠杆菌 DH5α、Rosetta(DE3),购自北京全式金生物技术有限公司。
试剂:动物组织总RNA提取试剂盒、普通DNA产物纯化试剂盒,均购自北京天根生物科技有限公司;限制性内切酶Nde I、EcoRⅠ、HindⅢ、EcoR V、T4DNA连接酶,购自NEB生物公司;Ni-NTA亲和柱,购自Qiagen公司;PCR引物合成及测序均由北京奥科生物技术有限责任公司完成。
1.2 目的基因fam12b的获得 提取8周龄C57雄鼠附睾总RNA,反转录获得相应的cDNA。参照GenBank公布的序列(NM_203508.1),用信号肽分析软件(http://bmbpcu36.leeds.ac.uk/prot-analysis/signal)分析出信号肽序列,将去掉信号肽的序列扩增出来。扩增目的基因的两种片段1和2,在片段1的5端引入NdeⅠ酶切位点,在3端引入Eco RⅠ酶切位点;在片段2的5端引入Eco RⅠ酶切位点,3端引入Hin dⅢ酶切位点。其中片段1不含终止密码子,片段2含有终止密码子。
设计引物如下(下划线为酶切位点):
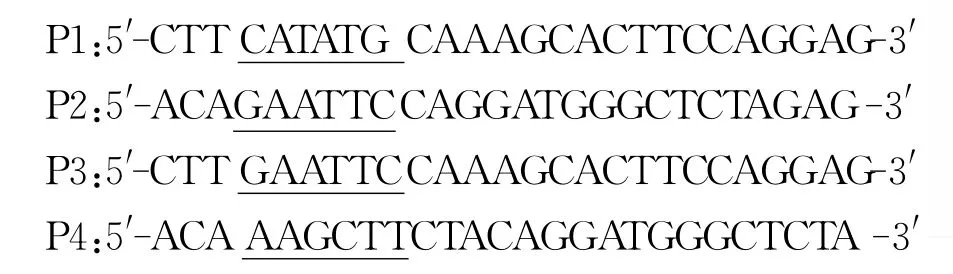
1.3 表达载体的构建及鉴定 片段1用NdeⅠ和Eco RⅠ双酶切,片段2用Eco RⅠ和Hin dⅢ双酶切,原核表达载体pET28(a)用Hin dⅢ、NdeⅠ双酶切,产物用T4DNA连接酶连接,转化大肠杆菌DH5α感受态细胞。用Hin dⅢ和Eco R V双酶切鉴定重组质粒,酶切正确的质粒由北京奥科生物技术有限责任公司测序。
1.4 融合蛋白的诱导表达 将测序正确的重组载体转化至大肠杆菌Rosetta(DE3)感受态细胞,37℃、200r/min振荡培养过夜。次日转接至新的液体培养基,振荡培养至OD600nm为0.6,加入终浓度为1mmol/L的IPTG,37℃诱导4h。收集1mL菌液,离心去上清加入溴酚蓝缓冲液悬浮沉淀,处理后进行SDS-PAGE检验。
1.5 Western-blot鉴定目的蛋白 将1.4中菌体裂解液进行SDS-PAGE,转移至0.22μm的PVDF膜上,用封闭液室温封闭1h,以His标签抗体孵育1h,TBST洗涤,羊抗鼠IgG-HRP孵育1h,TBST洗涤,加入HRP化学发光检测底物后在暗室显影。
1.6 纯化融合蛋白[12]将诱导成功的阳性菌液转接至新的液体培养液中,37℃、200r/min振荡培养至OD600nm为0.6,加入IPTG诱导,振荡培养4h。离心收集菌体细胞,-20℃冻存。IPTG诱导前后的菌液各取1mL,SDS-PAGE检测目的蛋白的表达。
取出冻存的菌体,按照QIAGEN蛋白纯化试剂盒说明书进行纯化,向10mL变性蛋白缓冲液B(pH值8.0)中加入500μL蛋白酶抑制剂溶液,混匀后加至菌体沉淀,室温放置1h。然后离心取上清加至Ni-NTA蛋白纯化柱,用变性蛋白缓冲液C(pH值6.3)洗涤2次后用变性蛋白缓冲液E(pH值4.5)洗脱3次。收集各步骤中流出的液体,SDS-PAGE检验。
2 结果
2.1 目的基因的克隆 经1%琼脂糖凝胶电泳,PCR扩增产物约在380bp处有特异性条带,与预期相符(图1)。

图1 fam12b基因的PCR扩增结果
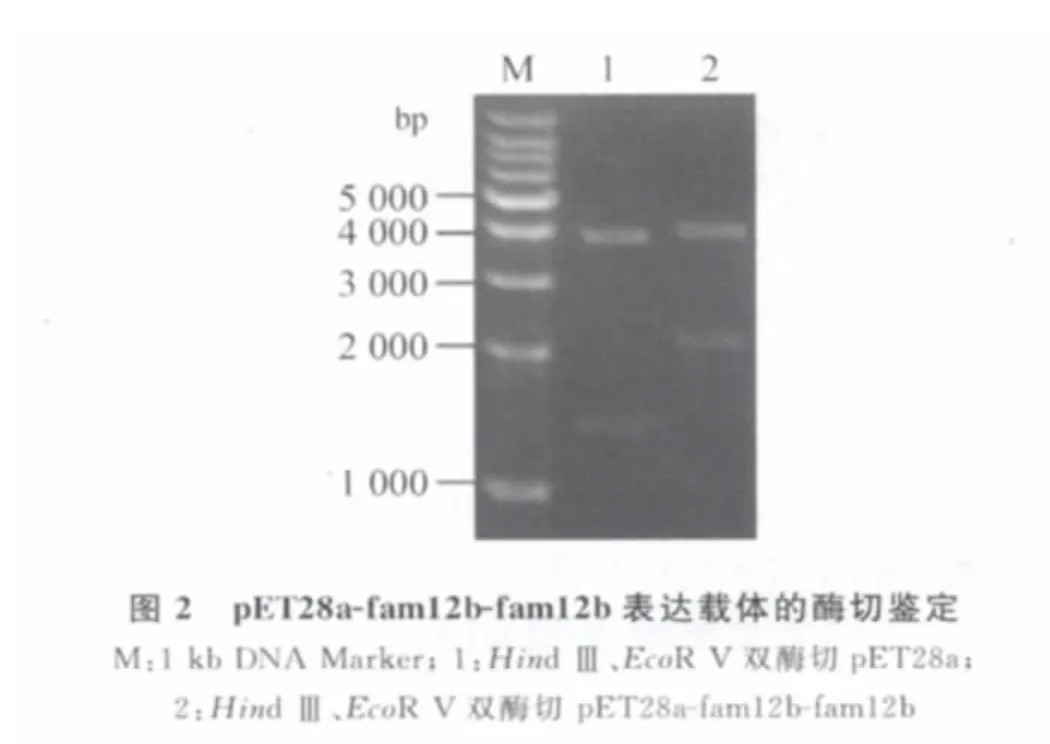
2.2 重组载体的鉴定 构建的重组质粒经Hin dⅢ、Eco R V双酶切鉴定,预期片段大小分别为2126bp与3969bp的片段,试验结果与预期相符(图2)。测序后显示成功获得序列完整且读码框正确的表达载体。
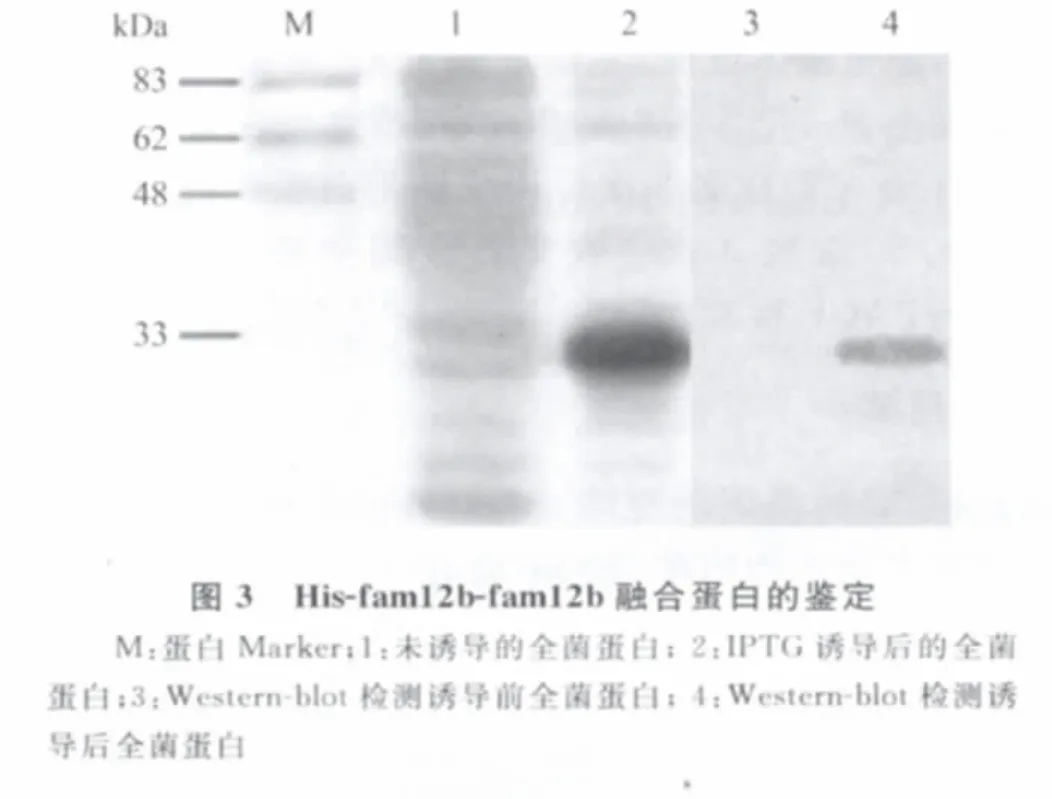
2.3 融合蛋白的诱导表达及鉴定 将1.4中处理的样品进行SDS-PAGE分析,在约31kDa处检测到蛋白表达的条带。Western-blot鉴定显示出在该位置处有特异性条带(图3)。
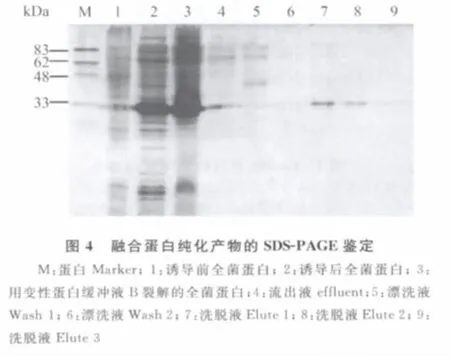
2.4 融合蛋白的亲和纯化 重组蛋白带有His标签,用Ni-NTA蛋白纯化柱亲和纯化,收集各步骤中的液体,进行SDS-PAGE电泳检测,如图4。
3 讨论
雄性哺乳动物的生殖道不容易被感染,很重要的一个原因是附睾上皮细胞会分泌一些蛋白,其中有些蛋白具有抗菌作用,保护精子可以顺利通过生殖道[13],精子在穿过附睾的过程中逐步成熟[14]。我们前期的工作用fam12b的单个基因连入pET28(a)载体,摸索了不同梯度的诱导剂浓度和诱导温度,但是均未检测到目的蛋白的表达;只有当两个相同的基因串联后,才能以融合蛋白的形式表达出来,我们推测该蛋白可能具有一定的抗菌能力,两个基因串联表达后,改变了天然存在蛋白的空间构象,进而干扰了蛋白的抗菌能力,故可以在大肠杆菌Rosetta中表达出来。另外,小分子蛋白的免疫原性较小,采用串联表达的方式可以增加该蛋白的免疫原性,便于制备抗体用于后续试验研究。
4 结语
本试验利用原核表达体系表达了小鼠附睾分泌蛋白Fam12b的融合蛋白,并获得纯度较好的蛋白,为制备其多克隆抗体奠定了基础,为进一步研究Fam12b的功能创造了条件。
[1]Cooper T G.Interactions between epididymal secretions and spermatozoa[J].J Reprod Fertil Suppl,1998,53:119-136.
[2]Brooks D E,Tiver K.Localization of epididymal secretory proteins on rat spermatozoa[J].J Reprod Fertil,1983,69(2):651-657.
[3]Jones R.Plasma membrane structure and remodelling during sperm maturation in the epididymis[J].J Reprod Fertil Suppl,1998,53:73-84.
[4]Oh J,Lee J,Woo J M,et al.Systematic identification and integrative analysis of novel genes expressed specifically or predominantly in mouse epididymis[J].BMC Genomics,2006,7:314.
[5]Christiane K.Human epididymis-specific gene expression[J].Anir-Anhp,2007,9:25-42.
[6]Thimon V,Koukoui O,Calvo E,et al.Region-specific gene expression profiling along the human epididymis[J].Molecular Human Reproduction,2007,13:691-704
[7]Cho S,Beintema J J,Zhang J.The ribonuclease A superfamily of mammals and birds:identifying new members and tracing evolutionary histories[J].Genomics,2005,85(2):208-220.
[8]Hooper L V,Stappenbeck T S,Hong C V,et al.Angiogenins:a new class of microbicidal proteins involved in innate immunity[J].Nat Immunol,2003,4(3):269-273.
[9]Ardelt W,Mikulski S M,Shogen K.Amino acid sequence of an anti-tumor protein from Rana pipiens oocytes and early embryos.Homology to pancreatic ribonucleases[J].J Biol Chem,1991,266(1):245-251.
[10]Dyer K D,Rosenberg H F.The RNase a superfamily:generation of diversity and innate host defense[J].Mol Divers,2006,10(4):585-597.
[11]Rosenberg H F.RNase A ribonucleases and host defense:an evolving story[J].J Leukoc Biol,2008,83(5):1079-1087.
[12]田利源,李秀丽,汪莉,等.小鼠附睾分泌蛋白Spink12的原核表达与纯化[J].解放军医学杂志,2010,35(2):197-200.
[13]张永莲.附睾功能基因组研究进展[J].中国科学院院刊,2002,17(1):34-36.
[14]Hall S H,Hamil K G,French F S.Host defense proteins of the male reproductive tract.[J].J Androl,2002,23(5):585-597.

