胃肠道间质瘤31例临床分析
卢 逊,吴 佩
(1.皖南医学院附属芜湖市第二人民医院 普外科,安徽 芜湖 241000;2.皖南医学院附属弋矶山医院 普外科,安徽芜湖 241001)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一种胃肠道非上皮性肿瘤,来源于胃肠道间质干细胞。近年来随着免疫组织化学的发展,对GIST的诊断已有了进一步认识。现将我院2002年2月~2010年2月经病理证实的GIST 31例报道如下,以进一步提高对该病的认识。
1 资料与方法
1.1 一般资料 本组31例,男18例,女13例,年龄40~74岁,平均年龄(56.3±2.4)岁,其中50岁以上26例,占83.8%。发病到就诊时间从6个月~5年不等,所有病例均经术中所见及病理结果证实。
1.2 临床表现 见表1。

表1 胃肠道间质瘤的临床表现(例次)
从表1中可见:食道间质瘤以吞咽困难,胃间质瘤以腹痛、呕血、黑便为首发症状,小肠间质瘤则以腹部肿块为首发症状,其次是黑便。而结肠间质瘤以腹部肿块和肠梗阻为首发症状。肠系膜间质瘤和大网膜间质瘤以腹部肿块为首发症状。
1.3 临床诊断 见表2。
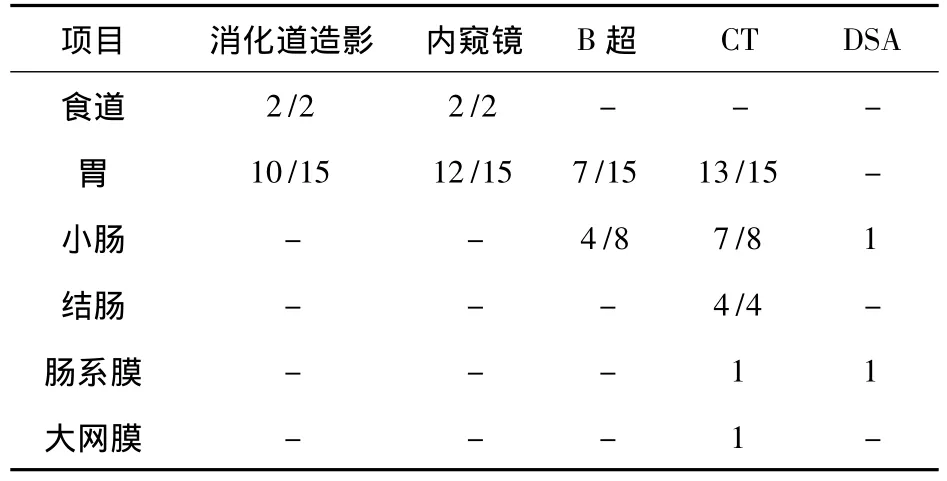
表2 胃肠道间质瘤的临床诊断(例次)
检查结果食道间质瘤2例,消化道造影和内窥镜检查均见食道压迫占位改变;胃间质瘤15例,消化道造影检查15例,阳性10例,内窥镜检查15例,阳性12例,B超检查15例阳性7例,CT检查15例,阳性13例;小肠间质瘤CT检查8例,阳性7例,有1例小肠间质瘤所有检查均阴性,DSA动脉插管造影确诊;结肠间质瘤4例,灌肠检查阴性,CT检查阳性;肠系膜间质瘤1例,CT检查阳性,DSA动脉插管造影阳性;大网膜间质瘤1例,仅CT检查阳性。可见CT检查阳性率为最高。
1.4 治疗方法 全部31例均行手术治疗,术中发现肿瘤位于食道2例(6.4%),胃15例(48.4%),小肠8例(其中十二指肠间质瘤2例,25.8%),结肠4例(12.9%),肠系膜1 例(3.2%),大网膜1 例(3.2%)。瘤体直径1~24 cm。所有病例术中均未见腹腔淋巴结肿大、转移(术后病理亦证实无淋巴结转移)。具体术式为:食道下段切除2例,胃癌根治术4例,胃大部切除术8例,行胃楔型切除术3例;十二指肠空肠部分切除术1例,十二指肠部分切除术1例,小肠肠段切除术8例;左半结肠切除术2例,右半结肠切除术2例,大网膜及肠系膜间质瘤各1例行肿瘤切除术。
1.5 随访 随访时间6月~7年。随访方式包括门诊复查、电话。极低度侵袭危险性2例,无复发。低度侵袭危险性4例,1例于术后3年复发,但因肿瘤较小(直径<1 cm),未再行手术切除,在观察中。中度侵袭危险性10例,2例分别于术后1年及3年复发,再次手术切除,术后情况良好。高度侵袭危险性15例,4例失访,4例死亡,7例分别于术后6月~5年发生复发或远处转移,5例再次手术,2例在服用甲磺酸伊马替尼治疗中,至今存活。
良性肿瘤31例,失访4例,其中2例分别于术后1年及3年复发,但因肿瘤较小(直径<1 cm),未再行手术切除,在观察中。余25例未发现有转移及复发现象;恶性肿瘤33例,失访9例,8例分别于术后6个月~5年发生复发或远处转移,4例再次手术(其中1例共行4次手术治疗),4例在进一步化疗中,至今存活,余12例未发现转移及复发(其中10例为低度恶性)。
2 结果
全部手术切除的标本都经病理学检查确诊:极低度侵袭危险性2例(6.5%),低度侵袭危险性4例(12.9%),中度侵袭危险性 10 例(32.3%),高度侵袭危险性15例(48.4%)。所检标本中未发现周围淋巴结转移。免疫组织化学染色为CD117阳性26例(90.3%),CD34 阳性 24 例(77.4%),共同表达CD117和CD34阳性21例(67.7%)。
3 讨论
3.1 发病情况及临床表现 1983年Maur[1]率先提出GIST的概念。目前认为GIST起源于胃肠道间质干细胞-Caja细胞,它不属于神经细胞却与神经功能密切相关,是胃肠道慢波活动的起搏点[2]。该细胞是胃肠道中惟一表达CD117和CD34的细胞。GIST临床表现无特异性,与肿瘤的部位、大小,是否引起梗阻及表面是否形成溃疡等有关。首发症状常表现为肿瘤坏死引起的消化道出血,可出现呕血和黑便,有时仅表现为贫血、恶心、呕吐、消瘦;其次为原因不明的腹部不适,腹痛或者可扪及的腹部肿块[3],部分病人可出现肠梗阻。GIST常见于中老年,无明显性别倾向,低于5%发生食管,39%~70%发生于胃,23% ~32%发生于小肠(与本组胃GIST发生率48.4%,小肠GIST发生率25.8%相当)。5%发生于结肠、直肠、肠系膜和网膜等。
3.2 诊断 GIST病人症状没有特异性,由于症状无特异性,且无特异的肿瘤学标志或实验室检查方法,故术前诊断率低。临床有意义的检查方法主要是影像学检查。消化道造影和内镜是最常见的检查手段,可能有助于确定GIST部位,但因GIST大多在黏膜下生长,胃镜、肠镜通常只能发现病变部位有局部隆起,但黏膜多光滑,不易取材,造成病理难以得到阳性结果。B超和CT作为术前的常规检查,有助于发现腔外肿块,了解肿块和周围脏器的关系,本组资料显示CT检查阳性率最高,尤其是螺旋CT,快速、方便、无创伤,密度分辨率最高,可以三维重建及进行CTA检查,能直接显示肿瘤本身的大小、形态、密度、内部结构、边界,对邻近结构的侵犯也显示得相当清楚,同时还可以观察其他部位的转移灶,有利于肿瘤的诊断、分期及鉴别诊断。DSA动脉插管造影对肿块较小且伴有消化道出血的患者最有帮助。然而上述方法均无法达到确诊的目的。本组病例术前均未确诊。对于GIST病人,术中的快速冰冻切片无法判断良恶性,且易造成肿瘤的播散,故不主张做术中快速病理。一般根据术中所见判断行相应的手术方式。最终确诊有赖于术后病理切片、免疫组化检查。病理诊断定性主要依靠CD117阳性和(或)CD34阳性,前者比后者有更高的敏感性和特异性[4,5]。本组病例 CD117 阳性率为 90.3%(26/31),高于CD34阳性率77.4%(24/31)。目前国际上对GIST都具有潜在恶性这一特点达成共识,认为不能简单地将GIST分为良性、恶性,而应按肿瘤的潜在侵袭危险性进行分级。Fletcher[6]推荐的GIST生物学评价表被广泛接受,见表3。
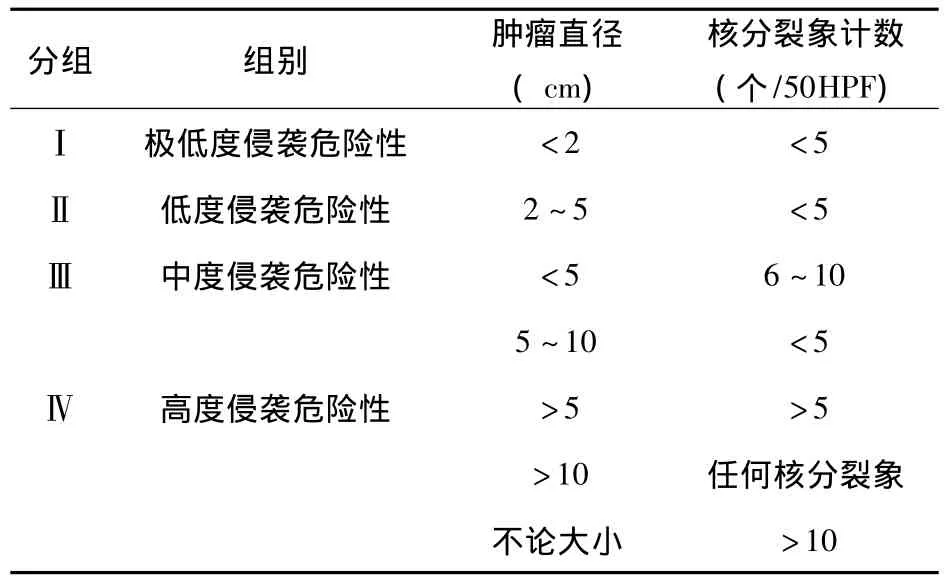
表3 胃肠道间质瘤临床病理特点
据此,本组病例诊断为极低度侵袭危险性2例(6.5%),低度侵袭危险性 4 例(12.9%),中度侵袭危险性 10例(32.3%),高度侵袭危险性 15例(48.4%)。
3.3 治疗 手术切除是GIST的首要治疗手段[7]。手术的规范性和合理性是影响疗效的重要因素。应根据术中探查的结果选择相应的手术方式:多发或与胃壁广泛粘连的GIST应行根治性胃大部切除术或全胃切除。胃肿瘤<5 cm的,切缘距肿瘤3 cm左右即可,靠近贲门或幽门的胃GIST应行近端或远端胃大部切除术,但切缘一定要注意是阴性;十二指肠GIST可行局部切除或保留胰头的十二指肠切除术,直径>5 cm,需要行胰十二指肠切除术。小肠GIST要求切除范围>10 cm以上的肠管,还要切除相应的小肠系膜,发生在结肠GIST可行左半或右半结肠切除术;直肠GIST怀疑高度侵袭危险性时,应行腹会阴联合切除术,而低度侵袭危险性且肿瘤直径<2 cm时常可行局部切除术。发生在肠道外的间质瘤可行局部切除术(应尽量完整切除)。对复发和转移的GlST应再次手术切除病灶。GIST肿瘤体积大、质地脆,仅包裹一层薄膜(假性包膜),内部往往伴有出血和坏死,易破溃造成腹腔内种植播散。术中应严格执行无瘤原则,精细操作,以免肿瘤破溃。GIST血行转移多见而鲜有淋巴转移,故术中不主张广泛性或区域性淋巴结清除术,但需整块切除肿瘤。切除过程中,尽可能先处理静脉。GIST的生长特点是悬垂式,非浸润性,扩大性切除病灶对病人的预后并无影响。现在普遍认为GIST患者术后的放化疗对改善患者预后没有作用[8]。目前发现GISTs与kit激酶基因突变有关,伊马替尼(imatinib)是针对c-kit基因产物的分子靶点药物。伊马替尼(imatinib)是一种人工合成的酪氨酸激酶抑制剂,可选择性抑制酪氨酸磷酸化,阻止c-kit将磷酸基从ATP上转移,抑制启动间质瘤细胞过度增生的信号过程,阻断信号的传递,促使其凋亡而达到治疗目的。已成为公认的GIST一线治疗药物。近来sunitinib被推荐用于对格列卫治疗疗效不佳的GIST患者,sunitinib是一种新的多靶向作用于酪氨酸激酶的抑制剂,其不仅拮抗由c-kit产生的酪氨酸激酶受体,且作用于与GIST有关的其他细胞信号通路。已被证明能延长抗甲磺酸伊马替尼患者的生存时间。Hopkins等[9]已开展2期和3期的临床试验,总之,手术切除是胃肠道间质瘤的首选治疗,分子靶向治疗将成为今后治疗的重要手段和发展方向。
[1]BUCHERP,VILLIGERP,EGGERJF,et al.Management of gastrointestinal stromal tumors:from diagnosisto treatment[J].Swiss med Wkly,2004,134(11):145 -153.
[2]唐军.胃肠运动起搏器-Cajal间质细胞研究进展[J].国外医学生理、病理科学与临床分册,2003,23(1):81.
[3]ROBERTS PJ,EISENBERG B.Clinical presentation of gastrointestinal stromal tumors and treatment of operable diease[J].Eur J Cancer,2002,38(l5):37 -38.
[4]刘晓红,马大烈,吴丽莉,等.原癌基因 c-kit在胃肠道间质瘤中的表达及其临床意义[J].中华外科杂志,2002,40(4):277.
[5]万厚民,李强,李海,等.胃肠恶性间质瘤17例[J].中国现代普通外科进展,2005,8(5):320.
[6]FLETCHER CD,BERMAN JJ,CORLESS C,et al.Diagnosis ofgastrointestinal stromal tumors;A consensus approach[J].Hum Pathol,2002,33(5):459 - 465.
[7]揭志刚,谢小平,秦克旺,等.胃肠道间质瘤预后因素的临床分析[J].中华胃肠外科,2005,5(8):210 -212.
[8]JEAN JP,CHOUDRY U,MUZIKANSKY A,et al.The effect of surgery and grade on outcome of gastrointestinal stromal tumors[J].Arch surg,2001,136:383 -389.
[9]HOPKINS T G,MARPLES M,STARK D.Sunitinib in the management ofgastrointestinal stromal tumors(GISTs)[J].Eur Jsurg Oncol,2008,34(8):844 -850.

