HPLC法测定江西不同产地蔓荆子中蔓荆子黄素的含量
杨人泽,钟美兴,钟星明(赣南医学院第一附属医院,赣州市341000)
蔓荆子为马鞭草科植物单叶蔓荆Vitex trifoliaL.var.simplicifoliaCham.或三叶蔓荆Vitex trifoliaL.的干燥成熟果实,为辛凉解表药,具有疏散风热、清利头目之功效,常用于治疗风热感冒、头痛等证[1]。单叶蔓荆分布广、产量大,其道地药材产区为山东[2],江西是其主产区之一[3];三叶蔓荆主产于海南、广西、云南等地。目前药用的蔓荆子有野生和人工栽培之分,由于生长环境的不同,其有效成分的含量差异很大。为了确保其药理作用和临床疗效,笔者采用高效液相色谱(HPLC)法[4]对江西5地10批次蔓荆子药材中蔓荆子黄素进行了含量测定[5~7],以为进一步开发利用蔓荆子[8,9]提供一定的科学依据。
1 仪器与试药
Agilent1100 HPLC仪(美国惠普公司);AEL204电子微量分析天平(瑞士梅特勒-托利多仪器有限公司);KQ-500B超声波清洗器(昆山市超声仪器有限公司,频率:40 kHz,功率:500 W);YLD-2000电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司)。
甲醇为色谱纯,水为超纯水,其他试剂均为分析纯;蔓荆子黄素(中国食品药品检定研究院,批号:111554-200903,纯度≥98%);10批蔓荆子药材(江西南昌1、江西南昌2、江西樟树1、江西樟树2、江西抚州1、江西抚州2、江西九江1、江西九江2、江西赣州1、江西赣州2)均于2009年8月采自江西各地,经鉴定为单叶蔓荆V.trifoliaL.var.simplicifoliaCham.的干燥成熟果实。
2 方法与结果
2.1 色谱条件
色谱柱:Alltima HPC18(250mm×4.6mm,5µm);流动相:乙腈-50mmol·L-1磷酸二氢钾溶液(磷酸调pH值为3.0)=50∶50;流速:1.0m L·m in-1;检测波长:254 nm;柱温:室温;进样量:10µL。色谱见图1。
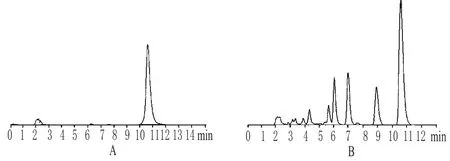
图1 高效液相色谱图A.蔓荆子黄素对照品;B.蔓荆子Fig 1 HPLC chromatogram s A.vitexicarpin control;B.V.trifolia
2.2 对照品溶液的制备
取蔓荆子黄素对照品约10mg,精密称定,置2m L量瓶中,加甲醇超声溶解并稀释至刻度,摇匀,精密吸取1m L,置50m L量瓶中,加甲醇稀释至刻度,摇匀,即得每1m L含0.1 mg的对照品溶液。0.45µm滤膜滤过,备用。
2.3 供试品溶液的制备
取蔓荆子药材中粉约2 g,精密称定,置索氏提取器中,加石油醚(60~90℃)适量,置水浴上提取3 h,弃去石油醚液,残渣挥干,再加甲醇适量,索氏提取6 h,甲醇提取液浓缩至约25 m L,用甲醇转移至50m L量瓶中并稀释至刻度,摇匀,即得(相当于每1m L甲醇中含有蔓荆子药材40mg)。
2.4 线性关系考察
分别精密吸取蔓荆子黄素对照品溶液2、5、7、10、12 µL,按上述色谱条件进样分析。以进样量(X)为横坐标,峰面积积分值(Y)为纵坐标,进行线性回归,得回归方程为Y=3 743.7X-2 878.2(r=0.999 4,n=5)。结果表明,蔓荆子黄素进样量在0.2~1.2µg范围内与峰面积积分值呈良好的线性关系。
2.5 精密度试验
精密吸取同一对照品溶液10µL,连续进样6次,测定蔓荆子黄素峰面积。结果,RSD=1.28%(n=6),表明仪器精密度良好。
2.6 重复性试验
取同一批样品适量,共6份,分别按“2.3”项下方法制备供试品溶液,按上述色谱条件进样测定。结果,RSD=2.64%(n=6),表明本方法重复性良好。
2.7 稳定性试验
在室温条件下,取适量供试品溶液于放置0、2、4、8、12 h时,按上述色谱条件进样测定,记录峰面积。结果,RSD=1.2%(n=5),表明供试品溶液在12 h内稳定。
2.8 加样回收率试验
称取9份已知含量的蔓荆子药材中粉约1 g,分别按“2.3”项下方法制成供试品溶液(蔓荆子黄素含量为0.582 5mg·g-1),经0.45µm微孔滤膜过滤,各取续滤液0.5m L,置于25m L量瓶中,分别加入低、中、高浓度的蔓荆子黄素对照品溶液各适量,以甲醇定容,按上述色谱条件测定蔓荆子黄素的含量,计算加样回收率,结果见表1。
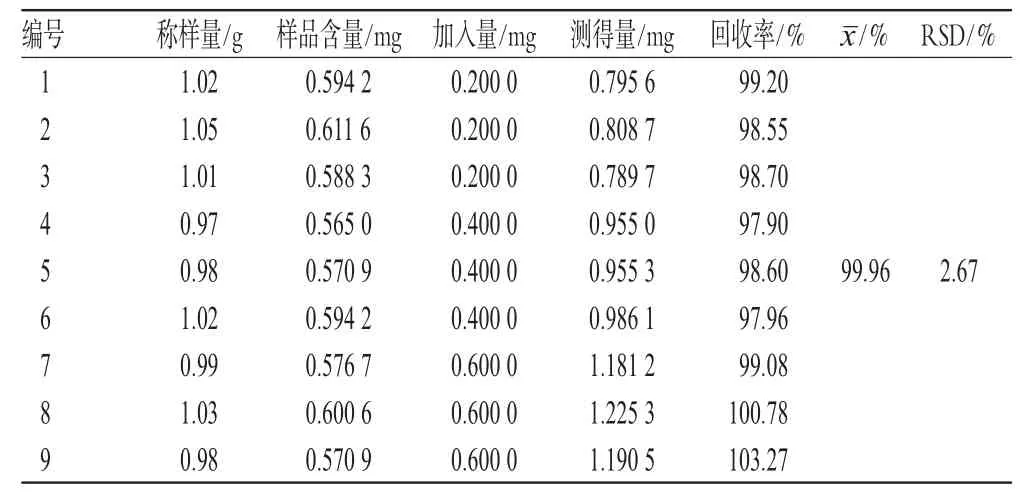
表1 加样回收率试验结果(n=9)Tab 1 Resultsof recovery tests(n=9)
2.9 样品含量测定
取10批样品,分别按“2.3”项下方法制备供试品溶液,各取10µL按上述色谱条件进样,测定峰面积,由线性回归方程计算样品中蔓荆子黄素的含量,结果见表2。
3 讨论
从测定结果可以看出,江西不同产地的蔓荆子药材中蔓荆子黄素的含量差异较大,最高的为0.063 7%,最低的为0.033 4%,含量相差2倍以上。其中含量较高的江西九江1、2号采自都昌县的蔓荆子GAP种植基地。蔓荆子主要生长在海边沙滩荒洲、河岸沙滩荒洲、盐碱地三大环境中。研究结果表明,生长在鄱阳湖边的1、2号样品及生长在赣江流域周边的3、4、5、6号样品要比生长在非河流、湖泊周边的山区样品的含量高。本试验结果可为蔓荆子的栽培、种植及采摘区域提供一定的科学依据,也表明药用植物都具有一些特异的适应性生境[10],同时也验证了江西是蔓荆子的适应产区。

表2 江西不同产地蔓荆子中蔓荆子黄素的含量测定结果(n=3)Tab 2 Results of content determ ination of vitexicarpin in V.trifolia from different producing areas of Jiangxi province(n=3)
目前在江西都昌县已建成全国最大的蔓荆子种植基地,面积达3万余亩。已有实验证明,蔓荆子中含有C2-C3双键的黄酮类化合物可以抑制某些癌症细胞的增殖[11],可以看出它在癌症的防治方面具有很大潜力。综上,本方法简便、快速、线性关系良好,可为进一步开发利用蔓荆子提供一定的科学依据,但该药材的开发利用还应在种质、遗传特性、生境、化学成分、药理药效方面做更深入的系统研究。
[1]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:340.
[2]胡世林.中国道地药材[M].哈尔滨:黑龙江科学技术出版杜,1989:415.
[3]朱圣和.中国药材商品学[M].北京:人民卫生出版杜,1990:307.
[4]胥秀英,郑一敏,杨艳红,等.高效液相色谱法测定蔓荆子中木犀草素的含量[J].时珍国医国药,2005,16(7):609.
[5]王 坤,管玉民,张桂菊,等.高效液相测定不同地区蔓荆子中蔓荆子黄素的含量[J].药物分析杂志,2003,23(4):257.
[6]彭 霞,台海川.HPLC测定傣药蔓荆叶中蔓荆子黄素的含量[J].中国民族医药杂志,2009,10(10):56.
[7]包桂花,康廷国,巴根那,等.HPLC法测定蒙药痔瘘六味丸中蔓荆子黄素的含量[J].辽宁中医杂志,2007,34(10):1 453.
[8]吴永忠,朱良辉,胡世林,等.不同产地蔓荆子化学成分含量比较[J].中药材,2000,23(10):616.
[9]徐榕青,林玉霖,林文津,等.不同产地蔓荆子生药材中总黄酮含量的比较研究[J].中药材,2008,31(2):243.
[10]王 璃,魏建和,陈士林,等.道地药材浙贝母产地适宜性的GIS分析[J].中国现代中药,2006,8(6):4.
[11]李宗友.蔓荆子黄索对体外鼠性淋巴细胞增殖和细胞株生长的抑制作用[J].国外医学中医中药分册,1999,21(6):36.

